2022-2023学年人教版2019高中化学必修1 第一章 物质及其变化 第三节 微专题2 氧化还原反应中的四种规律 课件(29张PPT)
文档属性
| 名称 | 2022-2023学年人教版2019高中化学必修1 第一章 物质及其变化 第三节 微专题2 氧化还原反应中的四种规律 课件(29张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 272.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-22 16:28:45 | ||
图片预览








文档简介
(共29张PPT)
微专题2
WEIZHUANTIER
氧化还原反应中的四种规律
第一章
1.守恒规律
氧化还原反应中,原子得失电子总数相等,元素化合价升降总数相等,即有关系式:
还原剂失电子的总数=氧化剂得电子的总数。
元素化合价降低的总数=元素化合价升高的总数。
应用:氧化还原反应方程式的配平,氧化还原反应的相关计算。
(1)在一定条件下,PbO2与Cr3+反应,产物是 和Pb2+,则Cr3+与PbO2反应的化学计量数之比为______。
(2)已知Na2SO3溶液能与K2Cr2O7溶液发生氧化还原反应,且Na2SO3被氧化为Na2SO4,Na2SO3与K2Cr2O7反应的化学计量数之比为3∶1,则铬元素在还原产物中的化合价为____。
例1
2∶3
+3
第一步:标变价元素的化合价,找出氧化剂、还原剂及相应的还原产物和氧化产物;
第二步:找准一个原子或离子的得失电子数(注意化学式中粒子的个数);
第三步:根据氧化剂个数×变价原子个数×化合价变化值(高价-低价)=还原剂个数×变价原子个数×化合价变化值(高价-低价)进行计算。
2.价态规律
(1)高低规律
元素处于最高价态时,只有氧化性;元素处于中间价态时,既有氧化性又有还原性;元素处于最低价态时,只有还原性,即“高价氧,低价还,中间价态两边转”。
应用:判断物质的氧化性、还原性。
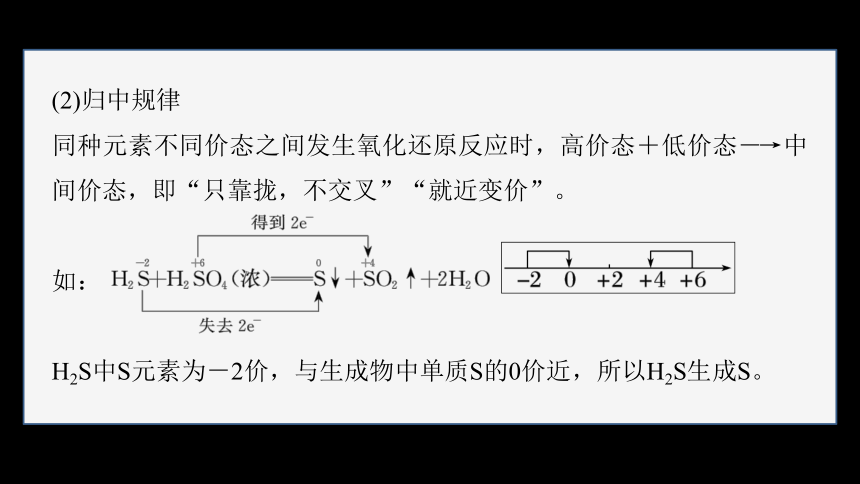
(2)归中规律
同种元素不同价态之间发生氧化还原反应时,高价态+低价态―→中间价态,即“只靠拢,不交叉”“就近变价”。
如:
H2S中S元素为-2价,与生成物中单质S的0价近,所以H2S生成S。
(3)歧化规律
氧化还原反应中,有原子化合价升高,必然有原子化合价 。某物质发生歧化反应时,中间价态―→高价态+低价态。
(4)同种元素相邻价态不发生氧化还原反应规律
如Fe3+和Fe2+不反应,H2SO4和SO2不反应等。
降低
(1)已知氯元素有-1、0、+1、+3、+5、+7价等多种常见化合价,氯气跟氢氧化钾溶液在一定条件下发生如下反应:
①Cl2+KOH―→KX+KY+H2O(未配平)。
②KX―→KY+KZ(氯元素歧化反应,未配平),KX、KY、KZ均是含氯元素的钾盐,Cl元素在a.KX、b.KY、c.KZ中的价态由高到低的顺序是_____(填字母)。
例2
cab
(2)已知氮元素有多种可变化合价,常见的有-3、+2、+3、+4、+5价等。某同学写出以下三个化学方程式(未配平):
①NO+HNO3―→N2O3+H2O
②NH3+NO―→HNO2+H2O
③N2O4+H2O―→HNO3+HNO2
根据价态规律,判断上述反应是否有可能实现,说明判断的理由。
答案 ①可能,反应物中的氮元素为+2价、+5价,生成物中为+3价,符合归中反应规律。
②不可能,反应物中的氮元素为-3价、+2价,生成物中为+3价,N元素的化合价只升不降。
③可能,反应物中的氮元素为+4价,生成物中为+3价、+5价,符合歧化反应规律。
3.强弱规律
还原剂 + 氧化剂===氧化产物 + 还原产物
(强还原性) (强氧化性) (弱氧化性) (弱还原性)
还原性:还原剂>还原产物;氧化性:氧化剂>氧化产物。即“强制弱”或“前强后弱”。
应用:物质间氧化性(或还原性)强弱的比较或判断氧化剂(或还原剂)和有还原性(或氧化性)的物质在一定条件下能否发生反应。
已知下列反应:
①Cl2+2NaBr===2NaCl+Br2
②2KI+Br2===2KBr+I2
③Na2S+I2===2NaI+S↓
(1)Cl-、Br-、I-、S2-的还原性由强到弱的顺序是________________。
例3
S2->I->Br->Cl-
根据同一氧化还原反应中还原剂的还原性强于还原产物的还原性,由反应①知还原性:Br->Cl-,由反应②知还原性:I->Br-,由反应③知还原性:S2->I-,即还原性:S2->I->Br->Cl-。
(2)Cl2、Br2、I2、S的氧化性由强到弱的顺序是_____________。
Cl2>Br2>I2>S
根据同一氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性知,由①得氧化性:Cl2>Br2,由②得氧化性:Br2>I2,由③得氧化性:I2>S,故氧化性由强到弱的顺序为Cl2>Br2>I2>S。
(3)判断Cl2与Na2S能否反应?____(填“能”或“否”)。
能
由(2)知氧化性:Cl2>S,故Cl2与Na2S能发生反应:Cl2+Na2S===
2NaCl+S↓。
(4)判断I2与NaCl能否共存?____(填“能”或“否”)。
能
氧化性:Cl2>I2,则I2与NaCl不能反应,故I2与NaCl可以共存。
4.先后规律
(1)同一氧化剂与多种还原剂混合时,还原性强的先被氧化。例如,已知还原性:I->Fe2+>Br-,当把氯气通入FeBr2溶液时,因为还原性:Fe2+>Br-,所以氯气的量不足时首先氧化Fe2+;把氯气通入FeI2溶液时,因为还原性:I->Fe2+,所以氯气的量不足时首先氧化I-。
(2)同一还原剂与多种氧化剂混合时,氧化性强的先被还原。例如,在含有Fe3+、Cu2+、H+的溶液中加入铁粉,因为氧化性:Fe3+>Cu2+>H+,所以铁粉先与Fe3+反应,然后再依次与Cu2+、H+反应。
应用:判断物质的氧化性、还原性强弱或判断反应的先后顺序。
向AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后,有金属析出,过滤、洗涤后往滤渣中加入稀盐酸,有无色气体放出,则滤液中一定存在
A.Fe2+ B.Cu2+、Fe2+
C.Ag+、Fe2+ D.Ag+、Cu2+、Fe2+
例4
√
在金属活动性顺序中,活泼性:Fe>H>Cu>Ag,往滤渣中加入稀盐酸,有无色气体放出,则说明滤渣中含有铁,铁能与硝酸银反应生成硝酸亚铁和银,能与硝酸铜反应生成硝酸亚铁和铜,当有铁剩余时,说明硝酸铜和硝酸银全部参加反应,滤液中无硝酸铜和硝酸银,只有生成的硝酸亚铁。
1
2
3
4
1.(2021·新疆师范大学附属中学高一检测)反应3NO2+H2O===2HNO3+NO中,当有2e-转移时,被氧化的物质与被还原的物质的个数比是
A.1∶1 B.2∶1 C.1∶2 D.3∶1
5
6
√
在反应3NO2+H2O===2HNO3+NO中,NO2既做还原剂又做氧化剂,每3 mol NO2发生反应,有2 mol NO2失去电子被氧化为HNO3,有1 mol NO2得到电子被还原成NO,反应过程中转移2 mol电子,则当有2e-转移时,被氧化的物质与被还原的物质的个数比是2∶1。
1
2
3
4
2.下列微粒只有还原性的是
A.H+ B.Fe2+ C.Zn D.HCl
5
6
√
只有还原性的元素应处于最低价。金属单质0价就是最低价。HCl中虽然Cl为-1价,为最低价,但是H为+1价,为最高价,有氧化性。
3.已知在热的碱性溶液中,NaClO发生如下反应:3NaClO===2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是
A.NaCl、NaClO B.NaCl、NaClO3
C.NaClO、NaClO3 D.NaClO3、NaClO4
1
2
3
4
5
6
√
1
2
3
4
5
6
已知反应中氯元素的化合价:+1价升高到+5价和降低到-1价,符合邻位转化规律。既然NaClO2也能发生类似的反应,则氯元素的化合价应既有升高,也有降低,A中氯元素化合价均降低,D中氯元素化合价均升高;
B、C与题意相符,根据已知反应可知,C中NaClO不是最终产物,故B正确。
1
2
3
4
4.关于反应K2H3IO6+9HI===2KI+4I2+6H2O,下列说法正确的是
A.K2H3IO6发生氧化反应
B.KI是还原产物
C.生成4个 I2时,转移7个电子
D.还原剂与氧化剂的数目之比为1∶7
5
6
√
1
2
3
4
反应中K2H3IO6中的I元素得电子,化合价降低,发生还原反应,A错误;
KI既不是氧化产物也不是还原产物,B错误;
每生成4个 I2转移7个电子,C正确;
反应中HI为还原剂,K2H3IO6为氧化剂,在反应中每消耗1个K2H3IO6就有7个HI失电子,则还原剂与氧化剂的数目之比为7∶1,D错误。
5
6
1
2
3
4
5.(2022·广东普宁第二中学高一检测)稀硫酸中几种离子的转化关系如图所示。下列说法正确的是
A.反应1中氧化剂是Mn3+
B.氧化性:Mn3+>Ce4+>Fe3+>I2
C.能发生反应:2Mn3++2I-===I2
+2Mn2+
D.反应2的还原产物为Fe3+
5
6
√
1
2
3
4
由图像可知,反应1为Ce4++Mn2+===Ce3++Mn3+,反应2为Mn3++Fe2+===Mn2++Fe3+,反应3为2Fe3+
5
6
+2I-===2Fe2++I2。反应1中的氧化剂为Ce4+,Mn3+是氧化产物,A错误;
氧化剂的氧化性强于氧化产物的氧化性,由反应1可知氧化性:Ce4+>Mn3+,由反应2可知氧化性:Mn3+>Fe3+,由反应3可知氧化性:Fe3+>I2,故有氧化性:Ce4+>Mn3+>Fe3+>I2,B错误;
1
2
3
4
氧化性:Mn3+>I2,因此可以发生反应:2Mn3++2I-===I2+2Mn2+,C正确;
5
6
反应2为Mn3++Fe2+===Mn2++Fe3+,还原产物为Mn2+,D错误。
1
2
3
4
6.多种氧化剂和还原剂相遇时,存在“争先恐后,强者优先”的现象。请预测,在含FeCl2、MgCl2和HCl的溶液中加入适量Zn粉,首先置换出来的是
A.Fe B.H2 C.Mg D.不能确定
5
6
√
氧化性:H+>Fe2+>Zn2+>Mg2+,所以Zn粉先跟氧化性最强的H+发生置换反应,然后再与Fe2+发生置换反应。
本课结束
第一章
微专题2
WEIZHUANTIER
氧化还原反应中的四种规律
第一章
1.守恒规律
氧化还原反应中,原子得失电子总数相等,元素化合价升降总数相等,即有关系式:
还原剂失电子的总数=氧化剂得电子的总数。
元素化合价降低的总数=元素化合价升高的总数。
应用:氧化还原反应方程式的配平,氧化还原反应的相关计算。
(1)在一定条件下,PbO2与Cr3+反应,产物是 和Pb2+,则Cr3+与PbO2反应的化学计量数之比为______。
(2)已知Na2SO3溶液能与K2Cr2O7溶液发生氧化还原反应,且Na2SO3被氧化为Na2SO4,Na2SO3与K2Cr2O7反应的化学计量数之比为3∶1,则铬元素在还原产物中的化合价为____。
例1
2∶3
+3
第一步:标变价元素的化合价,找出氧化剂、还原剂及相应的还原产物和氧化产物;
第二步:找准一个原子或离子的得失电子数(注意化学式中粒子的个数);
第三步:根据氧化剂个数×变价原子个数×化合价变化值(高价-低价)=还原剂个数×变价原子个数×化合价变化值(高价-低价)进行计算。
2.价态规律
(1)高低规律
元素处于最高价态时,只有氧化性;元素处于中间价态时,既有氧化性又有还原性;元素处于最低价态时,只有还原性,即“高价氧,低价还,中间价态两边转”。
应用:判断物质的氧化性、还原性。
(2)归中规律
同种元素不同价态之间发生氧化还原反应时,高价态+低价态―→中间价态,即“只靠拢,不交叉”“就近变价”。
如:
H2S中S元素为-2价,与生成物中单质S的0价近,所以H2S生成S。
(3)歧化规律
氧化还原反应中,有原子化合价升高,必然有原子化合价 。某物质发生歧化反应时,中间价态―→高价态+低价态。
(4)同种元素相邻价态不发生氧化还原反应规律
如Fe3+和Fe2+不反应,H2SO4和SO2不反应等。
降低
(1)已知氯元素有-1、0、+1、+3、+5、+7价等多种常见化合价,氯气跟氢氧化钾溶液在一定条件下发生如下反应:
①Cl2+KOH―→KX+KY+H2O(未配平)。
②KX―→KY+KZ(氯元素歧化反应,未配平),KX、KY、KZ均是含氯元素的钾盐,Cl元素在a.KX、b.KY、c.KZ中的价态由高到低的顺序是_____(填字母)。
例2
cab
(2)已知氮元素有多种可变化合价,常见的有-3、+2、+3、+4、+5价等。某同学写出以下三个化学方程式(未配平):
①NO+HNO3―→N2O3+H2O
②NH3+NO―→HNO2+H2O
③N2O4+H2O―→HNO3+HNO2
根据价态规律,判断上述反应是否有可能实现,说明判断的理由。
答案 ①可能,反应物中的氮元素为+2价、+5价,生成物中为+3价,符合归中反应规律。
②不可能,反应物中的氮元素为-3价、+2价,生成物中为+3价,N元素的化合价只升不降。
③可能,反应物中的氮元素为+4价,生成物中为+3价、+5价,符合歧化反应规律。
3.强弱规律
还原剂 + 氧化剂===氧化产物 + 还原产物
(强还原性) (强氧化性) (弱氧化性) (弱还原性)
还原性:还原剂>还原产物;氧化性:氧化剂>氧化产物。即“强制弱”或“前强后弱”。
应用:物质间氧化性(或还原性)强弱的比较或判断氧化剂(或还原剂)和有还原性(或氧化性)的物质在一定条件下能否发生反应。
已知下列反应:
①Cl2+2NaBr===2NaCl+Br2
②2KI+Br2===2KBr+I2
③Na2S+I2===2NaI+S↓
(1)Cl-、Br-、I-、S2-的还原性由强到弱的顺序是________________。
例3
S2->I->Br->Cl-
根据同一氧化还原反应中还原剂的还原性强于还原产物的还原性,由反应①知还原性:Br->Cl-,由反应②知还原性:I->Br-,由反应③知还原性:S2->I-,即还原性:S2->I->Br->Cl-。
(2)Cl2、Br2、I2、S的氧化性由强到弱的顺序是_____________。
Cl2>Br2>I2>S
根据同一氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性知,由①得氧化性:Cl2>Br2,由②得氧化性:Br2>I2,由③得氧化性:I2>S,故氧化性由强到弱的顺序为Cl2>Br2>I2>S。
(3)判断Cl2与Na2S能否反应?____(填“能”或“否”)。
能
由(2)知氧化性:Cl2>S,故Cl2与Na2S能发生反应:Cl2+Na2S===
2NaCl+S↓。
(4)判断I2与NaCl能否共存?____(填“能”或“否”)。
能
氧化性:Cl2>I2,则I2与NaCl不能反应,故I2与NaCl可以共存。
4.先后规律
(1)同一氧化剂与多种还原剂混合时,还原性强的先被氧化。例如,已知还原性:I->Fe2+>Br-,当把氯气通入FeBr2溶液时,因为还原性:Fe2+>Br-,所以氯气的量不足时首先氧化Fe2+;把氯气通入FeI2溶液时,因为还原性:I->Fe2+,所以氯气的量不足时首先氧化I-。
(2)同一还原剂与多种氧化剂混合时,氧化性强的先被还原。例如,在含有Fe3+、Cu2+、H+的溶液中加入铁粉,因为氧化性:Fe3+>Cu2+>H+,所以铁粉先与Fe3+反应,然后再依次与Cu2+、H+反应。
应用:判断物质的氧化性、还原性强弱或判断反应的先后顺序。
向AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后,有金属析出,过滤、洗涤后往滤渣中加入稀盐酸,有无色气体放出,则滤液中一定存在
A.Fe2+ B.Cu2+、Fe2+
C.Ag+、Fe2+ D.Ag+、Cu2+、Fe2+
例4
√
在金属活动性顺序中,活泼性:Fe>H>Cu>Ag,往滤渣中加入稀盐酸,有无色气体放出,则说明滤渣中含有铁,铁能与硝酸银反应生成硝酸亚铁和银,能与硝酸铜反应生成硝酸亚铁和铜,当有铁剩余时,说明硝酸铜和硝酸银全部参加反应,滤液中无硝酸铜和硝酸银,只有生成的硝酸亚铁。
1
2
3
4
1.(2021·新疆师范大学附属中学高一检测)反应3NO2+H2O===2HNO3+NO中,当有2e-转移时,被氧化的物质与被还原的物质的个数比是
A.1∶1 B.2∶1 C.1∶2 D.3∶1
5
6
√
在反应3NO2+H2O===2HNO3+NO中,NO2既做还原剂又做氧化剂,每3 mol NO2发生反应,有2 mol NO2失去电子被氧化为HNO3,有1 mol NO2得到电子被还原成NO,反应过程中转移2 mol电子,则当有2e-转移时,被氧化的物质与被还原的物质的个数比是2∶1。
1
2
3
4
2.下列微粒只有还原性的是
A.H+ B.Fe2+ C.Zn D.HCl
5
6
√
只有还原性的元素应处于最低价。金属单质0价就是最低价。HCl中虽然Cl为-1价,为最低价,但是H为+1价,为最高价,有氧化性。
3.已知在热的碱性溶液中,NaClO发生如下反应:3NaClO===2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是
A.NaCl、NaClO B.NaCl、NaClO3
C.NaClO、NaClO3 D.NaClO3、NaClO4
1
2
3
4
5
6
√
1
2
3
4
5
6
已知反应中氯元素的化合价:+1价升高到+5价和降低到-1价,符合邻位转化规律。既然NaClO2也能发生类似的反应,则氯元素的化合价应既有升高,也有降低,A中氯元素化合价均降低,D中氯元素化合价均升高;
B、C与题意相符,根据已知反应可知,C中NaClO不是最终产物,故B正确。
1
2
3
4
4.关于反应K2H3IO6+9HI===2KI+4I2+6H2O,下列说法正确的是
A.K2H3IO6发生氧化反应
B.KI是还原产物
C.生成4个 I2时,转移7个电子
D.还原剂与氧化剂的数目之比为1∶7
5
6
√
1
2
3
4
反应中K2H3IO6中的I元素得电子,化合价降低,发生还原反应,A错误;
KI既不是氧化产物也不是还原产物,B错误;
每生成4个 I2转移7个电子,C正确;
反应中HI为还原剂,K2H3IO6为氧化剂,在反应中每消耗1个K2H3IO6就有7个HI失电子,则还原剂与氧化剂的数目之比为7∶1,D错误。
5
6
1
2
3
4
5.(2022·广东普宁第二中学高一检测)稀硫酸中几种离子的转化关系如图所示。下列说法正确的是
A.反应1中氧化剂是Mn3+
B.氧化性:Mn3+>Ce4+>Fe3+>I2
C.能发生反应:2Mn3++2I-===I2
+2Mn2+
D.反应2的还原产物为Fe3+
5
6
√
1
2
3
4
由图像可知,反应1为Ce4++Mn2+===Ce3++Mn3+,反应2为Mn3++Fe2+===Mn2++Fe3+,反应3为2Fe3+
5
6
+2I-===2Fe2++I2。反应1中的氧化剂为Ce4+,Mn3+是氧化产物,A错误;
氧化剂的氧化性强于氧化产物的氧化性,由反应1可知氧化性:Ce4+>Mn3+,由反应2可知氧化性:Mn3+>Fe3+,由反应3可知氧化性:Fe3+>I2,故有氧化性:Ce4+>Mn3+>Fe3+>I2,B错误;
1
2
3
4
氧化性:Mn3+>I2,因此可以发生反应:2Mn3++2I-===I2+2Mn2+,C正确;
5
6
反应2为Mn3++Fe2+===Mn2++Fe3+,还原产物为Mn2+,D错误。
1
2
3
4
6.多种氧化剂和还原剂相遇时,存在“争先恐后,强者优先”的现象。请预测,在含FeCl2、MgCl2和HCl的溶液中加入适量Zn粉,首先置换出来的是
A.Fe B.H2 C.Mg D.不能确定
5
6
√
氧化性:H+>Fe2+>Zn2+>Mg2+,所以Zn粉先跟氧化性最强的H+发生置换反应,然后再与Fe2+发生置换反应。
本课结束
第一章
