2022-2023学年人教版2019高中化学必修1 第一章 物质及其变化 第二节 第1课时 电解质的电离 课件(66张PPT)
文档属性
| 名称 | 2022-2023学年人教版2019高中化学必修1 第一章 物质及其变化 第二节 第1课时 电解质的电离 课件(66张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-22 16:33:45 | ||
图片预览









文档简介
(共66张PPT)
第1课时
DIYIKESHI
电解质及其导电性 / 电解质的电离 / 随堂演练 知识落实 / 课时对点练
电解质的电离
第一章
核心素养
发展目标
1.能从宏观和微观的角度理解电解质的概念,了解常见的电解质,会正确判断电解质与非电解质。
2.知道酸、碱、盐在水溶液中或熔融状态下能发生电离,并会用电离方程式表示。能从电离的角度认识酸、碱、盐的概念及各自的通性。
内容索引
一、电解质及其导电性
二、电解质的电离
随堂演练 知识落实
课时对点练
电解质及其导电性
一
1.物质的导电性实验探究
(1)实验操作:将如图装置中的样品依次更换为NaCl固体、KNO3固体、蒸馏水、NaCl溶液、KNO3溶液。
(3)导电原因分析:物质导电必须具有能 、 的粒子。
①NaCl固体、KNO3固体不导电的原因是固体中含有阴、阳离子,但这些离子不能 。
②NaCl溶液、KNO3溶液导电的原因是__________________________
。
自由移动
带电荷
自由移动
在水溶液中,存在着能自由移
动的、带电荷的粒子
③NaCl固体受热熔化时,因温度升高,离子的运动加快,克服了离子间的相互作用,产生了能够 的Na+与Cl-,所以熔融状态的NaCl可以 。
结论:化合物在 或 下能产生自由移动的离子。
自由移动
导电
水溶液
熔融状态
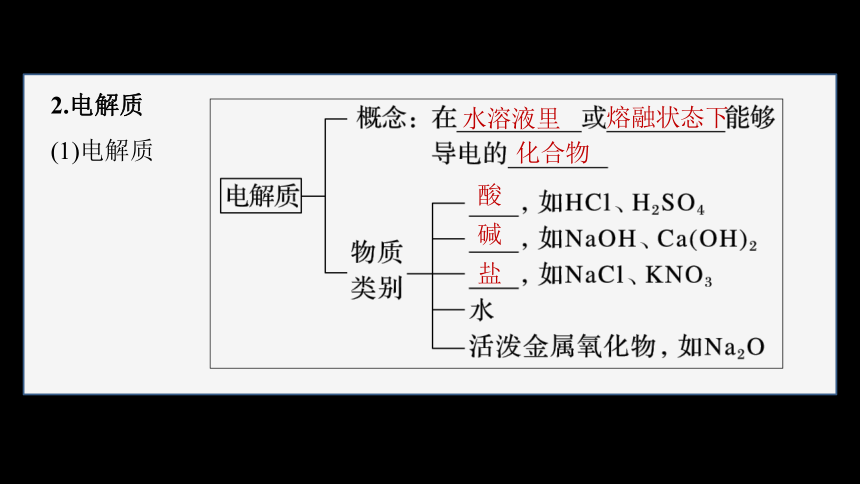
2.电解质
(1)电解质
酸
碱
盐
水溶液里
熔融状态下
化合物
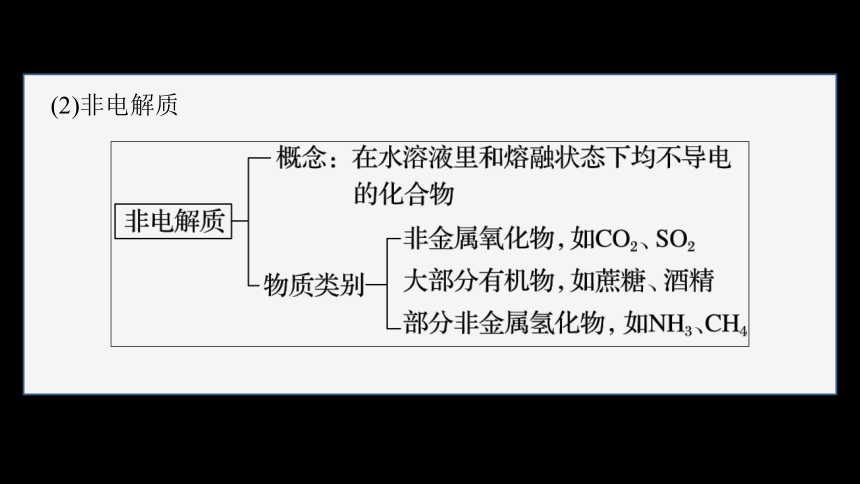
(2)非电解质
(1)铜丝、NaCl溶液和盐酸都能导电,所以三者都是电解质( )
(2)NH3、CO2的水溶液都能导电,所以NH3、CO2均是电解质( )
(3)NaCl是电解质,所以NaCl固体可以导电( )
(4)BaSO4难溶于水,其水溶液几乎不导电,所以BaSO4不是电解质( )
(5)HCl溶于水后能导电,但熔融状态下不导电( )
×
×
×
√
正误判断
×
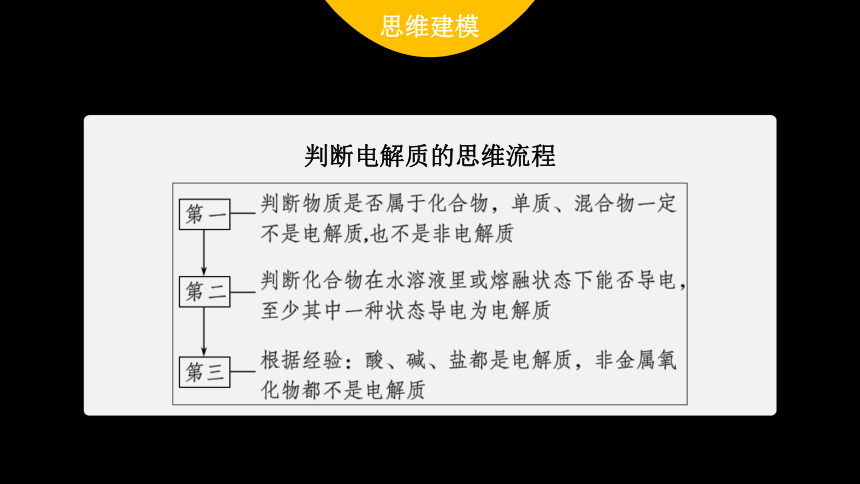
思维建模
判断电解质的思维流程
1.金属导电和电解质溶液导电的原理分别是什么?
深度思考
提示 金属导电是因为金属中存在自由电子,在电场中作定向移动而导电;而电解质溶液导电是阴、阳离子的定向移动形成电流而导电。
2.现有下列物质:①蔗糖 ②熔融NaCl ③HCl的水溶液 ④Fe
⑤NaOH固体 ⑥SO2的水溶液 ⑦NH3 ⑧SO3 ⑨氨水 ⑩液态H2SO4
请思考回答下列问题:
(1)上述状态下可导电的是___________(填序号,下同)。
(2)属于电解质的是_______。
(3)属于非电解质的是________。
(4)上述状态下的电解质不能导电的是_____。
深度思考
②③④⑥⑨
②⑤⑩
①⑦⑧
⑤⑩
(5)若SO2的水溶液导电能说明SO2是电解质吗?为什么?
深度思考
答案 不能,因为SO2不是电解质,SO2溶于水生成了H2SO3,H2SO3电离使水溶液导电而非SO2自身电离。
归纳总结
(1)电解质与导电性的关系
①有些电解质溶于水能导电,在熔融状态下不能导电,如HCl、H2SO4等。
②有些电解质只在熔融状态下能导电,如BaSO4、CaCO3等。
③能导电的物质不一定是电解质,如金属、石墨、盐酸等,电解质本身也不一定能导电,如NaCl固体、HCl气体等。
归纳总结
④溶于水能导电的化合物本身不一定是电解质,如SO2、NH3等。
(2)电解质与溶解性的关系
电解质不一定易溶于水(如硫酸钡等),易溶于水的化合物不一定是电解质(如酒精等)。
返回
电解质的电离
二
1.电解质的电离
(1)电离:电解质 或 时,形成 的 的过程。
(2)电离方程式(表示方法)
①含义:表示电解质电离的式子。
②书写要求:左边写电解质的化学式,右边写电离出的离子。
③实例:HCl=== ;
NaCl=== ;
Ba(OH)2=== 。
溶于水
受热熔化
自由移动
离子
H++Cl-
Na++Cl-
Ba2++2OH-
2.从电离角度认识酸、碱、盐
全部是H+
KOH===K++OH-
Ca(OH)2===Ca2++2OH-
全部是OH-
金属阳离子(或铵根离子)
酸根离子
(1)电解质发生电离,是在通电条件下才发生的( )
(2)KHSO4在水溶液中可以电离出H+,所以KHSO4属于酸( )
(3)液态硫酸无法电离,只有在溶于水形成水溶液时才发生电离( )
(4)盐中不一定含有金属元素( )
√
×
√
正误判断
×
1.判断下列物质在水溶液中的电离方程式是否正确,不正确的加以改正。
________________________________。
(2)Ba(OH)2===Ba2++(OH-)2
_____________________________________。
__________________________________。
深度思考
不正确;改正:Ba(OH)2===Ba2++2OH-
______________________________________。
深度思考
2.NaHSO4通常为晶体,易溶于水,它溶于水时电离出三种不同的离子,溶液显酸性。NaHSO4受热熔化时只能电离出两种不同的离子。
(1)NaHSO4在水溶液中的电离方程式为__________________________。
(2)NaHSO4在熔融状态下的电离方程式为___________________________。
(3)下列说法正确的是____(填字母)。
a.NaHSO4属于酸 b.NaHSO4属于盐
c.NaHSO4属于电解质 d.NaHSO4溶液能与Zn反应生成氢气
深度思考
bcd
3.已知溶液的导电性强弱由溶液中离子浓度的大小及离子所带电荷数决定。离子浓度越大,所带电荷数越多,则溶液导电性越强。某兴趣小组同学做了以下实验:
(1)在如图所示的装置里,若灯泡亮,广口瓶内
的物质A可以是__________(填序号)。
①干燥的氯化钠晶体 ②干燥的氢氧化钠晶体
③蔗糖晶体 ④酒精 ⑤氯化钠溶液 ⑥氢氧
化钠溶液 ⑦稀盐酸 ⑧硫酸铜溶液
深度思考
⑤⑥⑦⑧
干燥的氯化钠晶体、氢氧化钠晶体虽由离子构成,但离子不能自由移动,所以不能导电,两者溶于水后,在水分子的作用下,电离成自由移动的阴、阳离子(实为水合离子),所以二者的水溶液能导电;蔗糖由分子构成,不能导电;酒精也不能导电。
(2)在电解质溶液的导电性实验装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是___
(填字母)。
A.盐酸中逐滴加入食盐溶液
B.硫酸中逐滴加入氢氧化钠溶液
C.石灰乳中滴加稀盐酸
D.硫酸中逐滴加入氢氧化钡溶液
深度思考
D
溶液能否导电,取决于溶液中是否有离子存在;导电性强弱则由离子浓度大小等因素决定。D选项中,发生反应:H2SO4+Ba(OH)2===BaSO4↓+2H2O,溶液中离子浓度减小,恰好完全反应时,溶液中几乎没有离子,此过程灯泡由亮变暗直至熄灭,继续滴加Ba(OH)2溶液,溶液中Ba2+、OH-数目增多,导电能力增强,灯泡又逐渐变亮。
易错警示
(1)理解酸、碱概念时注意“全部”两个字,如NaHSO4、Cu2(OH)2CO3虽能电离产生H+、OH-,但都属于盐。
(2)盐中不一定含有金属元素,如NH4Cl。
易错警示
(3)电离方程式书写时注意:
①质量与电荷要守恒。
②原子团不能拆开,如 在水溶液中拆开,在熔融状态下不拆开。
③正确标注离子所带的电荷及其数目。
(4)溶液能否导电,取决于溶液中是否有自由移动的离子存在;溶液的导电性强弱则由离子浓度大小及离子所带电荷数决定。
返回
随堂演练 知识落实
1.(2022·河南开封高一质检)下列叙述正确的是
A.凡能电离出H+的化合物均属于酸
B.NaCl溶于水,在通电条件下才能发生电离
C.铜丝、石墨均能导电,所以它们都是电解质
D.熔融的MgCl2能导电,所以MgCl2是电解质
√
1
2
3
4
1
2
3
4
硫酸氢钠在水溶液中电离生成钠离子、氢离子、硫酸根离子,属于盐,故A错误;
NaCl溶于水,在水分子的作用下发生电离,不需要通电,故B错误;
铜丝、石墨是单质,既不是电解质也不是非电解质,故C错误;
熔融的MgCl2能导电且是化合物,所以MgCl2是电解质,故D正确。
2.下列各组关于电解质、非电解质的归类,完全正确的是
1
2
3
4
选项 A B C D
电解质 Fe NaCl溶液 CaCO3 HNO3
非电解质 C12H22O11(蔗糖) BaSO4 SO2 H2O
√
A项,Fe是单质,既不是电解质,也不是非电解质,错误;
B项,NaCl溶液是混合物,既不是电解质,也不是非电解质,BaSO4虽难溶于水,但BaSO4是盐,属于电解质,错误;
D项,H2O是电解质,错误。
1
2
3
4
3.(2022·广东揭西高一测试)下列电解质在水溶液中的电离方程式书写错误的是
1
2
3
4
√
4.现有中学化学中常见的八种物质:
①固体氢氧化钡 ②石墨棒 ③纯醋酸 ④液态氯化氢 ⑤硫酸氢钾固体 ⑥熔融氯化钠 ⑦蔗糖 ⑧碳酸钠粉末
请用序号填空:
(1)上述状态下可导电的是_____,属于非电解质的是____。
(2)属于酸的是_____,属于碱的是____,属于盐的是________。
1
2
3
4
②⑥
⑦
⑤⑥⑧
③④
①
(3)写出①④⑤⑧在水溶液中的电离方程式:
①________________________;
④_________________;
⑤________________________;
⑧______________________。
1
2
3
4
Ba(OH)2===Ba2++2OH-
HCl=== H++Cl-
返回
课时对点练
题组一 电解质及其导电性
1.下列关于电解质和非电解质的说法正确的是
A.它们研究的对象都是化合物 B.它们的水溶液都能导电
C.电解质一定能导电 D.不导电的物质一定是非电解质
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
电解质和非电解质研究的对象都是化合物;非电解质的水溶液不导电;电解质为固体时不能导电;不导电的物质不一定是非电解质。
2.医院里医生给病人做心电图时,在仪器与皮肤接触部位擦的一种电解质溶液是
A.氯化钠溶液 B.医用酒精
C.葡萄糖溶液 D.碘酒
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
氯化钠是电解质,溶于水可以导电;乙醇、葡萄糖为非电解质,碘是单质,既不是电解质也不是非电解质。
3.(2022·广东潮安高一检测)下列说法正确的是
A.蔗糖、酒精在水溶液里和熔融状态时均不导电,所以它们是非电解质
B.液态HCl、固态NaCl均不导电,所以HCl、NaCl 均是非电解质
C.NH3、CO2 的水溶液均能导电,所以NH3、CO2 均是电解质
D.铜、石墨均能导电,所以它们是电解质
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
蔗糖、酒精在水溶液里和熔融状态下均不能导电,说明蔗糖、酒精在两种状态下均不能电离,且二者均为化合物,故属于非电解质,A正确;
液态HCl、固体NaCl均未发生电离,故不导电,但两者均属于电解质,B错误;
NH3、CO2的水溶液虽然能导电,但离子是其溶于水后生成的NH3·H2O、H2CO3电离产生的,故NH3、CO2属于非电解质,C错误;
Cu、石墨属于单质,既不是电解质也不是非电解质,D错误。
4.(2022·河南新乡高一检测)下列物质属于电解质且能导电的是
A.NO气体 B.固态KCl
C.MgCl2溶液 D.熔融的K2O
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
5.(2022·陕西渭南市三贤中学高一检测)下列有关物质分类的正确组合是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
选项 酸 电解质 碱性氧化物 酸性氧化物
A H2SO4 Cu2(OH)2CO3 CaO CO2
B HCl Na2SO4 Na2O CO
C NH3 熔融的氯化钠 MgO SiO2
D HNO3 蔗糖 CuO SO2
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
H2SO4电离出的阳离子只有H+,属于酸,Cu2(OH)2CO3在水溶液中能电离出离子而导电,属于电解质,CaO能与酸反应生成盐和水,为碱性氧化物,CO2能与碱反应生成盐和水,为酸性氧化物,故A正确;
CO不能与碱反应生成盐和水,不属于酸性氧化物,故B错误;
NH3不属于酸,故C错误;
蔗糖在水溶液或熔融状态下都不能导电,属于非电解质,故D错误。
6.某一化学兴趣小组的同学在家中进行实验,按照图A连接好线路,发现灯泡不亮;按照图B连接好线路,发现灯泡亮了。由此得出的以下结论正确的是
A.硝酸钾固体不是电解质
B.硝酸钾溶液是电解质
C.硝酸钾在水溶液中电离出了可以自由移动的离子
D.在硝酸钾溶液中,水电离出了大量的离子
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
硝酸钾是电解质,但硝酸钾固体中因没有可以自由移动的离子而不导电,硝酸钾溶液是混合物,不是电解质。
题组二 电解质的电离
7.下列物质的变化不能产生自由移动的离子的是
A.氢氧化钠溶于水 B.硫酸溶于水
C.氯化钠固体受热熔化 D.蔗糖受热熔化
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
8.下列物质溶于水时,不能电离出酸根离子的是
A.NaNO3 B.Ba(OH)2
C.KMnO4 D.KCl
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
氢氧化钡是碱,电离出的是氢氧根离子,其他三种物质均能电离出酸根离子。
9.下列电离方程式错误的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
10.下列物质只有在水溶液中才导电的电解质是
A.氯化钠 B.二氧化碳 C.乙醇 D.氯化氢
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
氯化钠在水溶液里和熔融状态下都能够导电,故A不符合题意;
二氧化碳是非电解质,溶于水生成碳酸,碳酸溶液能导电,故B不符合题意;
乙醇为非电解质,在水溶液里不导电,故C不符合题意;
氯化氢为电解质,氯化氢不导电,只有在水溶液里才能导电,故D符合题意。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
11.下列说法正确的是
①难溶于水的盐(CaCO3、BaSO4等)都是非电解质
②不是电解质的物质一定是非电解质
③能电离出H+的化合物都是酸
④电解质溶液能导电的原因是溶液中有自由移动的阴离子和阳离子
⑤熔融的电解质都能导电
A.①③⑤ B.②④⑤ C.只有④ D.只有⑤
√
12.(2022·河南焦作高一检测)如图是电解质导电实验装置,接通电源后,下列说法正确的是
A.CuSO4、NaCl均为电解质,灯泡会亮起来
B.在NaCl粉末中加入适量水,灯泡会亮起来
D.将NaCl(s)改为NaCl溶液,在CuSO4溶液中
加入少量NaOH固体,灯泡明显变暗
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
固体氯化钠中无自由移动的离子,不导电,
灯泡不亮,A项错误;
向NaCl粉末中加入适量水,氯化钠溶于水电
离出Na+、Cl-,有自由移动的离子,能导电,
灯泡会亮起来,B项正确;
电解质电离不需要通电,C项错误;
CuSO4+2NaOH===Cu(OH)2↓+Na2SO4,因加入的NaOH为少量,部分Cu2+转化为沉淀,同时有Na+进入溶液,故灯泡亮度基本不变,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
13.下表是常见的几种酸、碱、盐在水溶液中电离出来离子的情况,根据表中信息分析正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
溶质 酸 盐 碱 HCl H2SO4 NaCl NaHSO4 NH4Cl NaOH NH3·H2O
电离出的离子 H+、Cl- H+、 Na+、Cl- Na+、 H+、 、Cl- Na+、OH- 、OH-
A.在水溶液中电离出H+的物质一定是酸
B.在水溶液中电离出金属阳离子和酸根离子的物质一定是盐
C.盐溶液电离出来的阳离子一定是金属离子
D.碱溶液电离出的离子一定是金属阳离子和OH-
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
NaHSO4在水溶液中电离出来的离子有H+,但不属于酸,属于盐,A错误;
盐由金属阳离子(或铵根离子)和酸根离子形成,则在水溶液中电离出金属阳离子和酸根离子的物质一定是盐,B正确、C错误;
NH3·H2O属于碱,在溶液中电离出的阳离子是 ,不是金属阳离子,D错误。
14.1923年丹麦化学家布朗斯特和英国化学家劳里提出了酸碱质子理论,其定义是凡是能够释放质子(H+)的任何含氢原子的分子或离子都是酸;凡是能与质子结合的分子或离子都是碱。按照酸碱质子理论,下列粒子既可以看作酸又可以看作碱的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
按照酸碱质子理论,CH3COO-只能结合H+转化为CH3COOH,属于碱,A错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
OH-只能结合H+转化为H2O,属于碱,C错误;
15.现有下列物质:①Na2CO3·10H2O晶体,②石墨,③无水酒精,④小苏打,⑤NaHSO4固体,⑥Ba(OH)2固体,⑦氨气,⑧稀硝酸,⑨食醋。
(1)按物质的分类方法,填写表格的空白处(填序号):
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
分类标准 能导电的物质 电解质 非电解质 既不是电解质也不是非电解质
属于该类的物质
②⑧⑨ ①④⑤⑥ ③⑦ ②⑧⑨
(2)写出属于电解质的物质在水溶液中的电离方程式:________________
_____________________________________________________________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
Na2CO3·10H2O===
(3)写出属于酸式盐的两种物质在水溶液中反应的化学方程式:________
_________________________________。
NaHCO3
+NaHSO4===Na2SO4+CO2↑+H2O
16.已知Ca(OH)2、CaCO3、Ca(HCO3)2都是电解质,CO2+H2O+CaCO3===Ca(HCO3)2,Ca(HCO3)2可溶于水。测定溶液的导电能力的实验装置如图:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(1)将实验现象填在下表空格中。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
实验操作 灯泡亮度变化
通入CO2以前
开始通入CO2时
恰好完全沉淀
沉淀完全后,继续通入过量的CO2
亮
由亮变暗
熄灭
又变亮
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
通入CO2之前,澄清石灰水中有Ca2+和OH-,故灯泡亮;
通入CO2时,由于发生CO2+Ca(OH)2===CaCO3↓+H2O,
溶液中离子浓度减小,所以灯泡变暗;
继续通入CO2使Ca2+恰好完全沉淀时,液体为水,导电
性非常弱,灯泡熄灭;
继续通入CO2发生反应:CO2+H2O+CaCO3===Ca(HCO3)2,Ca(HCO3)2电离出Ca2+和 ,离子浓度增大,故灯泡又变亮。
(2)下列四个图中,____(填字母)能比较准确地反映出溶液的导电能力和通入CO2气体量的关系(x轴表示CO2通入的量,y轴表示导电能力)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
D
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由于通入CO2后溶液中自由移动的离子的浓度逐渐减小,所以一开始导电能力逐渐下降,随着反应的进行,离子浓度逐渐增大,导电能力也逐渐增大,当反应进行完全后,溶液导电能力基本保持不变,所以选D。
返回
第1课时
DIYIKESHI
电解质及其导电性 / 电解质的电离 / 随堂演练 知识落实 / 课时对点练
电解质的电离
第一章
核心素养
发展目标
1.能从宏观和微观的角度理解电解质的概念,了解常见的电解质,会正确判断电解质与非电解质。
2.知道酸、碱、盐在水溶液中或熔融状态下能发生电离,并会用电离方程式表示。能从电离的角度认识酸、碱、盐的概念及各自的通性。
内容索引
一、电解质及其导电性
二、电解质的电离
随堂演练 知识落实
课时对点练
电解质及其导电性
一
1.物质的导电性实验探究
(1)实验操作:将如图装置中的样品依次更换为NaCl固体、KNO3固体、蒸馏水、NaCl溶液、KNO3溶液。
(3)导电原因分析:物质导电必须具有能 、 的粒子。
①NaCl固体、KNO3固体不导电的原因是固体中含有阴、阳离子,但这些离子不能 。
②NaCl溶液、KNO3溶液导电的原因是__________________________
。
自由移动
带电荷
自由移动
在水溶液中,存在着能自由移
动的、带电荷的粒子
③NaCl固体受热熔化时,因温度升高,离子的运动加快,克服了离子间的相互作用,产生了能够 的Na+与Cl-,所以熔融状态的NaCl可以 。
结论:化合物在 或 下能产生自由移动的离子。
自由移动
导电
水溶液
熔融状态
2.电解质
(1)电解质
酸
碱
盐
水溶液里
熔融状态下
化合物
(2)非电解质
(1)铜丝、NaCl溶液和盐酸都能导电,所以三者都是电解质( )
(2)NH3、CO2的水溶液都能导电,所以NH3、CO2均是电解质( )
(3)NaCl是电解质,所以NaCl固体可以导电( )
(4)BaSO4难溶于水,其水溶液几乎不导电,所以BaSO4不是电解质( )
(5)HCl溶于水后能导电,但熔融状态下不导电( )
×
×
×
√
正误判断
×
思维建模
判断电解质的思维流程
1.金属导电和电解质溶液导电的原理分别是什么?
深度思考
提示 金属导电是因为金属中存在自由电子,在电场中作定向移动而导电;而电解质溶液导电是阴、阳离子的定向移动形成电流而导电。
2.现有下列物质:①蔗糖 ②熔融NaCl ③HCl的水溶液 ④Fe
⑤NaOH固体 ⑥SO2的水溶液 ⑦NH3 ⑧SO3 ⑨氨水 ⑩液态H2SO4
请思考回答下列问题:
(1)上述状态下可导电的是___________(填序号,下同)。
(2)属于电解质的是_______。
(3)属于非电解质的是________。
(4)上述状态下的电解质不能导电的是_____。
深度思考
②③④⑥⑨
②⑤⑩
①⑦⑧
⑤⑩
(5)若SO2的水溶液导电能说明SO2是电解质吗?为什么?
深度思考
答案 不能,因为SO2不是电解质,SO2溶于水生成了H2SO3,H2SO3电离使水溶液导电而非SO2自身电离。
归纳总结
(1)电解质与导电性的关系
①有些电解质溶于水能导电,在熔融状态下不能导电,如HCl、H2SO4等。
②有些电解质只在熔融状态下能导电,如BaSO4、CaCO3等。
③能导电的物质不一定是电解质,如金属、石墨、盐酸等,电解质本身也不一定能导电,如NaCl固体、HCl气体等。
归纳总结
④溶于水能导电的化合物本身不一定是电解质,如SO2、NH3等。
(2)电解质与溶解性的关系
电解质不一定易溶于水(如硫酸钡等),易溶于水的化合物不一定是电解质(如酒精等)。
返回
电解质的电离
二
1.电解质的电离
(1)电离:电解质 或 时,形成 的 的过程。
(2)电离方程式(表示方法)
①含义:表示电解质电离的式子。
②书写要求:左边写电解质的化学式,右边写电离出的离子。
③实例:HCl=== ;
NaCl=== ;
Ba(OH)2=== 。
溶于水
受热熔化
自由移动
离子
H++Cl-
Na++Cl-
Ba2++2OH-
2.从电离角度认识酸、碱、盐
全部是H+
KOH===K++OH-
Ca(OH)2===Ca2++2OH-
全部是OH-
金属阳离子(或铵根离子)
酸根离子
(1)电解质发生电离,是在通电条件下才发生的( )
(2)KHSO4在水溶液中可以电离出H+,所以KHSO4属于酸( )
(3)液态硫酸无法电离,只有在溶于水形成水溶液时才发生电离( )
(4)盐中不一定含有金属元素( )
√
×
√
正误判断
×
1.判断下列物质在水溶液中的电离方程式是否正确,不正确的加以改正。
________________________________。
(2)Ba(OH)2===Ba2++(OH-)2
_____________________________________。
__________________________________。
深度思考
不正确;改正:Ba(OH)2===Ba2++2OH-
______________________________________。
深度思考
2.NaHSO4通常为晶体,易溶于水,它溶于水时电离出三种不同的离子,溶液显酸性。NaHSO4受热熔化时只能电离出两种不同的离子。
(1)NaHSO4在水溶液中的电离方程式为__________________________。
(2)NaHSO4在熔融状态下的电离方程式为___________________________。
(3)下列说法正确的是____(填字母)。
a.NaHSO4属于酸 b.NaHSO4属于盐
c.NaHSO4属于电解质 d.NaHSO4溶液能与Zn反应生成氢气
深度思考
bcd
3.已知溶液的导电性强弱由溶液中离子浓度的大小及离子所带电荷数决定。离子浓度越大,所带电荷数越多,则溶液导电性越强。某兴趣小组同学做了以下实验:
(1)在如图所示的装置里,若灯泡亮,广口瓶内
的物质A可以是__________(填序号)。
①干燥的氯化钠晶体 ②干燥的氢氧化钠晶体
③蔗糖晶体 ④酒精 ⑤氯化钠溶液 ⑥氢氧
化钠溶液 ⑦稀盐酸 ⑧硫酸铜溶液
深度思考
⑤⑥⑦⑧
干燥的氯化钠晶体、氢氧化钠晶体虽由离子构成,但离子不能自由移动,所以不能导电,两者溶于水后,在水分子的作用下,电离成自由移动的阴、阳离子(实为水合离子),所以二者的水溶液能导电;蔗糖由分子构成,不能导电;酒精也不能导电。
(2)在电解质溶液的导电性实验装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是___
(填字母)。
A.盐酸中逐滴加入食盐溶液
B.硫酸中逐滴加入氢氧化钠溶液
C.石灰乳中滴加稀盐酸
D.硫酸中逐滴加入氢氧化钡溶液
深度思考
D
溶液能否导电,取决于溶液中是否有离子存在;导电性强弱则由离子浓度大小等因素决定。D选项中,发生反应:H2SO4+Ba(OH)2===BaSO4↓+2H2O,溶液中离子浓度减小,恰好完全反应时,溶液中几乎没有离子,此过程灯泡由亮变暗直至熄灭,继续滴加Ba(OH)2溶液,溶液中Ba2+、OH-数目增多,导电能力增强,灯泡又逐渐变亮。
易错警示
(1)理解酸、碱概念时注意“全部”两个字,如NaHSO4、Cu2(OH)2CO3虽能电离产生H+、OH-,但都属于盐。
(2)盐中不一定含有金属元素,如NH4Cl。
易错警示
(3)电离方程式书写时注意:
①质量与电荷要守恒。
②原子团不能拆开,如 在水溶液中拆开,在熔融状态下不拆开。
③正确标注离子所带的电荷及其数目。
(4)溶液能否导电,取决于溶液中是否有自由移动的离子存在;溶液的导电性强弱则由离子浓度大小及离子所带电荷数决定。
返回
随堂演练 知识落实
1.(2022·河南开封高一质检)下列叙述正确的是
A.凡能电离出H+的化合物均属于酸
B.NaCl溶于水,在通电条件下才能发生电离
C.铜丝、石墨均能导电,所以它们都是电解质
D.熔融的MgCl2能导电,所以MgCl2是电解质
√
1
2
3
4
1
2
3
4
硫酸氢钠在水溶液中电离生成钠离子、氢离子、硫酸根离子,属于盐,故A错误;
NaCl溶于水,在水分子的作用下发生电离,不需要通电,故B错误;
铜丝、石墨是单质,既不是电解质也不是非电解质,故C错误;
熔融的MgCl2能导电且是化合物,所以MgCl2是电解质,故D正确。
2.下列各组关于电解质、非电解质的归类,完全正确的是
1
2
3
4
选项 A B C D
电解质 Fe NaCl溶液 CaCO3 HNO3
非电解质 C12H22O11(蔗糖) BaSO4 SO2 H2O
√
A项,Fe是单质,既不是电解质,也不是非电解质,错误;
B项,NaCl溶液是混合物,既不是电解质,也不是非电解质,BaSO4虽难溶于水,但BaSO4是盐,属于电解质,错误;
D项,H2O是电解质,错误。
1
2
3
4
3.(2022·广东揭西高一测试)下列电解质在水溶液中的电离方程式书写错误的是
1
2
3
4
√
4.现有中学化学中常见的八种物质:
①固体氢氧化钡 ②石墨棒 ③纯醋酸 ④液态氯化氢 ⑤硫酸氢钾固体 ⑥熔融氯化钠 ⑦蔗糖 ⑧碳酸钠粉末
请用序号填空:
(1)上述状态下可导电的是_____,属于非电解质的是____。
(2)属于酸的是_____,属于碱的是____,属于盐的是________。
1
2
3
4
②⑥
⑦
⑤⑥⑧
③④
①
(3)写出①④⑤⑧在水溶液中的电离方程式:
①________________________;
④_________________;
⑤________________________;
⑧______________________。
1
2
3
4
Ba(OH)2===Ba2++2OH-
HCl=== H++Cl-
返回
课时对点练
题组一 电解质及其导电性
1.下列关于电解质和非电解质的说法正确的是
A.它们研究的对象都是化合物 B.它们的水溶液都能导电
C.电解质一定能导电 D.不导电的物质一定是非电解质
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
电解质和非电解质研究的对象都是化合物;非电解质的水溶液不导电;电解质为固体时不能导电;不导电的物质不一定是非电解质。
2.医院里医生给病人做心电图时,在仪器与皮肤接触部位擦的一种电解质溶液是
A.氯化钠溶液 B.医用酒精
C.葡萄糖溶液 D.碘酒
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
氯化钠是电解质,溶于水可以导电;乙醇、葡萄糖为非电解质,碘是单质,既不是电解质也不是非电解质。
3.(2022·广东潮安高一检测)下列说法正确的是
A.蔗糖、酒精在水溶液里和熔融状态时均不导电,所以它们是非电解质
B.液态HCl、固态NaCl均不导电,所以HCl、NaCl 均是非电解质
C.NH3、CO2 的水溶液均能导电,所以NH3、CO2 均是电解质
D.铜、石墨均能导电,所以它们是电解质
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
蔗糖、酒精在水溶液里和熔融状态下均不能导电,说明蔗糖、酒精在两种状态下均不能电离,且二者均为化合物,故属于非电解质,A正确;
液态HCl、固体NaCl均未发生电离,故不导电,但两者均属于电解质,B错误;
NH3、CO2的水溶液虽然能导电,但离子是其溶于水后生成的NH3·H2O、H2CO3电离产生的,故NH3、CO2属于非电解质,C错误;
Cu、石墨属于单质,既不是电解质也不是非电解质,D错误。
4.(2022·河南新乡高一检测)下列物质属于电解质且能导电的是
A.NO气体 B.固态KCl
C.MgCl2溶液 D.熔融的K2O
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
5.(2022·陕西渭南市三贤中学高一检测)下列有关物质分类的正确组合是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
选项 酸 电解质 碱性氧化物 酸性氧化物
A H2SO4 Cu2(OH)2CO3 CaO CO2
B HCl Na2SO4 Na2O CO
C NH3 熔融的氯化钠 MgO SiO2
D HNO3 蔗糖 CuO SO2
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
H2SO4电离出的阳离子只有H+,属于酸,Cu2(OH)2CO3在水溶液中能电离出离子而导电,属于电解质,CaO能与酸反应生成盐和水,为碱性氧化物,CO2能与碱反应生成盐和水,为酸性氧化物,故A正确;
CO不能与碱反应生成盐和水,不属于酸性氧化物,故B错误;
NH3不属于酸,故C错误;
蔗糖在水溶液或熔融状态下都不能导电,属于非电解质,故D错误。
6.某一化学兴趣小组的同学在家中进行实验,按照图A连接好线路,发现灯泡不亮;按照图B连接好线路,发现灯泡亮了。由此得出的以下结论正确的是
A.硝酸钾固体不是电解质
B.硝酸钾溶液是电解质
C.硝酸钾在水溶液中电离出了可以自由移动的离子
D.在硝酸钾溶液中,水电离出了大量的离子
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
硝酸钾是电解质,但硝酸钾固体中因没有可以自由移动的离子而不导电,硝酸钾溶液是混合物,不是电解质。
题组二 电解质的电离
7.下列物质的变化不能产生自由移动的离子的是
A.氢氧化钠溶于水 B.硫酸溶于水
C.氯化钠固体受热熔化 D.蔗糖受热熔化
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
8.下列物质溶于水时,不能电离出酸根离子的是
A.NaNO3 B.Ba(OH)2
C.KMnO4 D.KCl
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
氢氧化钡是碱,电离出的是氢氧根离子,其他三种物质均能电离出酸根离子。
9.下列电离方程式错误的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
10.下列物质只有在水溶液中才导电的电解质是
A.氯化钠 B.二氧化碳 C.乙醇 D.氯化氢
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
氯化钠在水溶液里和熔融状态下都能够导电,故A不符合题意;
二氧化碳是非电解质,溶于水生成碳酸,碳酸溶液能导电,故B不符合题意;
乙醇为非电解质,在水溶液里不导电,故C不符合题意;
氯化氢为电解质,氯化氢不导电,只有在水溶液里才能导电,故D符合题意。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
11.下列说法正确的是
①难溶于水的盐(CaCO3、BaSO4等)都是非电解质
②不是电解质的物质一定是非电解质
③能电离出H+的化合物都是酸
④电解质溶液能导电的原因是溶液中有自由移动的阴离子和阳离子
⑤熔融的电解质都能导电
A.①③⑤ B.②④⑤ C.只有④ D.只有⑤
√
12.(2022·河南焦作高一检测)如图是电解质导电实验装置,接通电源后,下列说法正确的是
A.CuSO4、NaCl均为电解质,灯泡会亮起来
B.在NaCl粉末中加入适量水,灯泡会亮起来
D.将NaCl(s)改为NaCl溶液,在CuSO4溶液中
加入少量NaOH固体,灯泡明显变暗
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
固体氯化钠中无自由移动的离子,不导电,
灯泡不亮,A项错误;
向NaCl粉末中加入适量水,氯化钠溶于水电
离出Na+、Cl-,有自由移动的离子,能导电,
灯泡会亮起来,B项正确;
电解质电离不需要通电,C项错误;
CuSO4+2NaOH===Cu(OH)2↓+Na2SO4,因加入的NaOH为少量,部分Cu2+转化为沉淀,同时有Na+进入溶液,故灯泡亮度基本不变,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
13.下表是常见的几种酸、碱、盐在水溶液中电离出来离子的情况,根据表中信息分析正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
溶质 酸 盐 碱 HCl H2SO4 NaCl NaHSO4 NH4Cl NaOH NH3·H2O
电离出的离子 H+、Cl- H+、 Na+、Cl- Na+、 H+、 、Cl- Na+、OH- 、OH-
A.在水溶液中电离出H+的物质一定是酸
B.在水溶液中电离出金属阳离子和酸根离子的物质一定是盐
C.盐溶液电离出来的阳离子一定是金属离子
D.碱溶液电离出的离子一定是金属阳离子和OH-
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
NaHSO4在水溶液中电离出来的离子有H+,但不属于酸,属于盐,A错误;
盐由金属阳离子(或铵根离子)和酸根离子形成,则在水溶液中电离出金属阳离子和酸根离子的物质一定是盐,B正确、C错误;
NH3·H2O属于碱,在溶液中电离出的阳离子是 ,不是金属阳离子,D错误。
14.1923年丹麦化学家布朗斯特和英国化学家劳里提出了酸碱质子理论,其定义是凡是能够释放质子(H+)的任何含氢原子的分子或离子都是酸;凡是能与质子结合的分子或离子都是碱。按照酸碱质子理论,下列粒子既可以看作酸又可以看作碱的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
按照酸碱质子理论,CH3COO-只能结合H+转化为CH3COOH,属于碱,A错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
OH-只能结合H+转化为H2O,属于碱,C错误;
15.现有下列物质:①Na2CO3·10H2O晶体,②石墨,③无水酒精,④小苏打,⑤NaHSO4固体,⑥Ba(OH)2固体,⑦氨气,⑧稀硝酸,⑨食醋。
(1)按物质的分类方法,填写表格的空白处(填序号):
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
分类标准 能导电的物质 电解质 非电解质 既不是电解质也不是非电解质
属于该类的物质
②⑧⑨ ①④⑤⑥ ③⑦ ②⑧⑨
(2)写出属于电解质的物质在水溶液中的电离方程式:________________
_____________________________________________________________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
Na2CO3·10H2O===
(3)写出属于酸式盐的两种物质在水溶液中反应的化学方程式:________
_________________________________。
NaHCO3
+NaHSO4===Na2SO4+CO2↑+H2O
16.已知Ca(OH)2、CaCO3、Ca(HCO3)2都是电解质,CO2+H2O+CaCO3===Ca(HCO3)2,Ca(HCO3)2可溶于水。测定溶液的导电能力的实验装置如图:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(1)将实验现象填在下表空格中。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
实验操作 灯泡亮度变化
通入CO2以前
开始通入CO2时
恰好完全沉淀
沉淀完全后,继续通入过量的CO2
亮
由亮变暗
熄灭
又变亮
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
通入CO2之前,澄清石灰水中有Ca2+和OH-,故灯泡亮;
通入CO2时,由于发生CO2+Ca(OH)2===CaCO3↓+H2O,
溶液中离子浓度减小,所以灯泡变暗;
继续通入CO2使Ca2+恰好完全沉淀时,液体为水,导电
性非常弱,灯泡熄灭;
继续通入CO2发生反应:CO2+H2O+CaCO3===Ca(HCO3)2,Ca(HCO3)2电离出Ca2+和 ,离子浓度增大,故灯泡又变亮。
(2)下列四个图中,____(填字母)能比较准确地反映出溶液的导电能力和通入CO2气体量的关系(x轴表示CO2通入的量,y轴表示导电能力)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
D
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由于通入CO2后溶液中自由移动的离子的浓度逐渐减小,所以一开始导电能力逐渐下降,随着反应的进行,离子浓度逐渐增大,导电能力也逐渐增大,当反应进行完全后,溶液导电能力基本保持不变,所以选D。
返回
