2022-2023学年人教版2019高中化学必修1 第一章 物质及其变化 第二节 微专题1 离子反应的三大热点题型 课件(31张PPT)
文档属性
| 名称 | 2022-2023学年人教版2019高中化学必修1 第一章 物质及其变化 第二节 微专题1 离子反应的三大热点题型 课件(31张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 590.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-22 16:35:27 | ||
图片预览











文档简介
(共31张PPT)
微专题1
WEIZHUANTIYI
离子反应的三大热点题型
第一章
一、离子方程式的正误判断
离子方程式正误判断的“五个角度”
(1)看离子反应是否符合客观事实,不可主观臆造产物及反应。如铁与稀硫酸的反应不能写成2Fe+6H+===2Fe3++3H2↑,应写成________
。
(2)看各物质的化学式拆写是否正确。如石灰石与稀盐酸的反应不能写成 +2H+===H2O+CO2↑,应写成__________________________
。注意:微溶物在生成物中当成沉淀,不拆写,若为反应物且为澄清溶液则拆成离子,如Ca(OH)2。
Fe+2H+
===Fe2++H2↑
CaCO3+2H+===Ca2++H2O
+CO2↑
(3)看是否漏写参加反应的离子。如硫酸铜溶液和氢氧化钡溶液的反应,离子方程式不能写成 +Ba2+===BaSO4↓,应写成____________
。
(4)看原子和电荷是否守恒。如Cu与AgNO3溶液反应的离子方程式不能写成Cu+Ag+===Cu2++Ag,而应写成 。
(5)看反应物或生成物的配比是否正确。如稀硫酸与Ba(OH)2溶液的反应不能写成H++OH-+ +Ba2+===BaSO4↓+H2O,应写成____
。
+Ba2++2OH-===Cu(OH)2↓+BaSO4↓
Cu+2Ag+===Cu2++2Ag
2H+
1.判断下列反应的离子方程式的正误。
①稀硫酸滴在铜片上:Cu+2H+===Cu2++H2↑( )
②稀硫酸与氢氧化钡溶液混合: +Ba2+===BaSO4↓( )
③稀硝酸滴在大理石上:CaCO3+2H+===Ca2++H2CO3( )
④氧化铁与稀盐酸混合:Fe2O3+6H+===2Fe3++3H2O( )
⑤氢氧化铜和稀盐酸反应:OH-+H+===H2O( )
⑥镁和硝酸银溶液反应:Mg+Ag+===Mg2++Ag( )
⑦碳酸氢钠溶液与稀H2SO4反应: +2H+===H2O+CO2↑( )
⑧向澄清的石灰水中通过量CO2:Ca2++2OH-+CO2===CaCO3↓+H2O( )
×
√
×
×
×
×
×
×
Cu的活泼性小于H的活泼性,Cu不能和稀硫酸反应生成H2,故①错误;
反应生成的H2CO3不稳定,分解成CO2和水,故③错误;
Fe2O3为金属氧化物,在离子方程式中不能拆分为离子,故④正确;
Cu(OH)2在离子反应中不能拆分为离子,应为Cu(OH)2+2H+===Cu2++2H2O,故⑤错误;
电荷不守恒,应为Mg+2Ag+===2Ag+Mg2+,故⑥错误。
特别提醒
书写离子方程式时,“少量”“过量”“适量”等情况不同,产物可能不同。例如,澄清石灰水中通入过量CO2的反应:Ca2++2OH-+CO2===CaCO3↓+H2O(×),因为澄清石灰水与过量的CO2反应生成Ca(HCO3)2。
二、溶液中离子大量共存的判断
1.溶液中离子能否大量共存的判断方法
判断溶液中的离子能否大量共存,事实上是看离子之间能否反应,若反应,则不能大量共存;若不反应,则能大量共存。
2.“三看”突破溶液中离子能否大量共存问题
(1)看要求
是“能大量共存”还是“不能大量共存”;是“一定大量共存”还是“可能大量共存”。
(2)看条件
题干是否有“隐含条件”
①“无色透明”溶液不能大量存在有色离子,如:
Cu2+ Fe3+ Fe2+
| | | |
蓝色 棕黄色 浅绿色 紫红色
②酸性溶液中不能大量存在与H+反应的离子
“酸性”溶液的不同描述:
a.酸性溶液;
b.常温下,pH<7的溶液;
c.使紫色石蕊溶液变红色的溶液。
③碱性溶液中不能大量存在与OH-反应的离子
“碱性”溶液的不同描述:
a.碱性溶液;
b.常温下,pH>7的溶液;
c.使紫色石蕊溶液变蓝色的溶液。
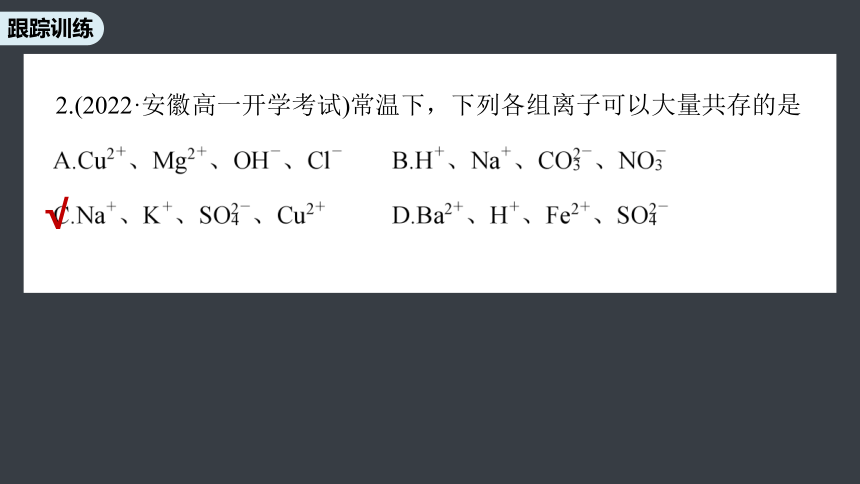
2.(2022·安徽高一开学考试)常温下,下列各组离子可以大量共存的是
√
Cu2+、Mg2+与OH-反应均生成沉淀,不能大量共存,A不选;
3.下列各组中的离子,能在溶液中大量共存的是
√
A项中的OH-与H+不能大量共存;
4.对四组无色透明溶液进行离子检验,四位同学各鉴定一组,他们的实验报告的结论如下,其中可能正确的是
√
B项,Mg2+与OH-不能大量共存;
5.(2022·吉林市教育学院高一检测)下列各组离子在给定条件下能大量共存的是
√
使酚酞溶液变红的溶液为碱性溶液,在碱性溶液中Fe3+不能大量存在,C错误;
三、常见离子的检验与推断
1.三种离子的检验方法
离子 试剂 操作及现象
CaCl2(或BaCl2)溶液、稀盐酸(或稀HNO3) 向待测液中加入BaCl2溶液(或CaCl2溶液),有白色沉淀生成,沉淀溶于稀盐酸(或稀硝酸),生成无色无味且能使澄清石灰水变浑浊的气体,证明有
Cl- 稀HNO3、AgNO3溶液 向待测液中加入几滴稀硝酸,然后加入几滴AgNO3溶液,有白色沉淀生成,证明有Cl-
稀盐酸、BaCl2溶液 向待测液中加入稀盐酸,无明显现象,然后加入几滴BaCl2溶液,有白色沉淀生成,证明有
2.离子推断要坚持“四项基本原则”
(1)肯定性原则:根据现象推断肯定存在或肯定不存在的离子。
(3)进出性原则:要注意所加试剂引入什么离子,是否造成干扰。
(4)守恒原则(电中性原则):阳离子和阴离子同时存在于溶液中且正、负电荷总量相等。
6.某研究性学习小组欲分析某矿石的主要成分,粉碎后将其溶于过量稀盐酸中充分反应,过滤后用所得滤液进行如下实验,下列说法正确的是
A.取少量滤液,向其中滴加少量Na2CO3溶液,无白色沉淀,说明矿石中一定不含Ca2+
B.取少量滤液,向其中滴加过量BaCl2溶液,产生白色沉淀,说明矿石中含有
C.取少量滤液,向其中滴加适量NaOH溶液,产生白色沉淀,说明矿石中一定含有
Mg2+
D.取少量滤液,向其中加入硝酸酸化的硝酸银,产生白色沉淀,说明矿石中一定含
有Cl-
√
因盐酸过量,加入的少量Na2CO3溶液应先和H+反应,即使有Ca2+存在,也不会产生白色沉淀,A项错误;
加入过量BaCl2溶液能产生白色沉淀,说明含有 ,B项正确;
加入NaOH溶液产生的白色沉淀不一定是Mg(OH)2,Al(OH)3、Zn(OH)2也是白色沉淀,C项错误;
溶液中加入硝酸酸化的硝酸银,产生白色沉淀,不能说明矿石中含有Cl-,因为在矿石溶解时,加入了过量的稀盐酸,引入了Cl-,D项错误。
步骤 操作 现象
(1) 向溶液中滴加2~3滴紫色石蕊溶液 溶液变红
(2) 向溶液中滴加BaCl2溶液和稀盐酸 有白色沉淀生成
(3) 将(2)中所得沉淀过滤,向滤液中加入AgNO3溶液和稀硝酸 有白色沉淀生成
下列结论正确的是
A.该实验无法确定是否含有③ B.肯定含有的离子是①②⑥
C.可能含有的离子是①③ D.肯定不含的离子有④⑤⑦
√
步骤 操作 现象
(1) 向溶液中滴加2~3滴紫色石蕊溶液 溶液变红
(2) 向溶液中滴加BaCl2溶液和稀盐酸 有白色沉淀生成
(3) 将(2)中所得沉淀过滤,向滤液中加入AgNO3溶液和稀硝酸 有白色沉淀生成
(3)将(2)中所得沉淀过滤,向滤液中加入AgNO3溶液和稀硝酸,有白色沉淀生成,此沉淀为AgCl,因(2)中引入了Cl-,故无法说明溶液中是否含有Cl-;
由于每种离子的浓度均相等,且溶液呈电中性,则溶液中一定含有Na+,一定不含Cl-;
8.某无色透明溶液中可能大量存在Ag+、Mg2+、Cu2+、Fe3+、Na+中的几种。请回答下列问题:
(1)不做任何实验就可以确定原溶液中一定不存在的离子是___________。
无色透明溶液中不可能含有有色离子Cu2+、Fe3+。
Cu2+、Fe3+
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是_____,有关反应的离子方程式为____________________。
(3)取(2)中的滤液,加入过量的NaOH溶液,出现白色沉淀,说明原溶液中肯定有________,有关反应的离子方程式为___________________
___________。
Ag+
Ag++Cl-===AgCl↓
Mg2+
Mg2++2OH-===
Mg(OH)2↓
(4)原溶液可能大量存在的阴离子是___(填字母)。
B
9.有一包白色固体粉末,其中可能含有NaCl、Ba(NO3)2、CuSO4、Na2CO3中的一种或几种,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色;
②向①的沉淀中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④另取①中过滤后的溶液加入足量AgNO3溶液,产生白色沉淀。
根据上述实验事实,回答下列问题:
(1)原白色粉末中一定含有的物质是___________________(写化学式,下同),一定不含有的物质是_______,可能含有的物质是______。
(2)写出①②步反应的离子方程式:
①_______________________;
②__________________________________。
NaCl
Ba(NO3)2、Na2CO3
CuSO4
BaCO3+2H+===Ba2++CO2↑+H2O
第一章
本课结束
微专题1
WEIZHUANTIYI
离子反应的三大热点题型
第一章
一、离子方程式的正误判断
离子方程式正误判断的“五个角度”
(1)看离子反应是否符合客观事实,不可主观臆造产物及反应。如铁与稀硫酸的反应不能写成2Fe+6H+===2Fe3++3H2↑,应写成________
。
(2)看各物质的化学式拆写是否正确。如石灰石与稀盐酸的反应不能写成 +2H+===H2O+CO2↑,应写成__________________________
。注意:微溶物在生成物中当成沉淀,不拆写,若为反应物且为澄清溶液则拆成离子,如Ca(OH)2。
Fe+2H+
===Fe2++H2↑
CaCO3+2H+===Ca2++H2O
+CO2↑
(3)看是否漏写参加反应的离子。如硫酸铜溶液和氢氧化钡溶液的反应,离子方程式不能写成 +Ba2+===BaSO4↓,应写成____________
。
(4)看原子和电荷是否守恒。如Cu与AgNO3溶液反应的离子方程式不能写成Cu+Ag+===Cu2++Ag,而应写成 。
(5)看反应物或生成物的配比是否正确。如稀硫酸与Ba(OH)2溶液的反应不能写成H++OH-+ +Ba2+===BaSO4↓+H2O,应写成____
。
+Ba2++2OH-===Cu(OH)2↓+BaSO4↓
Cu+2Ag+===Cu2++2Ag
2H+
1.判断下列反应的离子方程式的正误。
①稀硫酸滴在铜片上:Cu+2H+===Cu2++H2↑( )
②稀硫酸与氢氧化钡溶液混合: +Ba2+===BaSO4↓( )
③稀硝酸滴在大理石上:CaCO3+2H+===Ca2++H2CO3( )
④氧化铁与稀盐酸混合:Fe2O3+6H+===2Fe3++3H2O( )
⑤氢氧化铜和稀盐酸反应:OH-+H+===H2O( )
⑥镁和硝酸银溶液反应:Mg+Ag+===Mg2++Ag( )
⑦碳酸氢钠溶液与稀H2SO4反应: +2H+===H2O+CO2↑( )
⑧向澄清的石灰水中通过量CO2:Ca2++2OH-+CO2===CaCO3↓+H2O( )
×
√
×
×
×
×
×
×
Cu的活泼性小于H的活泼性,Cu不能和稀硫酸反应生成H2,故①错误;
反应生成的H2CO3不稳定,分解成CO2和水,故③错误;
Fe2O3为金属氧化物,在离子方程式中不能拆分为离子,故④正确;
Cu(OH)2在离子反应中不能拆分为离子,应为Cu(OH)2+2H+===Cu2++2H2O,故⑤错误;
电荷不守恒,应为Mg+2Ag+===2Ag+Mg2+,故⑥错误。
特别提醒
书写离子方程式时,“少量”“过量”“适量”等情况不同,产物可能不同。例如,澄清石灰水中通入过量CO2的反应:Ca2++2OH-+CO2===CaCO3↓+H2O(×),因为澄清石灰水与过量的CO2反应生成Ca(HCO3)2。
二、溶液中离子大量共存的判断
1.溶液中离子能否大量共存的判断方法
判断溶液中的离子能否大量共存,事实上是看离子之间能否反应,若反应,则不能大量共存;若不反应,则能大量共存。
2.“三看”突破溶液中离子能否大量共存问题
(1)看要求
是“能大量共存”还是“不能大量共存”;是“一定大量共存”还是“可能大量共存”。
(2)看条件
题干是否有“隐含条件”
①“无色透明”溶液不能大量存在有色离子,如:
Cu2+ Fe3+ Fe2+
| | | |
蓝色 棕黄色 浅绿色 紫红色
②酸性溶液中不能大量存在与H+反应的离子
“酸性”溶液的不同描述:
a.酸性溶液;
b.常温下,pH<7的溶液;
c.使紫色石蕊溶液变红色的溶液。
③碱性溶液中不能大量存在与OH-反应的离子
“碱性”溶液的不同描述:
a.碱性溶液;
b.常温下,pH>7的溶液;
c.使紫色石蕊溶液变蓝色的溶液。
2.(2022·安徽高一开学考试)常温下,下列各组离子可以大量共存的是
√
Cu2+、Mg2+与OH-反应均生成沉淀,不能大量共存,A不选;
3.下列各组中的离子,能在溶液中大量共存的是
√
A项中的OH-与H+不能大量共存;
4.对四组无色透明溶液进行离子检验,四位同学各鉴定一组,他们的实验报告的结论如下,其中可能正确的是
√
B项,Mg2+与OH-不能大量共存;
5.(2022·吉林市教育学院高一检测)下列各组离子在给定条件下能大量共存的是
√
使酚酞溶液变红的溶液为碱性溶液,在碱性溶液中Fe3+不能大量存在,C错误;
三、常见离子的检验与推断
1.三种离子的检验方法
离子 试剂 操作及现象
CaCl2(或BaCl2)溶液、稀盐酸(或稀HNO3) 向待测液中加入BaCl2溶液(或CaCl2溶液),有白色沉淀生成,沉淀溶于稀盐酸(或稀硝酸),生成无色无味且能使澄清石灰水变浑浊的气体,证明有
Cl- 稀HNO3、AgNO3溶液 向待测液中加入几滴稀硝酸,然后加入几滴AgNO3溶液,有白色沉淀生成,证明有Cl-
稀盐酸、BaCl2溶液 向待测液中加入稀盐酸,无明显现象,然后加入几滴BaCl2溶液,有白色沉淀生成,证明有
2.离子推断要坚持“四项基本原则”
(1)肯定性原则:根据现象推断肯定存在或肯定不存在的离子。
(3)进出性原则:要注意所加试剂引入什么离子,是否造成干扰。
(4)守恒原则(电中性原则):阳离子和阴离子同时存在于溶液中且正、负电荷总量相等。
6.某研究性学习小组欲分析某矿石的主要成分,粉碎后将其溶于过量稀盐酸中充分反应,过滤后用所得滤液进行如下实验,下列说法正确的是
A.取少量滤液,向其中滴加少量Na2CO3溶液,无白色沉淀,说明矿石中一定不含Ca2+
B.取少量滤液,向其中滴加过量BaCl2溶液,产生白色沉淀,说明矿石中含有
C.取少量滤液,向其中滴加适量NaOH溶液,产生白色沉淀,说明矿石中一定含有
Mg2+
D.取少量滤液,向其中加入硝酸酸化的硝酸银,产生白色沉淀,说明矿石中一定含
有Cl-
√
因盐酸过量,加入的少量Na2CO3溶液应先和H+反应,即使有Ca2+存在,也不会产生白色沉淀,A项错误;
加入过量BaCl2溶液能产生白色沉淀,说明含有 ,B项正确;
加入NaOH溶液产生的白色沉淀不一定是Mg(OH)2,Al(OH)3、Zn(OH)2也是白色沉淀,C项错误;
溶液中加入硝酸酸化的硝酸银,产生白色沉淀,不能说明矿石中含有Cl-,因为在矿石溶解时,加入了过量的稀盐酸,引入了Cl-,D项错误。
步骤 操作 现象
(1) 向溶液中滴加2~3滴紫色石蕊溶液 溶液变红
(2) 向溶液中滴加BaCl2溶液和稀盐酸 有白色沉淀生成
(3) 将(2)中所得沉淀过滤,向滤液中加入AgNO3溶液和稀硝酸 有白色沉淀生成
下列结论正确的是
A.该实验无法确定是否含有③ B.肯定含有的离子是①②⑥
C.可能含有的离子是①③ D.肯定不含的离子有④⑤⑦
√
步骤 操作 现象
(1) 向溶液中滴加2~3滴紫色石蕊溶液 溶液变红
(2) 向溶液中滴加BaCl2溶液和稀盐酸 有白色沉淀生成
(3) 将(2)中所得沉淀过滤,向滤液中加入AgNO3溶液和稀硝酸 有白色沉淀生成
(3)将(2)中所得沉淀过滤,向滤液中加入AgNO3溶液和稀硝酸,有白色沉淀生成,此沉淀为AgCl,因(2)中引入了Cl-,故无法说明溶液中是否含有Cl-;
由于每种离子的浓度均相等,且溶液呈电中性,则溶液中一定含有Na+,一定不含Cl-;
8.某无色透明溶液中可能大量存在Ag+、Mg2+、Cu2+、Fe3+、Na+中的几种。请回答下列问题:
(1)不做任何实验就可以确定原溶液中一定不存在的离子是___________。
无色透明溶液中不可能含有有色离子Cu2+、Fe3+。
Cu2+、Fe3+
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是_____,有关反应的离子方程式为____________________。
(3)取(2)中的滤液,加入过量的NaOH溶液,出现白色沉淀,说明原溶液中肯定有________,有关反应的离子方程式为___________________
___________。
Ag+
Ag++Cl-===AgCl↓
Mg2+
Mg2++2OH-===
Mg(OH)2↓
(4)原溶液可能大量存在的阴离子是___(填字母)。
B
9.有一包白色固体粉末,其中可能含有NaCl、Ba(NO3)2、CuSO4、Na2CO3中的一种或几种,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色;
②向①的沉淀中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④另取①中过滤后的溶液加入足量AgNO3溶液,产生白色沉淀。
根据上述实验事实,回答下列问题:
(1)原白色粉末中一定含有的物质是___________________(写化学式,下同),一定不含有的物质是_______,可能含有的物质是______。
(2)写出①②步反应的离子方程式:
①_______________________;
②__________________________________。
NaCl
Ba(NO3)2、Na2CO3
CuSO4
BaCO3+2H+===Ba2++CO2↑+H2O
第一章
本课结束
