2022-2023学年人教版2019高中化学必修1 第三章 铁 金属材料 第一节 微专题5 氢氧化亚铁制备实验的改进 课件(18张PPT)
文档属性
| 名称 | 2022-2023学年人教版2019高中化学必修1 第三章 铁 金属材料 第一节 微专题5 氢氧化亚铁制备实验的改进 课件(18张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 238.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-22 19:28:03 | ||
图片预览





文档简介
(共18张PPT)
微专题5
WEIZHUANTIWU
氢氧化亚铁制备实验的改进
第三章
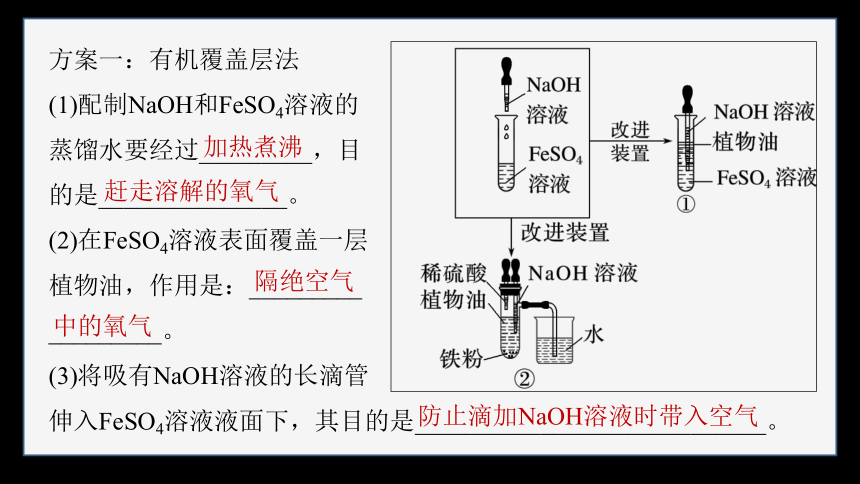
方案一:有机覆盖层法
(1)配制NaOH和FeSO4溶液的
蒸馏水要经过_________,目
的是_______________。
(2)在FeSO4溶液表面覆盖一层
植物油,作用是:_________
_________。
(3)将吸有NaOH溶液的长滴管
伸入FeSO4溶液液面下,其目的是____________________________。
加热煮沸
赶走溶解的氧气
隔绝空气
中的氧气
防止滴加NaOH溶液时带入空气
方案二:还原性气体保护法
在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(4)在试管Ⅰ里加入的试剂是_______________。
(5)在试管Ⅱ里加入的试剂是___________。
(6)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和试管Ⅱ
中加入试剂,塞紧塞子后的实验步骤是_________
___________________________________________
______________。
稀H2SO4、铁屑
NaOH溶液
夹a,待Ⅰ中反应生成的氢气排净装置中的空气后,
再关闭止水夹a
打开止水
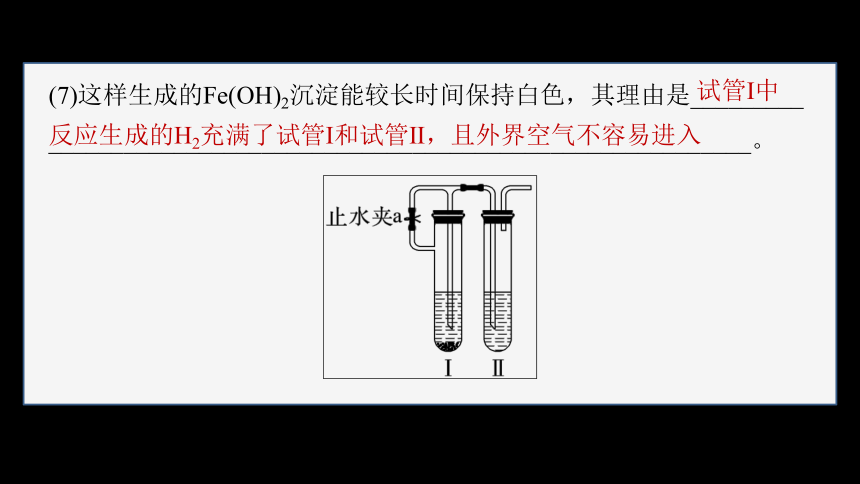
(7)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是_________
________________________________________________________。
反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入
试管Ⅰ中
归纳总结
制备Fe(OH)2的四个关键点
(1)Fe2+极易被氧化,所以FeSO4溶液要现用现配。
(2)为了防止Fe2+被氧化,配制FeSO4溶液的蒸馏水和NaOH溶液要煮沸,尽可能除去O2。
(3)为了防止滴加NaOH溶液时带入空气,可将吸有NaOH溶液的长滴管伸入FeSO4溶液的液面下,再挤出NaOH溶液。
(4)为防止Fe2+被氧化,还可以向盛有FeSO4溶液的试管中加入少量的煤油或其他密度小于水而不溶于水的有机物,以隔绝空气。
1.实验室用FeCl2溶液和烧碱制备Fe(OH)2,为了使产物不容易被氧化,下列做法不正确的是
A.配制FeCl2溶液和烧碱溶液所用的蒸馏水通常要煮沸
B.可在FeCl2溶液的上面加一层植物油以隔绝空气
C.向FeCl2溶液中滴加烧碱溶液时,胶头滴管尖嘴不能伸入试管内
D.产生Fe(OH)2沉淀后,不能振荡试管
√
A正确,FeCl2溶液和烧碱溶液要现用现配,且配制溶液的蒸馏水要煮沸以除去氧气,确保Fe(OH)2在无氧的环境里生成;
B正确,在FeCl2溶液的上面加一层植物油,以隔绝空气,防止氧气溶入;
C不正确,向FeCl2溶液中滴加烧碱溶液时,要将胶头滴管的尖嘴伸入FeCl2溶液中,防止氢氧化钠溶液在滴入时接触空气,从而溶有氧气;
D正确,产生Fe(OH)2沉淀后,若振荡试管,会增大沉淀与空气接触的机会,使沉淀更易被氧化。
2.有人设计出一种在隔绝空气条件下让钠与FeSO4溶液反应的方法以验证其反应实质。实验时,往100 mL的大试管中先加40 mL煤油,取3粒米粒大小的金属钠放入大试管后塞上橡胶塞,通过长
颈漏斗加入FeSO4溶液使煤油的液面上升至橡胶塞,
并夹紧弹簧夹(如图所示)。仔细观察,回答下列问题:
(1)大试管的下层溶液中出现的现象为______________
_____。
产生白色絮状
沉淀
由于金属Na的密度比H2O的小,比煤油的大,故钠粒应位于两种液体的交界处,Na与FeSO4溶液接触的部分与H2O发生反应生成NaOH和H2,NaOH与FeSO4发生反应生成白色絮状沉淀Fe(OH)2,因隔绝了空气,制得的白色Fe(OH)2可以保存较长时间。
(2)装置中长颈漏斗内液面______(填“下降”或“上升”)。
上升
由于大试管内产生H2,大试管内压强增大,把大试管内的液体压入长颈漏斗中,故长颈漏斗内的液面上升。
(3)写出钠与FeSO4溶液反应的化学方程式:____
__________________________________________。
2Na
反应的化学方程式为2Na+2H2O===2NaOH+H2↑、2NaOH+FeSO4
===Fe(OH)2↓+Na2SO4,将两个化学方程式相加得2Na+FeSO4+2H2O
===Fe(OH)2↓+Na2SO4+H2↑。
+FeSO4+2H2O===Fe(OH)2↓+Na2SO4+H2↑
3.如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2被氧化时的颜色变化,实验时必须使用铁屑、6 mol·L-1硫酸,其他试剂任选。
回答下列问题:
(1)仪器D的名称为_________,该仪器中需要
放入______________,装置B中盛有一定量的
NaOH溶液,装置A中应预先加入的试剂是
_____,装置A中发生反应的离子方程式为______________________。
分液漏斗
6 mol·L-1硫酸
铁屑
Fe+2H+===Fe2++H2↑
该实验制取Fe(OH)2的原理:通过装置A制得FeSO4溶液,并产生H2,H2提供还原性气体氛围,从而能使生成的
Fe(OH)2较长时间不被氧化。
装置A中应先加入铁屑,用分液漏斗滴加
稀硫酸,控制反应速率,反应的离子方程
式为Fe+2H+===Fe2++H2↑。
(2)实验开始时应先将止水夹E______(填“打开”或“关闭”),装置C中收集到的气体主要为____;待装置中空气
排尽后,将止水夹E____(填“打开”或“关
闭”),此时装置B中可能发生的化学反应是
______________________________________
_____________(用离子方程式表示)。
打开
H2
关闭
H++OH-===H2O、Fe2++2OH-===
===Fe(OH)2↓
实验开始时,要利用H2排尽装置中的空气,并将H2收集到装置C中,所以实验开始时应先打开止水夹E,使H2从支管处逸出。装置中空气排尽后,关闭止水夹E,气体无法逸出,
使装置A中压强增大,将装置A中产
生的FeSO4溶液压入装置B中,FeSO4
溶液与NaOH溶液反应生成Fe(OH)2
和Na2SO4;同时也会使装置A中剩余的H2SO4溶液压入装置B中,H2SO4溶液与NaOH溶液反应生成H2O和Na2SO4。
(3)拔去装置B中的橡胶塞,使空气进入,此时B中发生反应的化学方程式为_______________________________。
4Fe(OH)2+O2+2H2O===4Fe(OH)3
拔去装置B中的橡胶塞,空气进入装置B中,Fe(OH)2被氧化为Fe(OH)3,发生反应:4Fe(OH)2+O2+2H2O===4Fe(OH)3。
第三章
本课结束
微专题5
WEIZHUANTIWU
氢氧化亚铁制备实验的改进
第三章
方案一:有机覆盖层法
(1)配制NaOH和FeSO4溶液的
蒸馏水要经过_________,目
的是_______________。
(2)在FeSO4溶液表面覆盖一层
植物油,作用是:_________
_________。
(3)将吸有NaOH溶液的长滴管
伸入FeSO4溶液液面下,其目的是____________________________。
加热煮沸
赶走溶解的氧气
隔绝空气
中的氧气
防止滴加NaOH溶液时带入空气
方案二:还原性气体保护法
在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(4)在试管Ⅰ里加入的试剂是_______________。
(5)在试管Ⅱ里加入的试剂是___________。
(6)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和试管Ⅱ
中加入试剂,塞紧塞子后的实验步骤是_________
___________________________________________
______________。
稀H2SO4、铁屑
NaOH溶液
夹a,待Ⅰ中反应生成的氢气排净装置中的空气后,
再关闭止水夹a
打开止水
(7)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是_________
________________________________________________________。
反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入
试管Ⅰ中
归纳总结
制备Fe(OH)2的四个关键点
(1)Fe2+极易被氧化,所以FeSO4溶液要现用现配。
(2)为了防止Fe2+被氧化,配制FeSO4溶液的蒸馏水和NaOH溶液要煮沸,尽可能除去O2。
(3)为了防止滴加NaOH溶液时带入空气,可将吸有NaOH溶液的长滴管伸入FeSO4溶液的液面下,再挤出NaOH溶液。
(4)为防止Fe2+被氧化,还可以向盛有FeSO4溶液的试管中加入少量的煤油或其他密度小于水而不溶于水的有机物,以隔绝空气。
1.实验室用FeCl2溶液和烧碱制备Fe(OH)2,为了使产物不容易被氧化,下列做法不正确的是
A.配制FeCl2溶液和烧碱溶液所用的蒸馏水通常要煮沸
B.可在FeCl2溶液的上面加一层植物油以隔绝空气
C.向FeCl2溶液中滴加烧碱溶液时,胶头滴管尖嘴不能伸入试管内
D.产生Fe(OH)2沉淀后,不能振荡试管
√
A正确,FeCl2溶液和烧碱溶液要现用现配,且配制溶液的蒸馏水要煮沸以除去氧气,确保Fe(OH)2在无氧的环境里生成;
B正确,在FeCl2溶液的上面加一层植物油,以隔绝空气,防止氧气溶入;
C不正确,向FeCl2溶液中滴加烧碱溶液时,要将胶头滴管的尖嘴伸入FeCl2溶液中,防止氢氧化钠溶液在滴入时接触空气,从而溶有氧气;
D正确,产生Fe(OH)2沉淀后,若振荡试管,会增大沉淀与空气接触的机会,使沉淀更易被氧化。
2.有人设计出一种在隔绝空气条件下让钠与FeSO4溶液反应的方法以验证其反应实质。实验时,往100 mL的大试管中先加40 mL煤油,取3粒米粒大小的金属钠放入大试管后塞上橡胶塞,通过长
颈漏斗加入FeSO4溶液使煤油的液面上升至橡胶塞,
并夹紧弹簧夹(如图所示)。仔细观察,回答下列问题:
(1)大试管的下层溶液中出现的现象为______________
_____。
产生白色絮状
沉淀
由于金属Na的密度比H2O的小,比煤油的大,故钠粒应位于两种液体的交界处,Na与FeSO4溶液接触的部分与H2O发生反应生成NaOH和H2,NaOH与FeSO4发生反应生成白色絮状沉淀Fe(OH)2,因隔绝了空气,制得的白色Fe(OH)2可以保存较长时间。
(2)装置中长颈漏斗内液面______(填“下降”或“上升”)。
上升
由于大试管内产生H2,大试管内压强增大,把大试管内的液体压入长颈漏斗中,故长颈漏斗内的液面上升。
(3)写出钠与FeSO4溶液反应的化学方程式:____
__________________________________________。
2Na
反应的化学方程式为2Na+2H2O===2NaOH+H2↑、2NaOH+FeSO4
===Fe(OH)2↓+Na2SO4,将两个化学方程式相加得2Na+FeSO4+2H2O
===Fe(OH)2↓+Na2SO4+H2↑。
+FeSO4+2H2O===Fe(OH)2↓+Na2SO4+H2↑
3.如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2被氧化时的颜色变化,实验时必须使用铁屑、6 mol·L-1硫酸,其他试剂任选。
回答下列问题:
(1)仪器D的名称为_________,该仪器中需要
放入______________,装置B中盛有一定量的
NaOH溶液,装置A中应预先加入的试剂是
_____,装置A中发生反应的离子方程式为______________________。
分液漏斗
6 mol·L-1硫酸
铁屑
Fe+2H+===Fe2++H2↑
该实验制取Fe(OH)2的原理:通过装置A制得FeSO4溶液,并产生H2,H2提供还原性气体氛围,从而能使生成的
Fe(OH)2较长时间不被氧化。
装置A中应先加入铁屑,用分液漏斗滴加
稀硫酸,控制反应速率,反应的离子方程
式为Fe+2H+===Fe2++H2↑。
(2)实验开始时应先将止水夹E______(填“打开”或“关闭”),装置C中收集到的气体主要为____;待装置中空气
排尽后,将止水夹E____(填“打开”或“关
闭”),此时装置B中可能发生的化学反应是
______________________________________
_____________(用离子方程式表示)。
打开
H2
关闭
H++OH-===H2O、Fe2++2OH-===
===Fe(OH)2↓
实验开始时,要利用H2排尽装置中的空气,并将H2收集到装置C中,所以实验开始时应先打开止水夹E,使H2从支管处逸出。装置中空气排尽后,关闭止水夹E,气体无法逸出,
使装置A中压强增大,将装置A中产
生的FeSO4溶液压入装置B中,FeSO4
溶液与NaOH溶液反应生成Fe(OH)2
和Na2SO4;同时也会使装置A中剩余的H2SO4溶液压入装置B中,H2SO4溶液与NaOH溶液反应生成H2O和Na2SO4。
(3)拔去装置B中的橡胶塞,使空气进入,此时B中发生反应的化学方程式为_______________________________。
4Fe(OH)2+O2+2H2O===4Fe(OH)3
拔去装置B中的橡胶塞,空气进入装置B中,Fe(OH)2被氧化为Fe(OH)3,发生反应:4Fe(OH)2+O2+2H2O===4Fe(OH)3。
第三章
本课结束
