2022-2023学年人教版2019高中化学必修1 第三章 铁 金属材料 第二节 第1课时 常见的合金及应用 课件(85张PPT)
文档属性
| 名称 | 2022-2023学年人教版2019高中化学必修1 第三章 铁 金属材料 第二节 第1课时 常见的合金及应用 课件(85张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 5.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-22 19:31:31 | ||
图片预览










文档简介
(共85张PPT)
第1课时
DIYIKESHI
铁合金 / 铝和铝合金 / 新型合金 / 随堂演练 知识落实 / 课时对点练
常见的合金及应用
第三章
核心素养
发展目标
1.能从合金结构与组成的角度理解合金的特殊性能,培养宏观辨识与微观探析的能力。
2.能列举常见合金的组成和性能,能科学、合理的选择和使用金属材料,培养学生的科学态度和社会责任感。
内容索引
一、铁合金
二、铝和铝合金
随堂演练 知识落实
三、新型合金
课时对点练
铁合金
一
1.合金
(1)合金的概念
合金是指由两种或两种以上的 (或金属与非金属)熔合而成的具有金属特性的物质。属于 物。
(2)合金的特性及原因
①合金的物理、化学及机械性能 各成分金属,合金比各成分金属的硬度 。
②合金的性能可以通过所添加的合金元素的种类、含量和生成合金的条件等来加以调节。
例如:硬铝(Al、Cu、Mg、Mn、Si)的强度和硬度都比纯铝的 。
金属
混合
优于
大
大
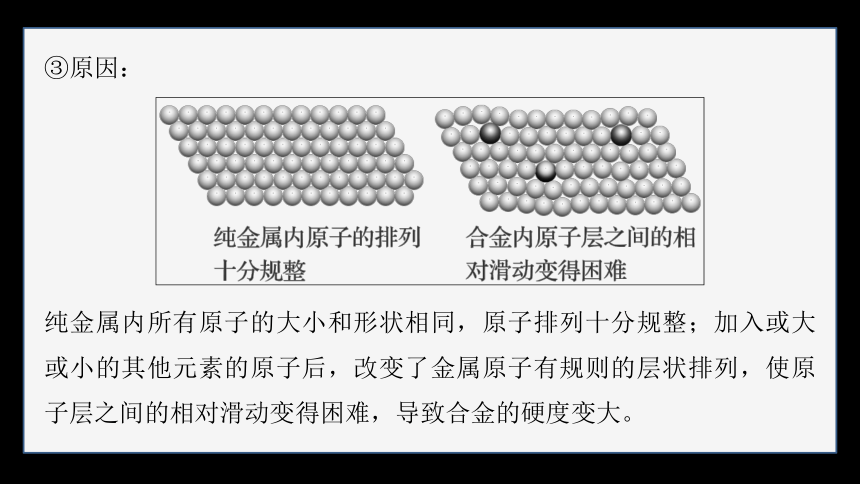
③原因:
纯金属内所有原子的大小和形状相同,原子排列十分规整;加入或大或小的其他元素的原子后,改变了金属原子有规则的层状排列,使原子层之间的相对滑动变得困难,导致合金的硬度变大。
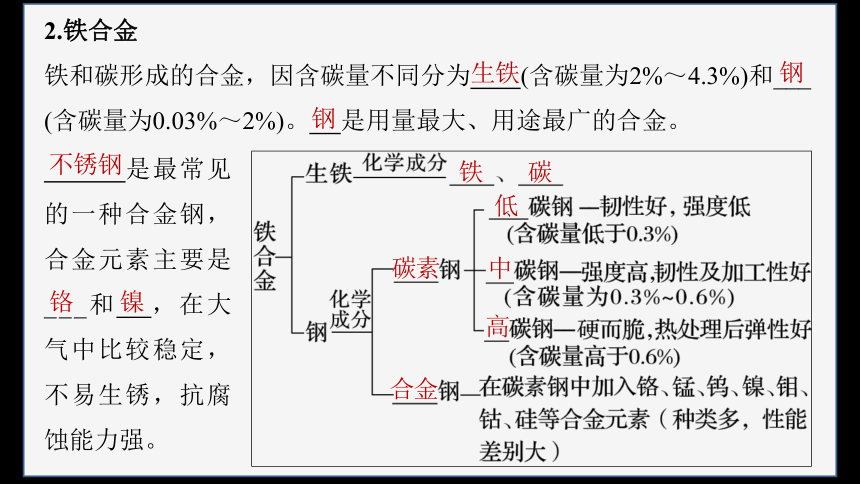
2.铁合金
铁和碳形成的合金,因含碳量不同分为 (含碳量为2%~4.3%)和___
(含碳量为0.03%~2%)。 是用量最大、用途最广的合金。
生铁
钢
钢
铁 碳
碳素
低
中
高
合金
是最常见的一种合金钢,合金元素主要是___和 ,在大气中比较稳定,不易生锈,抗腐蚀能力强。
不锈钢
铬
镍
(1)合金一定是不同金属熔合而成的具有金属特性的化合物( )
(2)生铁的熔点比纯铁低,但机械强度和硬度比纯铁高( )
(3)铁、铬、镍熔合成不锈钢是化学变化( )
(4)生铁中的铁与纯铁的化学性质不同( )
(5)地震灾区重建要使用大量钢材,钢材是合金( )
×
√
×
√
正误判断
×
已知铜的熔点为1 083 ℃,钠的沸点为883 ℃,试问铜与钠能否形成合金?
提示 不能。当铜开始熔化时,钠已经气化,所以二者不能形成合金。
深度思考
应用体验
1.(2021·河北,1)“灌钢法”是我国古代劳动人民对钢铁冶炼技术的重大贡献,陶弘景在其《本草经集注》中提到“钢铁是杂炼生鍒作刀镰者”。“灌钢法”主要是将生铁和熟铁(含碳量约0.1%)混合加热,生铁熔化灌入熟铁,再锻打成钢。下列说法错误的是
A.钢是以铁为主的含碳合金
B.钢的含碳量越高,硬度和脆性越大
C.生铁由于含碳量高,熔点比熟铁高
D.冶炼铁的原料之一赤铁矿的主要成分为Fe2O3
√
钢是含碳量低的铁合金,故A正确;
钢的硬度和脆性与含碳量有关,随着含碳量的增大而增大,故B正确;
由题意可知,生铁熔化灌入熟铁,再锻打成钢,说明生铁的熔点低于熟铁,故C错误;
赤铁矿的主要成分是Fe2O3,可用于冶炼铁,故D正确。
2.下列关于铁和铁合金的有关说法错误的是
A.工业上用一氧化碳将铁矿石中的铁还原出来
B.不锈钢抗腐蚀性能好,长期使用绝对不会生锈
C.制造铁轨、船舶、桥梁的碳素钢是铁和碳的合金
D.使用铁锅烧饭菜能为人体提供微量的铁元素
√
一氧化碳具有还原性,可以将铁矿石中的铁还原出来;在相同条件和环境下,不锈钢较碳素钢而言不易生锈;碳素钢是铁和碳的合金;铁是人体需要的微量元素,使用铁锅烧饭菜能为人体提供微量的铁元素。
返回
铝和铝合金
二
1.铝和铝合金
(1)铝是地壳中含量 的金属元素,常温下就能与空气中的 发生反应,表面生成一层致密的 薄膜,保护内部金属。
特别提醒 在常温下形成致密保护膜的金属,如铝、镁等金属。铁在高温下形成致密保护膜,俗称“烤蓝”,铁或铝遇到浓H2SO4或浓HNO3时,迅速反应生成致密氧化膜,称为钝化。
最多
氧气
氧化铝
(2)铝合金
铝合金是目前用途广泛的合金之一,硬铝是在铝中添加了一定比例的Cu、Mg、Mn、Si,它的密度 ,强度 ,具有较强抗腐蚀能力,是制造飞机和宇宙飞船的理想材料。
小
高
2.铝、氧化铝的性质
(1)①铝、氧化铝与稀盐酸反应
实验操作
实验现象 铝片 ,有无色气泡冒出,将点燃的木条放在试管口有_______
逐渐溶解
爆鸣声
化学 方程式 ___________________________、_________________________
离子 方程式 __________________________、________________________
Al2O3+6HCl===2AlCl3+3H2O
2Al+6HCl===2AlCl3+3H2↑
Al2O3+6H+===2Al3++3H2O
2Al+6H+===2Al3++3H2↑
实验 操作
实验 现象 试管①中一开始无气泡产生,一段时间后,铝片 ,有无色气泡冒出,试管②中铝片溶解,立即产生无色气泡,将点燃的木条放在试管口,都有______
②铝、氧化铝与NaOH溶液反应
溶解
爆鸣声
化学 方程式 _______________________________、__________________
___________________
离子 方程式 ___________________________、______________________
_____________
Al2O3+2NaOH===2NaAlO2+H2O
2Al+2NaOH+2H2O
===2NaAlO2+3H2↑
2Al+2OH-+2H2O===
(2)两性氧化物
既能与 反应生成盐和水,又能与 反应生成盐和水的氧化物,如Al2O3等,其与强酸、强碱反应的离子方程式为:
Al2O3+6H+===2Al3++3H2O
酸
碱
1.铝是活泼金属,但在日常生活中铝制品却能稳定存在,原因是什么?
提示 常温下铝与氧气反应,在铝制品表面形成致密的氧化铝薄膜,保护铝不被腐蚀。
深度思考
2.向集满CO2的铝制易拉罐中加入过量NaOH浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起。上述实验过程中发生的离子反应有__________________________________________________。
深度思考
向集满CO2的易拉罐中加入过量NaOH浓溶液,易拉罐渐渐凹瘪,是由于CO2被NaOH溶液吸收,气体压强减小,发生了①反应;
铝制易拉罐表面的Al2O3会与NaOH溶液反应,发生了②反应;
NaOH溶液能与Al发生反应生成H2,使易拉罐凸起,发生了③反应。
应用体验
1.(2022·广东清远高一月考)铝是地壳中含量最高的金属元素,下列关于铝及其化合物的性质、用途的说法错误的是
A.纯铝的硬度和强度较小,不适合用于制造机器零部件
B.可用NaOH溶液除去Fe2O3粉末中少量的Al2O3
C.铝合金是用来制造飞机和宇宙飞船的理想材料
D.铝制品廉价易得,适用于厨房蒸煮和长期存放碱性食物
√
制造机器零部件要求材料硬度高、强度大,而纯铝硬度、强度较小,不适合,A正确;
氧化铁不与氢氧化钠溶液反应,氧化铝为两性氧化物,与氢氧化钠溶液反应生成偏铝酸钠和水,B正确;
铝合金硬度高、质量轻,是用来制造飞机和宇宙飞船的理想材料,C正确;
铝能与酸、碱发生反应,铝制品不能长期存放酸性或碱性较强的食物,D错误。
2.把镁粉中混入的少量铝粉除去,应选用的试剂是
A.盐酸 B.氯水
C.烧碱溶液 D.食盐水
√
盐酸和镁粉、铝粉都反应,不能把镁粉中混有的少量铝粉除去,故A错误;
氯水和镁粉、铝粉都反应,不能把镁粉中混有的少量铝粉除去,故B错误;
烧碱和镁粉不反应,和铝粉反应,因此可以把镁粉中混有的少量铝粉除去,故C正确;
食盐水和镁粉、铝粉都不反应,不能把镁粉中混有的少量铝粉除去,故D错误。
3.向某溶液中加入铝粉能放出H2,下列各组离子一定不能在该溶液中大量共存的是
√
加入铝粉能放出H2,说明该溶液可能呈酸性,也可能呈碱性。A选项中的4种离子可在酸性溶液中大量共存;
C选项中的离子在碱性溶液中可以大量共存;
D选项中的离子在酸性溶液、碱性溶液中都可以大量共存。
4.等体积的盐酸和苛性钠溶液分别与两份足量的铝粉反应,在相同条件下产生氢气的体积比为1∶3,则盐酸和苛性钠溶液的物质的量浓度之比为
A.1∶1 B.2∶1
C.3∶1 D.2∶3
√
由2Al+6HCl===2AlCl3+3H2↑、2Al+2NaOH+2H2O===2NaAlO2+3H2↑可知,产生氢气的体积比为1∶3,需要盐酸和氢氧化钠的物质的量之比为1∶1,溶液的体积相同,故盐酸和苛性钠溶液的物质的量浓度之比也为1∶1。
返回
新型合金
三
1.储氢合金:一类能够大量吸收H2,并与H2结合成 的材料。如Ti-Fe合金、La-Ni合金等,为氢气作为能源的实际应用起到重要的推动作用。
2.其他新型合金: 、 和 等新型合金广泛应用于航空航天、生物工程和电子工业等领域。
3.用途广泛的稀土金属
(1)镧系元素(57~71号元素)及钇和钪,共17种元素为稀土元素。
我国是稀土资源大国,到目前为止,我国的稀土储量、稀土产量、稀土用量和稀土出口量均居世界第一位。
金属氢化物
钛合金
耐热合金
形状记忆合金
(2)稀土金属有着广泛的用途,它既可以单独使用,也可用于生产合金。在合金中加入适量稀土金属,能大大改善合金的性能。因而,稀土元素又被称为“冶金工业的维生素”。
(3)稀土金属可用于制造引火合金、永磁材料、超导材料和发光材料等。稀土金属除广泛应用在冶金、石油化工、材料工业、医药及农业领域外,还逐渐深入到许多现代科技领域。
应用体验
1.我国“蛟龙”号载人潜水器已成功下潜至海里7 062.68米处。“蛟龙”号载人潜水器的外壳是耐超高压的钛合金,下面有关合金的说法正确的是
A.钛合金是一种新型金属单质
B.钛合金熔点比钛金属高
C.钛合金的硬度与钛单质相同
D.青铜、合金钢和硬铝都是合金
√
合金含有两种或者两种以上元素,不是单质,故A错误;
合金熔点一般比其组分中任一金属的熔点低,故B错误;
合金硬度一般比其组分中任一金属的硬度大,故C错误;
青铜、合金钢和硬铝都是合金,故D正确。
2.下列关于新型合金材料说法不正确的是
A.镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料
B.钛合金生物相容性好,强度大,可作人造骨骼
C.形状记忆合金可在使合金发生形变的作用力消失后恢复原状
D.利用合金的熔点低于成分金属这一特点可制得耐热合金
√
储氢材料是一类能可逆地吸收和释放氢气的材料,镧镍合金能大量吸收H2形成金属氢化物,是目前解决氢气的储存和运输问题的材料,故A正确;
钛合金与人体有很好的相容性,且性质稳定,抗腐蚀性强,所以可用来制造人造骨骼,故B正确;
形状记忆合金可在使合金发生形变的作用力消失后恢复原状,故C正确;
耐热合金的熔点很高,与合金的特性无关,故D错误。
返回
随堂演练 知识落实
1.(2021·广东,1)今年五一假期,人文考古游持续成为热点。很多珍贵文物都记载着中华文明的灿烂成就,具有深邃的文化寓意和极高的学术价值。下列国宝级文物主要由合金材料制成的是
选项 A B C D
文物
名称 铸客大铜鼎 河姆渡出土陶灶 兽首玛瑙杯 角形玉杯
√
1
2
3
4
铸客大铜鼎属于铜的合金,A符合题意。
2.(2022·无锡教育科学研究院高一质检)下列关于合金的叙述正确的是
A.铝合金硬度比纯铝小
B.生铁是铁碳合金,钢是纯净的铁单质
C.硬铝密度小、强度高,常用于制造飞机外壳
D.不锈钢和钢都是铁合金,性质完全相同
1
2
3
4
√
合金的硬度比其任一成分金属都大,铝合金硬度比纯铝大,A错误;
生铁是铁碳合金,钢的含碳量比生铁低,也是铁碳合金,B错误;
不锈钢和钢都是铁合金,但其内部结构和组分不同,性质不相同,D错误。
1
2
3
4
3.储氢合金是一种新型合金。下列关于储氢合金的说法错误的是
A.储氢合金是一类能大量吸收H2,并与H2结合成金属氢化物的材料
B.储氢合金吸收H2的过程属于物理变化
C.储氢合金NaAlH4中氢元素的化合价为-1价
D.具有实用价值的储氢合金在室温下吸、放氢的速率快
√
1
2
3
4
储氢合金是一类能够大量吸收氢气,并与氢气结合成金属氢化物的材料,如镧镍合金,它吸收氢气可结合成金属氢化物,故A正确;
氢气在储存过程中与金属反应生成其他物质,是化学变化,故B错误;
NaAlH4中Na是+1价,Al是+3价,则H为-1价,故C正确;
储氢合金储氢量大,吸、放氢速率快,所以可用于氢燃料汽车,故D正确。
1
2
3
4
4.合金是由两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。
(1)下列物质不属于合金的是_____(填字母,下同)。
A.明矾 B.硬铝 C.生铁 D.青铜
1
2
3
4
A
A属于化合物;硬铝中含铝、铜、镁等,生铁中主要含铁、碳,青铜中含有铜、锡等,它们都属于合金。
金 属 Na Cu Al Fe
熔点/℃ 97.8 1 083 660 1 535
沸点/℃ 883 2 567 2 467 2 750
(2)已知下表中四种金属的熔、沸点:
1
2
3
4
其中不能形成合金的是_______。
①Cu与Na ②Fe与Cu ③Fe与Na ④Al与Na
A.①② B.①③ C.①④ D.②④
B
当一种金属的熔点超过另一种金属的沸点时,它们就不可能熔合在一起形成合金。
1
2
3
4
返回
课时对点练
题组一 合金及铁合金
1.(2022·辽宁辽阳高一月考)下列材料不属于合金的是
A.铸造下水井盖的生铁 B.储氢用的La-Ni合金
C.可用于机器人“皮肤”的橡胶 D.可用于军用车辆的超级钢
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
生铁是Fe和C的合金,A不符合题意;
橡胶不是合金,C符合题意;
超级钢是铁合金,D不符合题意。
2.2020年11月24日4时30分,我国在中国文昌航天发射场,用长征五号遥五运载火箭成功发射探月工程“嫦娥五号”探测器,开启我国首次地外天体采样返回之旅。“嫦娥五号”中使用了大量合金。下列有关金属或合金的说法中不正确的是
A.生铁属于合金
B.一般合金的熔点比各成分金属的低
C.合金的化学性质与其成分金属的化学性质不同
D.改变原料的配比、生成合金的条件,可以得到具有不同性能的合金
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
生铁由铁和碳等元素组成,属于合金,故A正确;
形成合金后,结构发生了改变,一般合金的熔点比各成分金属的低,故B正确;
合金的化学性质与其成分金属的化学性质相同,故C错误;
改变原料的配比、生成合金的条件,组成合金的成分、结构不同,对合金的性质产生不同的影响,可以得到具有不同性能的合金,故D正确。
3.下列关于钢的说法不正确的是
A.根据含碳量不同,碳素钢可分为高碳钢、中碳钢和低碳钢
B.含碳量低的钢,硬度较大,韧性较弱
C.向钢中加入一定量的一种或几种其他元素,可得到具有各种不同性能
的合金钢
D.不锈钢中主要加入了铬、镍两种元素
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
钢的分类有多种,以含碳量的多少可分为高碳钢、中碳钢和低碳钢,故A正确;
钢中含碳量多时,硬度大,韧性弱,含碳量少时,硬度小,韧性强,故B错误;
合金就是几种金属或金属与非金属熔合在一起形成的具有金属特性的物质,故C正确;
普通钢中加入铬元素使钢的表面形成了致密而坚硬的氧化膜,加入镍元素使钢不能被多种酸、碱、盐溶液腐蚀,故D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
题组二 铝和铝合金
4.铝镁合金材料在现代装饰材料中占有极为重要的地位,这种材料常用于制作门窗框、防护栏等。铝镁合金的下列性质与以上用途无关的是
A.不易生锈 B.导电性好 C.密度小 D.强度高
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
铝镁合金作为现代装饰材料与其导电性无关。
5.为了除去MgO中混有的少量杂质Al2O3,可选用的试剂是
A.KOH溶液 B.氨水
C.稀盐酸 D.稀醋酸
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
要除去MgO中混有的少量杂质Al2O3,所加试剂只能与Al2O3反应而不能与MgO反应,反应完全后过滤即可。氨水与Al2O3不反应,稀盐酸、稀醋酸均能与MgO反应,只有KOH溶液能与Al2O3反应而与MgO不反应。
6.(2022·绵阳南山中学双语学校高一开学考试)若在加入Al能放出H2的溶液中分别加入下列各组离子,可能大量共存的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Mg2+与OH-结合生成沉淀,不能共存,故B项错误;
酸或碱溶液中,各离子之间都不反应,可共存,故C项正确;
7.在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡。然后将两球分别浸没在溶液质量相等的稀烧碱溶液和
硫酸铜溶液中一段时间,如图所示。下列说法正
确的是
A.铝球表面有气泡产生,且有白色沉淀生成,杠杆不平衡
B.铝球表面有气泡产生,溶液澄清;铁球表面有红色物质析出,溶液蓝
色变浅,杠杆右边下沉
C.反应后去掉两烧杯,杠杆仍平衡
D.右边球上出现红色,左边溶液的c(OH-)增大
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
左烧杯中的铝球与氢氧化钠溶液反应:2Al+2NaOH+2H2O===2NaAlO2
+3H2↑,有一部分铝溶解,并产生气体,生成偏铝酸钠;右烧杯铁球浸在硫酸铜溶液中发生反应:Fe+CuSO4===FeSO4+Cu,铁球表面有红色物质析出,铁球质量增加,溶液蓝色变浅,左边消耗OH-,使c(OH-)减小。
题组三 新型合金
8.钛和钛合金被誉为“21世纪最有发展前景的金属材料”,它们具有很多优良的性能,如熔点高、密度小、可塑性好、易于加工,尤其是钛合金与人体器官具有很好的“生物相容性”。根据它们的主要性能,下列用途不切实际的是
A.用来做保险丝 B.用于制造航天飞机
C.用来制造人造骨 D.用于家庭装修,制作钛合金装饰门
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
由于其熔点高,不适合做保险丝,A错误;
由于钛和钛合金密度小、可塑性好,因此可用于航天领域,B正确;
由于钛合金与人体器官具有很好的“生物相容性”,可与人体的组织相容,不引起排斥反应,因此可以用来制造人造骨,C正确;
由于其密度小、可塑性好、易于加工,因此可用于家庭装修,做钛合金装饰门,D正确。
9.形状记忆合金是一种在加热升温后能完全消除其在较低的温度下发生的变形,恢复其变形前原始形状的合金材料,即拥有“记忆”效应的合金。下列变化不是利用合金记忆效应的是
A.脊柱侧弯矫形采用的哈伦顿棒,如果矫形棒的矫正力有变化,把温度升高
到比体温约高5 ℃,就能恢复足够的矫正力
B.合金在高温环境下制作好天线,再在低温下把它压缩成一个小铁球,运上
太空中,太阳的强烈的辐射使它恢复原来的形状
C.用合金制造的精密仪器或精密车床,一旦由于震动、碰撞等原因变形,只
需加热即可排除故障
D.汽车受损变形后,利用钣金喷漆整形
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
10.(2022·张家口高一检测)下列离子方程式正确的是
A.铁与稀硫酸的反应:2Fe+6H+===2Fe3+ +3H2↑
B.将碳酸氢钠溶液与NaOH溶液混合:
C.氧化铝与烧碱溶液反应:Al2O3+2OH-===2Al3+ +4O2-+H2O
D.铝与NaOH溶液反应:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
铁与稀硫酸反应生成硫酸亚铁和氢气,反应的离子方程式是Fe+2H+===Fe2++H2↑,故A错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
11.氧化铝的熔点很高,常用于制造耐火材料,例如制作坩埚。下列操作不能在氧化铝坩埚中进行的是
A.加热使胆矾失去结晶水 B.加热使高锰酸钾分解
C.加热熔化烧碱 D.加热分解碱式碳酸铜
√
氧化铝能与强酸、强碱反应,用氧化铝材料制作的坩埚不能加热强酸、强碱。
12.下列变化不可能通过一步反应直接完成的是
A.Al(OH)3→Al2O3 B.Al2O3→Al(OH)3
C.Al→ D.AlCl3→Al(OH)3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
Al(OH)3→Al2O3,氢氧化铝受热反应生成氧化铝和水,可以一步完成,A不符合题意;
Al2O3→Al(OH)3,Al2O3难溶于水,应先将Al2O3与酸反应变成Al3+或与强碱溶液反应生成 后,然后加入弱碱或弱酸反应生成Al(OH)3,不可以一步完成,B符合题意;
Al和NaOH溶液反应生成NaAlO2和H2,可以一步完成,C不符合题意;
AlCl3→Al(OH)3,氯化铝和氨水反应生成氢氧化铝和氯化铵,可以一步完成,D不符合题意。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
13.甲、乙两个烧杯中分别盛有100 mL 4.0 mol·L-1的盐酸和100 mL 4.0 mol·
L-1 NaOH溶液,向两个烧杯中均加入5.4 g铝粉,在相同状况下产生气体的体积比为
A.1∶1 B.2∶3
C.3∶2 D.3∶1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
甲、乙两烧杯中含HCl、NaOH的物质的量都为0.4 mol,根据化学方程式:2Al+6HCl===2AlCl3+3H2↑、2Al+2NaOH+2H2O===2NaAlO2
+3H2↑可知,5.4 g(即0.2 mol)Al分别与盐酸和NaOH溶液反应时,盐酸不足量而NaOH过量,故Al与盐酸反应生成0.2 mol H2,与NaOH溶液反应生成0.3 mol H2,其体积比为2∶3。
14.铁、铝的混合物进行如下实验:
(1)操作X的名称是_______。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
过滤
加入足量NaOH溶液,Al溶解,Fe不溶解,操作X为过滤。
(2)气体A是________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
H2
Al与氢氧化钠溶液反应产生氢气,气体A为H2。
(3)A与Cl2混合光照可能发生爆炸,生成______(填化学式),A在该反应中作为________(填“氧化剂”或“还原剂”)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
HCl
H2与Cl2反应生成HCl。
还原剂
(4)溶液B中阴离子除OH-外还有________,溶液D中存在的金属离子为______。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Fe2+
15.铝镁合金已成为轮船制造、化工生产等行业的重要材料。某研究性学习小组的三位同学为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计下列三种不同实验方案进行探究。填写下列空白。
探究一
实验方案:铝镁合金 测定剩余固体质量。实验中发生反应的化学方程式是_____________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
2H2O+2Al+2NaOH===2NaAlO2+3H2↑
实验步骤:
(1)称取5.4 g铝镁合金粉末样品,投入体积为V、浓度为2.0 mol·L-1的NaOH溶液中,充分反应。为保证合金充分反应,NaOH溶液的体积V≥_________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
97 mL
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
铝镁合金中镁的质量分数至少为3%时,5.4 g铝镁合金粉末样品中铝的质量为5.4 g×(1-3%)=5.4 g×97%,则:
2Al + 2NaOH+2H2O===2NaAlO2+3H2↑
2 2
所以n(NaOH)=0.194 mol,需要NaOH溶液的体积V= =
0.097 L=97 mL;为保证合金充分反应,NaOH溶液的体积V≥97 mL。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将______(填“偏大”或“偏小”)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
偏大
镁上会附着NaAlO2等物质,未洗涤导致测定的镁的质量偏大,镁的质量分数将偏大。
探究二
实验方案:铝镁合金 测定生成气体的体积(实验装置如图所示)。
(1)某同学提出该实验装置不够完善,应在A、B之间添加一个除酸雾的装置。你的意见是_______(填“需要”或“不需要”)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
不需要
因为氯化氢极易溶于水,挥发的氯化氢不影响氢气体积的测定结果,所以不需要加除酸雾装置。
(2)为使测定结果尽可能精确,实验中应注意的问题有(写出两点):
①__________________,
②______________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
冷却至室温再读数
读数时,使量气管左右液面相平
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
反应中装置的气密性、合金是否完全溶解、量气装置的使用都会影响测定结果。因此为使测定结果尽可能精确,
实验中应注意的问题有:检查装置的气密
性,加入足量盐酸,调整量气管C的高度,
使C中液面与B中液面相平,待冷却至室温
再读取体积等。
探究三
实验方案:称量x g铝镁合金粉末,放入装有足量氧气的容器中使其充分灼烧。
(1)欲计算镁的质量分数,该实验中还需要测定的数据是_____________
_____________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
充分灼烧后固
体粉末的质量
Mg、Al均与氧气反应生成金属氧化物,则还需测定生成物的质量,才能计算出Mg的质量分数。
(2)若用空气代替O2进行实验,对测定结果是否有影响?_____(填“是”或“否”)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
是
若用空气代替O2进行实验,会发生反应:3Mg+N2 Mg3N2,2Mg+CO2 2MgO+C,对测定结果会有影响。
返回
第三章
本课结束
第1课时
DIYIKESHI
铁合金 / 铝和铝合金 / 新型合金 / 随堂演练 知识落实 / 课时对点练
常见的合金及应用
第三章
核心素养
发展目标
1.能从合金结构与组成的角度理解合金的特殊性能,培养宏观辨识与微观探析的能力。
2.能列举常见合金的组成和性能,能科学、合理的选择和使用金属材料,培养学生的科学态度和社会责任感。
内容索引
一、铁合金
二、铝和铝合金
随堂演练 知识落实
三、新型合金
课时对点练
铁合金
一
1.合金
(1)合金的概念
合金是指由两种或两种以上的 (或金属与非金属)熔合而成的具有金属特性的物质。属于 物。
(2)合金的特性及原因
①合金的物理、化学及机械性能 各成分金属,合金比各成分金属的硬度 。
②合金的性能可以通过所添加的合金元素的种类、含量和生成合金的条件等来加以调节。
例如:硬铝(Al、Cu、Mg、Mn、Si)的强度和硬度都比纯铝的 。
金属
混合
优于
大
大
③原因:
纯金属内所有原子的大小和形状相同,原子排列十分规整;加入或大或小的其他元素的原子后,改变了金属原子有规则的层状排列,使原子层之间的相对滑动变得困难,导致合金的硬度变大。
2.铁合金
铁和碳形成的合金,因含碳量不同分为 (含碳量为2%~4.3%)和___
(含碳量为0.03%~2%)。 是用量最大、用途最广的合金。
生铁
钢
钢
铁 碳
碳素
低
中
高
合金
是最常见的一种合金钢,合金元素主要是___和 ,在大气中比较稳定,不易生锈,抗腐蚀能力强。
不锈钢
铬
镍
(1)合金一定是不同金属熔合而成的具有金属特性的化合物( )
(2)生铁的熔点比纯铁低,但机械强度和硬度比纯铁高( )
(3)铁、铬、镍熔合成不锈钢是化学变化( )
(4)生铁中的铁与纯铁的化学性质不同( )
(5)地震灾区重建要使用大量钢材,钢材是合金( )
×
√
×
√
正误判断
×
已知铜的熔点为1 083 ℃,钠的沸点为883 ℃,试问铜与钠能否形成合金?
提示 不能。当铜开始熔化时,钠已经气化,所以二者不能形成合金。
深度思考
应用体验
1.(2021·河北,1)“灌钢法”是我国古代劳动人民对钢铁冶炼技术的重大贡献,陶弘景在其《本草经集注》中提到“钢铁是杂炼生鍒作刀镰者”。“灌钢法”主要是将生铁和熟铁(含碳量约0.1%)混合加热,生铁熔化灌入熟铁,再锻打成钢。下列说法错误的是
A.钢是以铁为主的含碳合金
B.钢的含碳量越高,硬度和脆性越大
C.生铁由于含碳量高,熔点比熟铁高
D.冶炼铁的原料之一赤铁矿的主要成分为Fe2O3
√
钢是含碳量低的铁合金,故A正确;
钢的硬度和脆性与含碳量有关,随着含碳量的增大而增大,故B正确;
由题意可知,生铁熔化灌入熟铁,再锻打成钢,说明生铁的熔点低于熟铁,故C错误;
赤铁矿的主要成分是Fe2O3,可用于冶炼铁,故D正确。
2.下列关于铁和铁合金的有关说法错误的是
A.工业上用一氧化碳将铁矿石中的铁还原出来
B.不锈钢抗腐蚀性能好,长期使用绝对不会生锈
C.制造铁轨、船舶、桥梁的碳素钢是铁和碳的合金
D.使用铁锅烧饭菜能为人体提供微量的铁元素
√
一氧化碳具有还原性,可以将铁矿石中的铁还原出来;在相同条件和环境下,不锈钢较碳素钢而言不易生锈;碳素钢是铁和碳的合金;铁是人体需要的微量元素,使用铁锅烧饭菜能为人体提供微量的铁元素。
返回
铝和铝合金
二
1.铝和铝合金
(1)铝是地壳中含量 的金属元素,常温下就能与空气中的 发生反应,表面生成一层致密的 薄膜,保护内部金属。
特别提醒 在常温下形成致密保护膜的金属,如铝、镁等金属。铁在高温下形成致密保护膜,俗称“烤蓝”,铁或铝遇到浓H2SO4或浓HNO3时,迅速反应生成致密氧化膜,称为钝化。
最多
氧气
氧化铝
(2)铝合金
铝合金是目前用途广泛的合金之一,硬铝是在铝中添加了一定比例的Cu、Mg、Mn、Si,它的密度 ,强度 ,具有较强抗腐蚀能力,是制造飞机和宇宙飞船的理想材料。
小
高
2.铝、氧化铝的性质
(1)①铝、氧化铝与稀盐酸反应
实验操作
实验现象 铝片 ,有无色气泡冒出,将点燃的木条放在试管口有_______
逐渐溶解
爆鸣声
化学 方程式 ___________________________、_________________________
离子 方程式 __________________________、________________________
Al2O3+6HCl===2AlCl3+3H2O
2Al+6HCl===2AlCl3+3H2↑
Al2O3+6H+===2Al3++3H2O
2Al+6H+===2Al3++3H2↑
实验 操作
实验 现象 试管①中一开始无气泡产生,一段时间后,铝片 ,有无色气泡冒出,试管②中铝片溶解,立即产生无色气泡,将点燃的木条放在试管口,都有______
②铝、氧化铝与NaOH溶液反应
溶解
爆鸣声
化学 方程式 _______________________________、__________________
___________________
离子 方程式 ___________________________、______________________
_____________
Al2O3+2NaOH===2NaAlO2+H2O
2Al+2NaOH+2H2O
===2NaAlO2+3H2↑
2Al+2OH-+2H2O===
(2)两性氧化物
既能与 反应生成盐和水,又能与 反应生成盐和水的氧化物,如Al2O3等,其与强酸、强碱反应的离子方程式为:
Al2O3+6H+===2Al3++3H2O
酸
碱
1.铝是活泼金属,但在日常生活中铝制品却能稳定存在,原因是什么?
提示 常温下铝与氧气反应,在铝制品表面形成致密的氧化铝薄膜,保护铝不被腐蚀。
深度思考
2.向集满CO2的铝制易拉罐中加入过量NaOH浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起。上述实验过程中发生的离子反应有__________________________________________________。
深度思考
向集满CO2的易拉罐中加入过量NaOH浓溶液,易拉罐渐渐凹瘪,是由于CO2被NaOH溶液吸收,气体压强减小,发生了①反应;
铝制易拉罐表面的Al2O3会与NaOH溶液反应,发生了②反应;
NaOH溶液能与Al发生反应生成H2,使易拉罐凸起,发生了③反应。
应用体验
1.(2022·广东清远高一月考)铝是地壳中含量最高的金属元素,下列关于铝及其化合物的性质、用途的说法错误的是
A.纯铝的硬度和强度较小,不适合用于制造机器零部件
B.可用NaOH溶液除去Fe2O3粉末中少量的Al2O3
C.铝合金是用来制造飞机和宇宙飞船的理想材料
D.铝制品廉价易得,适用于厨房蒸煮和长期存放碱性食物
√
制造机器零部件要求材料硬度高、强度大,而纯铝硬度、强度较小,不适合,A正确;
氧化铁不与氢氧化钠溶液反应,氧化铝为两性氧化物,与氢氧化钠溶液反应生成偏铝酸钠和水,B正确;
铝合金硬度高、质量轻,是用来制造飞机和宇宙飞船的理想材料,C正确;
铝能与酸、碱发生反应,铝制品不能长期存放酸性或碱性较强的食物,D错误。
2.把镁粉中混入的少量铝粉除去,应选用的试剂是
A.盐酸 B.氯水
C.烧碱溶液 D.食盐水
√
盐酸和镁粉、铝粉都反应,不能把镁粉中混有的少量铝粉除去,故A错误;
氯水和镁粉、铝粉都反应,不能把镁粉中混有的少量铝粉除去,故B错误;
烧碱和镁粉不反应,和铝粉反应,因此可以把镁粉中混有的少量铝粉除去,故C正确;
食盐水和镁粉、铝粉都不反应,不能把镁粉中混有的少量铝粉除去,故D错误。
3.向某溶液中加入铝粉能放出H2,下列各组离子一定不能在该溶液中大量共存的是
√
加入铝粉能放出H2,说明该溶液可能呈酸性,也可能呈碱性。A选项中的4种离子可在酸性溶液中大量共存;
C选项中的离子在碱性溶液中可以大量共存;
D选项中的离子在酸性溶液、碱性溶液中都可以大量共存。
4.等体积的盐酸和苛性钠溶液分别与两份足量的铝粉反应,在相同条件下产生氢气的体积比为1∶3,则盐酸和苛性钠溶液的物质的量浓度之比为
A.1∶1 B.2∶1
C.3∶1 D.2∶3
√
由2Al+6HCl===2AlCl3+3H2↑、2Al+2NaOH+2H2O===2NaAlO2+3H2↑可知,产生氢气的体积比为1∶3,需要盐酸和氢氧化钠的物质的量之比为1∶1,溶液的体积相同,故盐酸和苛性钠溶液的物质的量浓度之比也为1∶1。
返回
新型合金
三
1.储氢合金:一类能够大量吸收H2,并与H2结合成 的材料。如Ti-Fe合金、La-Ni合金等,为氢气作为能源的实际应用起到重要的推动作用。
2.其他新型合金: 、 和 等新型合金广泛应用于航空航天、生物工程和电子工业等领域。
3.用途广泛的稀土金属
(1)镧系元素(57~71号元素)及钇和钪,共17种元素为稀土元素。
我国是稀土资源大国,到目前为止,我国的稀土储量、稀土产量、稀土用量和稀土出口量均居世界第一位。
金属氢化物
钛合金
耐热合金
形状记忆合金
(2)稀土金属有着广泛的用途,它既可以单独使用,也可用于生产合金。在合金中加入适量稀土金属,能大大改善合金的性能。因而,稀土元素又被称为“冶金工业的维生素”。
(3)稀土金属可用于制造引火合金、永磁材料、超导材料和发光材料等。稀土金属除广泛应用在冶金、石油化工、材料工业、医药及农业领域外,还逐渐深入到许多现代科技领域。
应用体验
1.我国“蛟龙”号载人潜水器已成功下潜至海里7 062.68米处。“蛟龙”号载人潜水器的外壳是耐超高压的钛合金,下面有关合金的说法正确的是
A.钛合金是一种新型金属单质
B.钛合金熔点比钛金属高
C.钛合金的硬度与钛单质相同
D.青铜、合金钢和硬铝都是合金
√
合金含有两种或者两种以上元素,不是单质,故A错误;
合金熔点一般比其组分中任一金属的熔点低,故B错误;
合金硬度一般比其组分中任一金属的硬度大,故C错误;
青铜、合金钢和硬铝都是合金,故D正确。
2.下列关于新型合金材料说法不正确的是
A.镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料
B.钛合金生物相容性好,强度大,可作人造骨骼
C.形状记忆合金可在使合金发生形变的作用力消失后恢复原状
D.利用合金的熔点低于成分金属这一特点可制得耐热合金
√
储氢材料是一类能可逆地吸收和释放氢气的材料,镧镍合金能大量吸收H2形成金属氢化物,是目前解决氢气的储存和运输问题的材料,故A正确;
钛合金与人体有很好的相容性,且性质稳定,抗腐蚀性强,所以可用来制造人造骨骼,故B正确;
形状记忆合金可在使合金发生形变的作用力消失后恢复原状,故C正确;
耐热合金的熔点很高,与合金的特性无关,故D错误。
返回
随堂演练 知识落实
1.(2021·广东,1)今年五一假期,人文考古游持续成为热点。很多珍贵文物都记载着中华文明的灿烂成就,具有深邃的文化寓意和极高的学术价值。下列国宝级文物主要由合金材料制成的是
选项 A B C D
文物
名称 铸客大铜鼎 河姆渡出土陶灶 兽首玛瑙杯 角形玉杯
√
1
2
3
4
铸客大铜鼎属于铜的合金,A符合题意。
2.(2022·无锡教育科学研究院高一质检)下列关于合金的叙述正确的是
A.铝合金硬度比纯铝小
B.生铁是铁碳合金,钢是纯净的铁单质
C.硬铝密度小、强度高,常用于制造飞机外壳
D.不锈钢和钢都是铁合金,性质完全相同
1
2
3
4
√
合金的硬度比其任一成分金属都大,铝合金硬度比纯铝大,A错误;
生铁是铁碳合金,钢的含碳量比生铁低,也是铁碳合金,B错误;
不锈钢和钢都是铁合金,但其内部结构和组分不同,性质不相同,D错误。
1
2
3
4
3.储氢合金是一种新型合金。下列关于储氢合金的说法错误的是
A.储氢合金是一类能大量吸收H2,并与H2结合成金属氢化物的材料
B.储氢合金吸收H2的过程属于物理变化
C.储氢合金NaAlH4中氢元素的化合价为-1价
D.具有实用价值的储氢合金在室温下吸、放氢的速率快
√
1
2
3
4
储氢合金是一类能够大量吸收氢气,并与氢气结合成金属氢化物的材料,如镧镍合金,它吸收氢气可结合成金属氢化物,故A正确;
氢气在储存过程中与金属反应生成其他物质,是化学变化,故B错误;
NaAlH4中Na是+1价,Al是+3价,则H为-1价,故C正确;
储氢合金储氢量大,吸、放氢速率快,所以可用于氢燃料汽车,故D正确。
1
2
3
4
4.合金是由两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。
(1)下列物质不属于合金的是_____(填字母,下同)。
A.明矾 B.硬铝 C.生铁 D.青铜
1
2
3
4
A
A属于化合物;硬铝中含铝、铜、镁等,生铁中主要含铁、碳,青铜中含有铜、锡等,它们都属于合金。
金 属 Na Cu Al Fe
熔点/℃ 97.8 1 083 660 1 535
沸点/℃ 883 2 567 2 467 2 750
(2)已知下表中四种金属的熔、沸点:
1
2
3
4
其中不能形成合金的是_______。
①Cu与Na ②Fe与Cu ③Fe与Na ④Al与Na
A.①② B.①③ C.①④ D.②④
B
当一种金属的熔点超过另一种金属的沸点时,它们就不可能熔合在一起形成合金。
1
2
3
4
返回
课时对点练
题组一 合金及铁合金
1.(2022·辽宁辽阳高一月考)下列材料不属于合金的是
A.铸造下水井盖的生铁 B.储氢用的La-Ni合金
C.可用于机器人“皮肤”的橡胶 D.可用于军用车辆的超级钢
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
生铁是Fe和C的合金,A不符合题意;
橡胶不是合金,C符合题意;
超级钢是铁合金,D不符合题意。
2.2020年11月24日4时30分,我国在中国文昌航天发射场,用长征五号遥五运载火箭成功发射探月工程“嫦娥五号”探测器,开启我国首次地外天体采样返回之旅。“嫦娥五号”中使用了大量合金。下列有关金属或合金的说法中不正确的是
A.生铁属于合金
B.一般合金的熔点比各成分金属的低
C.合金的化学性质与其成分金属的化学性质不同
D.改变原料的配比、生成合金的条件,可以得到具有不同性能的合金
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
生铁由铁和碳等元素组成,属于合金,故A正确;
形成合金后,结构发生了改变,一般合金的熔点比各成分金属的低,故B正确;
合金的化学性质与其成分金属的化学性质相同,故C错误;
改变原料的配比、生成合金的条件,组成合金的成分、结构不同,对合金的性质产生不同的影响,可以得到具有不同性能的合金,故D正确。
3.下列关于钢的说法不正确的是
A.根据含碳量不同,碳素钢可分为高碳钢、中碳钢和低碳钢
B.含碳量低的钢,硬度较大,韧性较弱
C.向钢中加入一定量的一种或几种其他元素,可得到具有各种不同性能
的合金钢
D.不锈钢中主要加入了铬、镍两种元素
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
钢的分类有多种,以含碳量的多少可分为高碳钢、中碳钢和低碳钢,故A正确;
钢中含碳量多时,硬度大,韧性弱,含碳量少时,硬度小,韧性强,故B错误;
合金就是几种金属或金属与非金属熔合在一起形成的具有金属特性的物质,故C正确;
普通钢中加入铬元素使钢的表面形成了致密而坚硬的氧化膜,加入镍元素使钢不能被多种酸、碱、盐溶液腐蚀,故D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
题组二 铝和铝合金
4.铝镁合金材料在现代装饰材料中占有极为重要的地位,这种材料常用于制作门窗框、防护栏等。铝镁合金的下列性质与以上用途无关的是
A.不易生锈 B.导电性好 C.密度小 D.强度高
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
铝镁合金作为现代装饰材料与其导电性无关。
5.为了除去MgO中混有的少量杂质Al2O3,可选用的试剂是
A.KOH溶液 B.氨水
C.稀盐酸 D.稀醋酸
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
要除去MgO中混有的少量杂质Al2O3,所加试剂只能与Al2O3反应而不能与MgO反应,反应完全后过滤即可。氨水与Al2O3不反应,稀盐酸、稀醋酸均能与MgO反应,只有KOH溶液能与Al2O3反应而与MgO不反应。
6.(2022·绵阳南山中学双语学校高一开学考试)若在加入Al能放出H2的溶液中分别加入下列各组离子,可能大量共存的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Mg2+与OH-结合生成沉淀,不能共存,故B项错误;
酸或碱溶液中,各离子之间都不反应,可共存,故C项正确;
7.在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡。然后将两球分别浸没在溶液质量相等的稀烧碱溶液和
硫酸铜溶液中一段时间,如图所示。下列说法正
确的是
A.铝球表面有气泡产生,且有白色沉淀生成,杠杆不平衡
B.铝球表面有气泡产生,溶液澄清;铁球表面有红色物质析出,溶液蓝
色变浅,杠杆右边下沉
C.反应后去掉两烧杯,杠杆仍平衡
D.右边球上出现红色,左边溶液的c(OH-)增大
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
左烧杯中的铝球与氢氧化钠溶液反应:2Al+2NaOH+2H2O===2NaAlO2
+3H2↑,有一部分铝溶解,并产生气体,生成偏铝酸钠;右烧杯铁球浸在硫酸铜溶液中发生反应:Fe+CuSO4===FeSO4+Cu,铁球表面有红色物质析出,铁球质量增加,溶液蓝色变浅,左边消耗OH-,使c(OH-)减小。
题组三 新型合金
8.钛和钛合金被誉为“21世纪最有发展前景的金属材料”,它们具有很多优良的性能,如熔点高、密度小、可塑性好、易于加工,尤其是钛合金与人体器官具有很好的“生物相容性”。根据它们的主要性能,下列用途不切实际的是
A.用来做保险丝 B.用于制造航天飞机
C.用来制造人造骨 D.用于家庭装修,制作钛合金装饰门
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
由于其熔点高,不适合做保险丝,A错误;
由于钛和钛合金密度小、可塑性好,因此可用于航天领域,B正确;
由于钛合金与人体器官具有很好的“生物相容性”,可与人体的组织相容,不引起排斥反应,因此可以用来制造人造骨,C正确;
由于其密度小、可塑性好、易于加工,因此可用于家庭装修,做钛合金装饰门,D正确。
9.形状记忆合金是一种在加热升温后能完全消除其在较低的温度下发生的变形,恢复其变形前原始形状的合金材料,即拥有“记忆”效应的合金。下列变化不是利用合金记忆效应的是
A.脊柱侧弯矫形采用的哈伦顿棒,如果矫形棒的矫正力有变化,把温度升高
到比体温约高5 ℃,就能恢复足够的矫正力
B.合金在高温环境下制作好天线,再在低温下把它压缩成一个小铁球,运上
太空中,太阳的强烈的辐射使它恢复原来的形状
C.用合金制造的精密仪器或精密车床,一旦由于震动、碰撞等原因变形,只
需加热即可排除故障
D.汽车受损变形后,利用钣金喷漆整形
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
10.(2022·张家口高一检测)下列离子方程式正确的是
A.铁与稀硫酸的反应:2Fe+6H+===2Fe3+ +3H2↑
B.将碳酸氢钠溶液与NaOH溶液混合:
C.氧化铝与烧碱溶液反应:Al2O3+2OH-===2Al3+ +4O2-+H2O
D.铝与NaOH溶液反应:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
铁与稀硫酸反应生成硫酸亚铁和氢气,反应的离子方程式是Fe+2H+===Fe2++H2↑,故A错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
11.氧化铝的熔点很高,常用于制造耐火材料,例如制作坩埚。下列操作不能在氧化铝坩埚中进行的是
A.加热使胆矾失去结晶水 B.加热使高锰酸钾分解
C.加热熔化烧碱 D.加热分解碱式碳酸铜
√
氧化铝能与强酸、强碱反应,用氧化铝材料制作的坩埚不能加热强酸、强碱。
12.下列变化不可能通过一步反应直接完成的是
A.Al(OH)3→Al2O3 B.Al2O3→Al(OH)3
C.Al→ D.AlCl3→Al(OH)3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
Al(OH)3→Al2O3,氢氧化铝受热反应生成氧化铝和水,可以一步完成,A不符合题意;
Al2O3→Al(OH)3,Al2O3难溶于水,应先将Al2O3与酸反应变成Al3+或与强碱溶液反应生成 后,然后加入弱碱或弱酸反应生成Al(OH)3,不可以一步完成,B符合题意;
Al和NaOH溶液反应生成NaAlO2和H2,可以一步完成,C不符合题意;
AlCl3→Al(OH)3,氯化铝和氨水反应生成氢氧化铝和氯化铵,可以一步完成,D不符合题意。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
13.甲、乙两个烧杯中分别盛有100 mL 4.0 mol·L-1的盐酸和100 mL 4.0 mol·
L-1 NaOH溶液,向两个烧杯中均加入5.4 g铝粉,在相同状况下产生气体的体积比为
A.1∶1 B.2∶3
C.3∶2 D.3∶1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
甲、乙两烧杯中含HCl、NaOH的物质的量都为0.4 mol,根据化学方程式:2Al+6HCl===2AlCl3+3H2↑、2Al+2NaOH+2H2O===2NaAlO2
+3H2↑可知,5.4 g(即0.2 mol)Al分别与盐酸和NaOH溶液反应时,盐酸不足量而NaOH过量,故Al与盐酸反应生成0.2 mol H2,与NaOH溶液反应生成0.3 mol H2,其体积比为2∶3。
14.铁、铝的混合物进行如下实验:
(1)操作X的名称是_______。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
过滤
加入足量NaOH溶液,Al溶解,Fe不溶解,操作X为过滤。
(2)气体A是________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
H2
Al与氢氧化钠溶液反应产生氢气,气体A为H2。
(3)A与Cl2混合光照可能发生爆炸,生成______(填化学式),A在该反应中作为________(填“氧化剂”或“还原剂”)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
HCl
H2与Cl2反应生成HCl。
还原剂
(4)溶液B中阴离子除OH-外还有________,溶液D中存在的金属离子为______。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Fe2+
15.铝镁合金已成为轮船制造、化工生产等行业的重要材料。某研究性学习小组的三位同学为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计下列三种不同实验方案进行探究。填写下列空白。
探究一
实验方案:铝镁合金 测定剩余固体质量。实验中发生反应的化学方程式是_____________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
2H2O+2Al+2NaOH===2NaAlO2+3H2↑
实验步骤:
(1)称取5.4 g铝镁合金粉末样品,投入体积为V、浓度为2.0 mol·L-1的NaOH溶液中,充分反应。为保证合金充分反应,NaOH溶液的体积V≥_________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
97 mL
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
铝镁合金中镁的质量分数至少为3%时,5.4 g铝镁合金粉末样品中铝的质量为5.4 g×(1-3%)=5.4 g×97%,则:
2Al + 2NaOH+2H2O===2NaAlO2+3H2↑
2 2
所以n(NaOH)=0.194 mol,需要NaOH溶液的体积V= =
0.097 L=97 mL;为保证合金充分反应,NaOH溶液的体积V≥97 mL。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将______(填“偏大”或“偏小”)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
偏大
镁上会附着NaAlO2等物质,未洗涤导致测定的镁的质量偏大,镁的质量分数将偏大。
探究二
实验方案:铝镁合金 测定生成气体的体积(实验装置如图所示)。
(1)某同学提出该实验装置不够完善,应在A、B之间添加一个除酸雾的装置。你的意见是_______(填“需要”或“不需要”)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
不需要
因为氯化氢极易溶于水,挥发的氯化氢不影响氢气体积的测定结果,所以不需要加除酸雾装置。
(2)为使测定结果尽可能精确,实验中应注意的问题有(写出两点):
①__________________,
②______________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
冷却至室温再读数
读数时,使量气管左右液面相平
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
反应中装置的气密性、合金是否完全溶解、量气装置的使用都会影响测定结果。因此为使测定结果尽可能精确,
实验中应注意的问题有:检查装置的气密
性,加入足量盐酸,调整量气管C的高度,
使C中液面与B中液面相平,待冷却至室温
再读取体积等。
探究三
实验方案:称量x g铝镁合金粉末,放入装有足量氧气的容器中使其充分灼烧。
(1)欲计算镁的质量分数,该实验中还需要测定的数据是_____________
_____________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
充分灼烧后固
体粉末的质量
Mg、Al均与氧气反应生成金属氧化物,则还需测定生成物的质量,才能计算出Mg的质量分数。
(2)若用空气代替O2进行实验,对测定结果是否有影响?_____(填“是”或“否”)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
是
若用空气代替O2进行实验,会发生反应:3Mg+N2 Mg3N2,2Mg+CO2 2MgO+C,对测定结果会有影响。
返回
第三章
本课结束
