专题5 微观结构与物质的多样性 第三单元 第2课时 晶体与非晶体 课时作业(word版含解析)
文档属性
| 名称 | 专题5 微观结构与物质的多样性 第三单元 第2课时 晶体与非晶体 课时作业(word版含解析) |

|
|
| 格式 | doc | ||
| 文件大小 | 414.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-23 23:52:07 | ||
图片预览




文档简介
专题5 微观结构与物质的多样性 第三单元 第2课时 晶体与非晶体 课时作业
1.我们熟悉的食盐、金属、刨冰、钻石、水晶等都是晶体;而同样透明的玻璃却是非晶体。下列关于晶体和非晶体的本质区别的叙述中,正确的是( )
A.是否具有规则几何外形的固体
B.是否具有固定组成的物质
C.是否具有美观对称的外形
D.内部构成微粒是否在空间呈有规则的重复排列
2.下列晶体中属于原子晶体的是( )
A.氖 B.食盐
C.干冰 D.金刚石
3.下列物质性质的变化规律与化学键强弱无关的是( )
A.F2、Cl2、Br2、I2的熔沸点逐渐升高
B.HF、HCl、HBr、HI的热稳定性依次减弱
C.金刚石的硬度、熔点、沸点都高于晶体硅
D.NaF、NaCl、NaBr、NaI的熔点依次降低
4.下列说法正确的是( )
A.氯化氢溶于水能电离出H+、Cl-,所以氯化氢是离子化合物
B.碘晶体受热转变成碘蒸气,破坏了共价键
C.CH3CH2OH和CH3OCH3互为同分异构体
D.加热氧化镁使之熔化克服的是共价键
5.下表列出的对晶体的说明中,错误的是( )
选项 A B C D
晶体名称 碘化钾 干冰 石墨 碘
晶体中的粒子 阴、阳离子 分子 原子 分子
粒子间的作用 离子键 分子间作用力 共价键 分子间作用力
6.下列说法一定正确的是( )
A.其水溶液导电的一定是离子晶体
B.熔融态导电的一定是离子晶体
C.共价化合物形成的晶体一定是分子晶体
D.固态不导电、熔融态导电的一定是离子晶体
7.下列说法正确的是( )
A.Na2O2晶体中阴离子与阳离子数目之比为1∶1
B.只有非金属元素之间才能形成共价化合物
C.分子晶体中一定含有共价键
D.在晶体中只要有阴离子就一定有阳离子
8.下列各组物质中,按熔点由低到高的顺序排列正确的是( )
A.Cl2、Br2、I2 B.CO2、SiO2、KCl
C.O2、I2、Hg D.SiC、NaCl、SO2
9.下表给出几种氯化物的熔、沸点:
NaCl MgCl2 CaCl2 SiCl4
熔点(℃) 801 712 782 -68
沸点(℃) 1 465 1 412 1 600 57.6
则下列各项中与表中数据一致的有( )
①CaCl2属于离子晶体 ②SiCl4是分子晶体 ③1 500 ℃时,NaCl可汽化 ④MgCl2水溶液不能导电
A.仅① B.仅②
C.①②④ D.①②③
10.元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a-b),L层电子数为(a+b),则A、B两元素所形成的化合物的晶体类型为( )
A.原子晶体 B.分子晶体
C.离子晶体 D.金属晶体
11.在原子序数为1~18的元素中,其单质可以形成原子晶体的元素有 (填元素名称,下同),其单质是金属晶体的元素有 ,
举出三种其单质是分子晶体且在常温下是气体的元素: 。
12.现有几组物质的熔点(℃)数据:
A组 B组 C组 D组
金刚石:>3 550 Li:181 HF:-84 NaCl:801
硅晶体:1 410 Na:98 HCl:-114 KCl:776
硼晶体:2 300 K:64 HBr:-87 RbCl:718
二氧化硅:1 723 Rb:39 HI:-51 CsCl:645
据此回答下列问题:
(1)A组属于 晶体,其熔化时克服的微粒间的作用力是 。
(2)B组晶体属于 晶体。
(3)C组晶体属于 晶体,晶体含有的作用力有 。
(4)D组晶体可能具有的性质是 (填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
13.A、B、C、D都是短周期主族元素,原子半径:D>C>A>B。已知A、B处于同一周期,A、C处于同一主族;C原子核内的质子数等于A、B原子核内的质子数之和;C原子最外层电子数是D原子最外层电子数的4倍。试回答下列问题:
(1)这四种元素分别是A ,B ,C ,D (填元素名称);
(2)B、C、D元素的单质的熔点由高到低的顺序是_______________________(填化学式);
(3)C的单质是 (填“原子”“离子”或“分子”,下同)晶体,B的单质和D的单质在常温下反应得到的生成物属于 晶体。
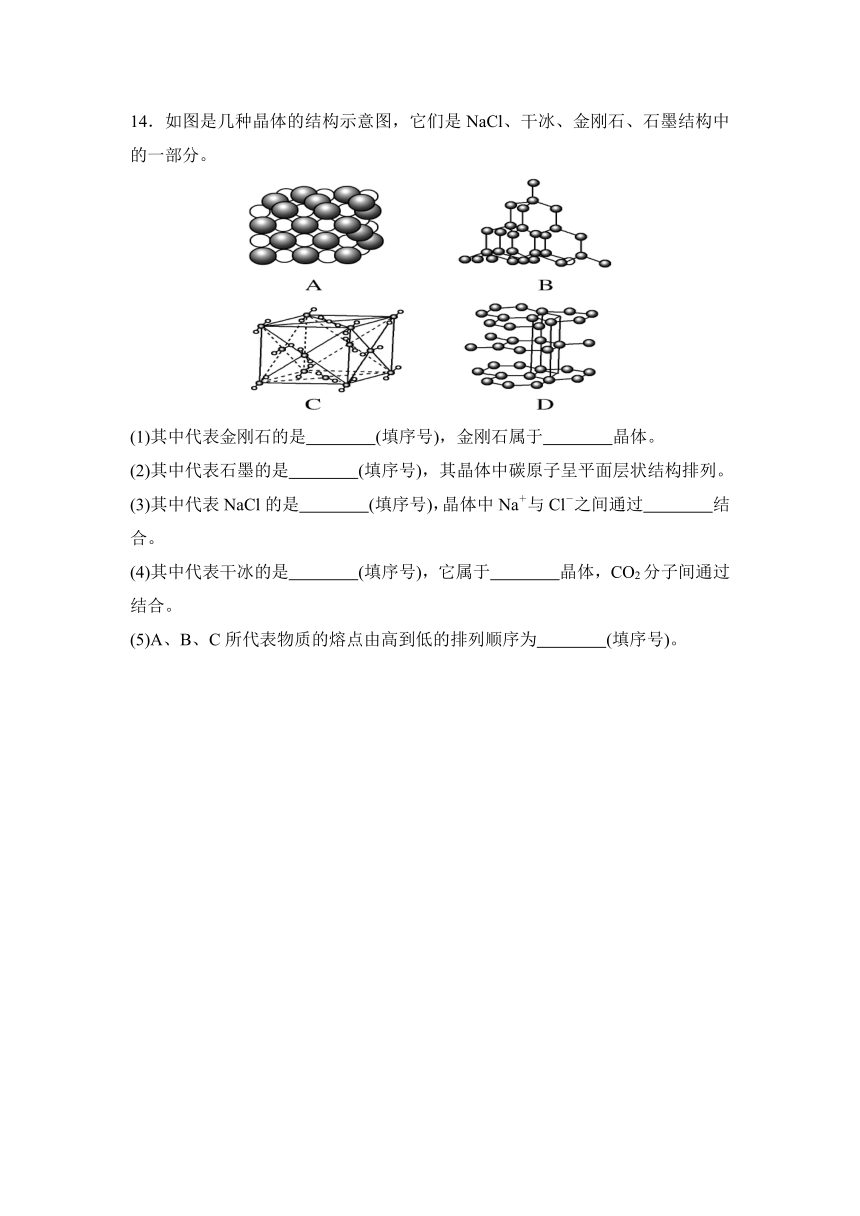
14.如图是几种晶体的结构示意图,它们是NaCl、干冰、金刚石、石墨结构中的一部分。
(1)其中代表金刚石的是 (填序号),金刚石属于 晶体。
(2)其中代表石墨的是 (填序号),其晶体中碳原子呈平面层状结构排列。
(3)其中代表NaCl的是 (填序号),晶体中Na+与Cl-之间通过 结合。
(4)其中代表干冰的是 (填序号),它属于 晶体,CO2分子间通过 结合。
(5)A、B、C所代表物质的熔点由高到低的排列顺序为 (填序号)。
专题5 微观结构与物质的多样性 第三单元 第2课时 晶体与非晶体 课时作业
1.我们熟悉的食盐、金属、刨冰、钻石、水晶等都是晶体;而同样透明的玻璃却是非晶体。下列关于晶体和非晶体的本质区别的叙述中,正确的是( )
A.是否具有规则几何外形的固体
B.是否具有固定组成的物质
C.是否具有美观对称的外形
D.内部构成微粒是否在空间呈有规则的重复排列
解析 有规则几何外形或美观对称的固体不一定都是晶体,如玻璃; 具有固定组成的物质也不一定是晶体,如某些无定形体也具有固定的组成。晶体和非晶体的本质区别在于微观结构不同。
答案 D
2.下列晶体中属于原子晶体的是( )
A.氖 B.食盐
C.干冰 D.金刚石
解析 氖、干冰属于分子晶体,食盐属于离子晶体,金刚石属于原子晶体。
答案 D
3.下列物质性质的变化规律与化学键强弱无关的是( )
A.F2、Cl2、Br2、I2的熔沸点逐渐升高
B.HF、HCl、HBr、HI的热稳定性依次减弱
C.金刚石的硬度、熔点、沸点都高于晶体硅
D.NaF、NaCl、NaBr、NaI的熔点依次降低
解析 A项,F2、Cl2、Br2、I2形成的晶体为分子晶体,熔化时仅破坏分子间作用力,与化学键无关;B项,热稳定性是指物质受热分解的难易程度,而HX分解时要破坏H—X键,从HF到HI其键能依次减小,故其稳定性依次减弱;C项,由于金刚石中碳碳键的键能大于晶体硅中硅硅键的键能,因此金刚石的硬度、熔点、沸点较晶体硅高;D项,NaX为离子晶体,熔化时破坏离子键。
答案 A
4.下列说法正确的是( )
A.氯化氢溶于水能电离出H+、Cl-,所以氯化氢是离子化合物
B.碘晶体受热转变成碘蒸气,破坏了共价键
C.CH3CH2OH和CH3OCH3互为同分异构体
D.加热氧化镁使之熔化克服的是共价键
解析 氯化氢是共价化合物,故A项错误;碘晶体受热转变成碘蒸气,破坏了分子间作用力,故B项错误;CH3CH2OH和CH3OCH3的分子式相同,结构不同,互为同分异构体,故C项正确;加热氧化镁使之熔化克服的是离子键,故D项错误。
答案 C
5.下表列出的对晶体的说明中,错误的是( )
选项 A B C D
晶体名称 碘化钾 干冰 石墨 碘
晶体中的粒子 阴、阳离子 分子 原子 分子
粒子间的作用 离子键 分子间作用力 共价键 分子间作用力
解析 干冰和碘都是分子晶体,熔化时克服分子间作用力;石墨是混合型晶体,呈层状结构,层与层之间为分子间作用力,碳原子与碳原子之间形成共价键,熔化时两种作用力都需克服,故C错。
答案 C
6.下列说法一定正确的是( )
A.其水溶液导电的一定是离子晶体
B.熔融态导电的一定是离子晶体
C.共价化合物形成的晶体一定是分子晶体
D.固态不导电、熔融态导电的一定是离子晶体
解析 部分分子晶体和离子晶体的水溶液能导电。固态不导电、熔融态导电是离子晶体区别其他晶体的性质。共价化合物形成的晶体可能是分子晶体,如干冰;也可能是原子晶体,如石英。
答案 D
7.下列说法正确的是( )
A.Na2O2晶体中阴离子与阳离子数目之比为1∶1
B.只有非金属元素之间才能形成共价化合物
C.分子晶体中一定含有共价键
D.在晶体中只要有阴离子就一定有阳离子
解析 A项中Na2O2的电子式为,晶体中阴、阳离子数目之比为1∶2,不是1∶1,A项错误;B项中如BeCl2和AlCl3均为共价化合物,B项错误;C项中稀有气体元素的原子本身已达到稳定结构,当其呈现晶体状态时,没有共价键,只存在分子间作用力,故C项也错误;D项晶体中只要有阴离子存在,那么就一定存在阳离子,故D项正确。
答案 D
8.下列各组物质中,按熔点由低到高的顺序排列正确的是( )
A.Cl2、Br2、I2 B.CO2、SiO2、KCl
C.O2、I2、Hg D.SiC、NaCl、SO2
解析 Cl2、Br2、I2的晶体属于分子晶体,且组成和结构相似,随着相对分子质量的增大,分子间作用力增大,晶体的熔点逐渐升高,A项正确。CO2、KCl、SiO2的晶体分别属于分子晶体、离子晶体、原子晶体,熔点:原子晶体>离子晶体>分子晶体,B项错误。常温、常压下,O2为气态,I2为固态,Hg为液态,C项错误。SiC、NaCl、SO2的晶体分别为原子晶体、离子晶体、分子晶体,它们的熔点逐渐降低,D项错误。
答案 A
9.下表给出几种氯化物的熔、沸点:
NaCl MgCl2 CaCl2 SiCl4
熔点(℃) 801 712 782 -68
沸点(℃) 1 465 1 412 1 600 57.6
则下列各项中与表中数据一致的有( )
①CaCl2属于离子晶体 ②SiCl4是分子晶体 ③1 500 ℃时,NaCl可汽化 ④MgCl2水溶液不能导电
A.仅① B.仅②
C.①②④ D.①②③
解析 熔、沸点的差异说明了晶体中微粒间作用力的不同,即晶体类型不同。判断出晶体类型,然后根据各晶体的性质特点进行判断。
答案 D
10.元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a-b),L层电子数为(a+b),则A、B两元素所形成的化合物的晶体类型为( )
A.原子晶体 B.分子晶体
C.离子晶体 D.金属晶体
解析 元素A和B的原子序数都小于18,B元素原子的M层电子数为(a-b),L层电子数为(a+b),则a+b=8,A元素原子最外层电子数为a,次外层电子数为b,则A元素原子的次外层为K层,即b=2,有2个电子层,所以a=8-2=6,故A为氧元素,B原子的M层电子数为6-2=4,故B为硅元素,A、B两元素所形成的化合物为SiO2,属于原子晶体,故选A。
答案 A
11.在原子序数为1~18的元素中,其单质可以形成原子晶体的元素有 (填元素名称,下同),其单质是金属晶体的元素有 ,
举出三种其单质是分子晶体且在常温下是气体的元素: 。
答案 硼、碳、硅 锂、铍、钠、镁、铝 氧、氮、氟(答案合理即可)
12.现有几组物质的熔点(℃)数据:
A组 B组 C组 D组
金刚石:>3 550 Li:181 HF:-84 NaCl:801
硅晶体:1 410 Na:98 HCl:-114 KCl:776
硼晶体:2 300 K:64 HBr:-87 RbCl:718
二氧化硅:1 723 Rb:39 HI:-51 CsCl:645
据此回答下列问题:
(1)A组属于 晶体,其熔化时克服的微粒间的作用力是 。
(2)B组晶体属于 晶体。
(3)C组晶体属于 晶体,晶体含有的作用力有 。
(4)D组晶体可能具有的性质是 (填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
解析 根据题给各组物质的熔点差异,可判断出A组物质为原子晶体,B组为金属晶体,C组为分子晶体,D组为离子晶体。
答案 (1)原子 共价键 (2)金属 (3)分子 分子间作用力、共价键 (4)②④
13.A、B、C、D都是短周期主族元素,原子半径:D>C>A>B。已知A、B处于同一周期,A、C处于同一主族;C原子核内的质子数等于A、B原子核内的质子数之和;C原子最外层电子数是D原子最外层电子数的4倍。试回答下列问题:
(1)这四种元素分别是A ,B ,C ,D (填元素名称);
(2)B、C、D元素的单质的熔点由高到低的顺序是_______________________(填化学式);
(3)C的单质是 (填“原子”“离子”或“分子”,下同)晶体,B的单质和D的单质在常温下反应得到的生成物属于 晶体。
解析 由A、B、C、D都是短周期主族元素,A、C处于同一主族,且原子半径:C>A,可知C比A的原子序数大8;C原子核内的质子数等于A、B原子核内的质子数之和,则B的原子序数为8,B是氧;C原子最外层电子数是D原子最外层电子数的4倍,C原子最外层电子数不应是8,则D原子最外层电子数为1,结合原子半径的大小关系可知D是钠,C是硅,A是碳。
答案 (1)碳 氧 硅 钠 (2)Si>Na>O2
(3)原子 离子
14.如图是几种晶体的结构示意图,它们是NaCl、干冰、金刚石、石墨结构中的一部分。
(1)其中代表金刚石的是 (填序号),金刚石属于 晶体。
(2)其中代表石墨的是 (填序号),其晶体中碳原子呈平面层状结构排列。
(3)其中代表NaCl的是 (填序号),晶体中Na+与Cl-之间通过 结合。
(4)其中代表干冰的是 (填序号),它属于 晶体,CO2分子间通过 结合。
(5)A、B、C所代表物质的熔点由高到低的排列顺序为 (填序号)。
解析 金刚石是原子晶体,碳原子间以共价键结合,B是金刚石的结构模型。石墨是层状结构,D是石墨的结构模型。氯化钠是Na+和Cl-按个数比1∶1堆积而成的离子晶体,A是氯化钠的结构模型。干冰晶体中,CO2分子间依靠分子间作用力结合,C是干冰的结构模型。一般来说,晶体的熔点:原子晶体>离子晶体>分子晶体。
答案 (1)B 原子 (2)D (3)A 离子键 (4)C 分子 分子间作用力 (5)B>A>C
1.我们熟悉的食盐、金属、刨冰、钻石、水晶等都是晶体;而同样透明的玻璃却是非晶体。下列关于晶体和非晶体的本质区别的叙述中,正确的是( )
A.是否具有规则几何外形的固体
B.是否具有固定组成的物质
C.是否具有美观对称的外形
D.内部构成微粒是否在空间呈有规则的重复排列
2.下列晶体中属于原子晶体的是( )
A.氖 B.食盐
C.干冰 D.金刚石
3.下列物质性质的变化规律与化学键强弱无关的是( )
A.F2、Cl2、Br2、I2的熔沸点逐渐升高
B.HF、HCl、HBr、HI的热稳定性依次减弱
C.金刚石的硬度、熔点、沸点都高于晶体硅
D.NaF、NaCl、NaBr、NaI的熔点依次降低
4.下列说法正确的是( )
A.氯化氢溶于水能电离出H+、Cl-,所以氯化氢是离子化合物
B.碘晶体受热转变成碘蒸气,破坏了共价键
C.CH3CH2OH和CH3OCH3互为同分异构体
D.加热氧化镁使之熔化克服的是共价键
5.下表列出的对晶体的说明中,错误的是( )
选项 A B C D
晶体名称 碘化钾 干冰 石墨 碘
晶体中的粒子 阴、阳离子 分子 原子 分子
粒子间的作用 离子键 分子间作用力 共价键 分子间作用力
6.下列说法一定正确的是( )
A.其水溶液导电的一定是离子晶体
B.熔融态导电的一定是离子晶体
C.共价化合物形成的晶体一定是分子晶体
D.固态不导电、熔融态导电的一定是离子晶体
7.下列说法正确的是( )
A.Na2O2晶体中阴离子与阳离子数目之比为1∶1
B.只有非金属元素之间才能形成共价化合物
C.分子晶体中一定含有共价键
D.在晶体中只要有阴离子就一定有阳离子
8.下列各组物质中,按熔点由低到高的顺序排列正确的是( )
A.Cl2、Br2、I2 B.CO2、SiO2、KCl
C.O2、I2、Hg D.SiC、NaCl、SO2
9.下表给出几种氯化物的熔、沸点:
NaCl MgCl2 CaCl2 SiCl4
熔点(℃) 801 712 782 -68
沸点(℃) 1 465 1 412 1 600 57.6
则下列各项中与表中数据一致的有( )
①CaCl2属于离子晶体 ②SiCl4是分子晶体 ③1 500 ℃时,NaCl可汽化 ④MgCl2水溶液不能导电
A.仅① B.仅②
C.①②④ D.①②③
10.元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a-b),L层电子数为(a+b),则A、B两元素所形成的化合物的晶体类型为( )
A.原子晶体 B.分子晶体
C.离子晶体 D.金属晶体
11.在原子序数为1~18的元素中,其单质可以形成原子晶体的元素有 (填元素名称,下同),其单质是金属晶体的元素有 ,
举出三种其单质是分子晶体且在常温下是气体的元素: 。
12.现有几组物质的熔点(℃)数据:
A组 B组 C组 D组
金刚石:>3 550 Li:181 HF:-84 NaCl:801
硅晶体:1 410 Na:98 HCl:-114 KCl:776
硼晶体:2 300 K:64 HBr:-87 RbCl:718
二氧化硅:1 723 Rb:39 HI:-51 CsCl:645
据此回答下列问题:
(1)A组属于 晶体,其熔化时克服的微粒间的作用力是 。
(2)B组晶体属于 晶体。
(3)C组晶体属于 晶体,晶体含有的作用力有 。
(4)D组晶体可能具有的性质是 (填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
13.A、B、C、D都是短周期主族元素,原子半径:D>C>A>B。已知A、B处于同一周期,A、C处于同一主族;C原子核内的质子数等于A、B原子核内的质子数之和;C原子最外层电子数是D原子最外层电子数的4倍。试回答下列问题:
(1)这四种元素分别是A ,B ,C ,D (填元素名称);
(2)B、C、D元素的单质的熔点由高到低的顺序是_______________________(填化学式);
(3)C的单质是 (填“原子”“离子”或“分子”,下同)晶体,B的单质和D的单质在常温下反应得到的生成物属于 晶体。
14.如图是几种晶体的结构示意图,它们是NaCl、干冰、金刚石、石墨结构中的一部分。
(1)其中代表金刚石的是 (填序号),金刚石属于 晶体。
(2)其中代表石墨的是 (填序号),其晶体中碳原子呈平面层状结构排列。
(3)其中代表NaCl的是 (填序号),晶体中Na+与Cl-之间通过 结合。
(4)其中代表干冰的是 (填序号),它属于 晶体,CO2分子间通过 结合。
(5)A、B、C所代表物质的熔点由高到低的排列顺序为 (填序号)。
专题5 微观结构与物质的多样性 第三单元 第2课时 晶体与非晶体 课时作业
1.我们熟悉的食盐、金属、刨冰、钻石、水晶等都是晶体;而同样透明的玻璃却是非晶体。下列关于晶体和非晶体的本质区别的叙述中,正确的是( )
A.是否具有规则几何外形的固体
B.是否具有固定组成的物质
C.是否具有美观对称的外形
D.内部构成微粒是否在空间呈有规则的重复排列
解析 有规则几何外形或美观对称的固体不一定都是晶体,如玻璃; 具有固定组成的物质也不一定是晶体,如某些无定形体也具有固定的组成。晶体和非晶体的本质区别在于微观结构不同。
答案 D
2.下列晶体中属于原子晶体的是( )
A.氖 B.食盐
C.干冰 D.金刚石
解析 氖、干冰属于分子晶体,食盐属于离子晶体,金刚石属于原子晶体。
答案 D
3.下列物质性质的变化规律与化学键强弱无关的是( )
A.F2、Cl2、Br2、I2的熔沸点逐渐升高
B.HF、HCl、HBr、HI的热稳定性依次减弱
C.金刚石的硬度、熔点、沸点都高于晶体硅
D.NaF、NaCl、NaBr、NaI的熔点依次降低
解析 A项,F2、Cl2、Br2、I2形成的晶体为分子晶体,熔化时仅破坏分子间作用力,与化学键无关;B项,热稳定性是指物质受热分解的难易程度,而HX分解时要破坏H—X键,从HF到HI其键能依次减小,故其稳定性依次减弱;C项,由于金刚石中碳碳键的键能大于晶体硅中硅硅键的键能,因此金刚石的硬度、熔点、沸点较晶体硅高;D项,NaX为离子晶体,熔化时破坏离子键。
答案 A
4.下列说法正确的是( )
A.氯化氢溶于水能电离出H+、Cl-,所以氯化氢是离子化合物
B.碘晶体受热转变成碘蒸气,破坏了共价键
C.CH3CH2OH和CH3OCH3互为同分异构体
D.加热氧化镁使之熔化克服的是共价键
解析 氯化氢是共价化合物,故A项错误;碘晶体受热转变成碘蒸气,破坏了分子间作用力,故B项错误;CH3CH2OH和CH3OCH3的分子式相同,结构不同,互为同分异构体,故C项正确;加热氧化镁使之熔化克服的是离子键,故D项错误。
答案 C
5.下表列出的对晶体的说明中,错误的是( )
选项 A B C D
晶体名称 碘化钾 干冰 石墨 碘
晶体中的粒子 阴、阳离子 分子 原子 分子
粒子间的作用 离子键 分子间作用力 共价键 分子间作用力
解析 干冰和碘都是分子晶体,熔化时克服分子间作用力;石墨是混合型晶体,呈层状结构,层与层之间为分子间作用力,碳原子与碳原子之间形成共价键,熔化时两种作用力都需克服,故C错。
答案 C
6.下列说法一定正确的是( )
A.其水溶液导电的一定是离子晶体
B.熔融态导电的一定是离子晶体
C.共价化合物形成的晶体一定是分子晶体
D.固态不导电、熔融态导电的一定是离子晶体
解析 部分分子晶体和离子晶体的水溶液能导电。固态不导电、熔融态导电是离子晶体区别其他晶体的性质。共价化合物形成的晶体可能是分子晶体,如干冰;也可能是原子晶体,如石英。
答案 D
7.下列说法正确的是( )
A.Na2O2晶体中阴离子与阳离子数目之比为1∶1
B.只有非金属元素之间才能形成共价化合物
C.分子晶体中一定含有共价键
D.在晶体中只要有阴离子就一定有阳离子
解析 A项中Na2O2的电子式为,晶体中阴、阳离子数目之比为1∶2,不是1∶1,A项错误;B项中如BeCl2和AlCl3均为共价化合物,B项错误;C项中稀有气体元素的原子本身已达到稳定结构,当其呈现晶体状态时,没有共价键,只存在分子间作用力,故C项也错误;D项晶体中只要有阴离子存在,那么就一定存在阳离子,故D项正确。
答案 D
8.下列各组物质中,按熔点由低到高的顺序排列正确的是( )
A.Cl2、Br2、I2 B.CO2、SiO2、KCl
C.O2、I2、Hg D.SiC、NaCl、SO2
解析 Cl2、Br2、I2的晶体属于分子晶体,且组成和结构相似,随着相对分子质量的增大,分子间作用力增大,晶体的熔点逐渐升高,A项正确。CO2、KCl、SiO2的晶体分别属于分子晶体、离子晶体、原子晶体,熔点:原子晶体>离子晶体>分子晶体,B项错误。常温、常压下,O2为气态,I2为固态,Hg为液态,C项错误。SiC、NaCl、SO2的晶体分别为原子晶体、离子晶体、分子晶体,它们的熔点逐渐降低,D项错误。
答案 A
9.下表给出几种氯化物的熔、沸点:
NaCl MgCl2 CaCl2 SiCl4
熔点(℃) 801 712 782 -68
沸点(℃) 1 465 1 412 1 600 57.6
则下列各项中与表中数据一致的有( )
①CaCl2属于离子晶体 ②SiCl4是分子晶体 ③1 500 ℃时,NaCl可汽化 ④MgCl2水溶液不能导电
A.仅① B.仅②
C.①②④ D.①②③
解析 熔、沸点的差异说明了晶体中微粒间作用力的不同,即晶体类型不同。判断出晶体类型,然后根据各晶体的性质特点进行判断。
答案 D
10.元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a-b),L层电子数为(a+b),则A、B两元素所形成的化合物的晶体类型为( )
A.原子晶体 B.分子晶体
C.离子晶体 D.金属晶体
解析 元素A和B的原子序数都小于18,B元素原子的M层电子数为(a-b),L层电子数为(a+b),则a+b=8,A元素原子最外层电子数为a,次外层电子数为b,则A元素原子的次外层为K层,即b=2,有2个电子层,所以a=8-2=6,故A为氧元素,B原子的M层电子数为6-2=4,故B为硅元素,A、B两元素所形成的化合物为SiO2,属于原子晶体,故选A。
答案 A
11.在原子序数为1~18的元素中,其单质可以形成原子晶体的元素有 (填元素名称,下同),其单质是金属晶体的元素有 ,
举出三种其单质是分子晶体且在常温下是气体的元素: 。
答案 硼、碳、硅 锂、铍、钠、镁、铝 氧、氮、氟(答案合理即可)
12.现有几组物质的熔点(℃)数据:
A组 B组 C组 D组
金刚石:>3 550 Li:181 HF:-84 NaCl:801
硅晶体:1 410 Na:98 HCl:-114 KCl:776
硼晶体:2 300 K:64 HBr:-87 RbCl:718
二氧化硅:1 723 Rb:39 HI:-51 CsCl:645
据此回答下列问题:
(1)A组属于 晶体,其熔化时克服的微粒间的作用力是 。
(2)B组晶体属于 晶体。
(3)C组晶体属于 晶体,晶体含有的作用力有 。
(4)D组晶体可能具有的性质是 (填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
解析 根据题给各组物质的熔点差异,可判断出A组物质为原子晶体,B组为金属晶体,C组为分子晶体,D组为离子晶体。
答案 (1)原子 共价键 (2)金属 (3)分子 分子间作用力、共价键 (4)②④
13.A、B、C、D都是短周期主族元素,原子半径:D>C>A>B。已知A、B处于同一周期,A、C处于同一主族;C原子核内的质子数等于A、B原子核内的质子数之和;C原子最外层电子数是D原子最外层电子数的4倍。试回答下列问题:
(1)这四种元素分别是A ,B ,C ,D (填元素名称);
(2)B、C、D元素的单质的熔点由高到低的顺序是_______________________(填化学式);
(3)C的单质是 (填“原子”“离子”或“分子”,下同)晶体,B的单质和D的单质在常温下反应得到的生成物属于 晶体。
解析 由A、B、C、D都是短周期主族元素,A、C处于同一主族,且原子半径:C>A,可知C比A的原子序数大8;C原子核内的质子数等于A、B原子核内的质子数之和,则B的原子序数为8,B是氧;C原子最外层电子数是D原子最外层电子数的4倍,C原子最外层电子数不应是8,则D原子最外层电子数为1,结合原子半径的大小关系可知D是钠,C是硅,A是碳。
答案 (1)碳 氧 硅 钠 (2)Si>Na>O2
(3)原子 离子
14.如图是几种晶体的结构示意图,它们是NaCl、干冰、金刚石、石墨结构中的一部分。
(1)其中代表金刚石的是 (填序号),金刚石属于 晶体。
(2)其中代表石墨的是 (填序号),其晶体中碳原子呈平面层状结构排列。
(3)其中代表NaCl的是 (填序号),晶体中Na+与Cl-之间通过 结合。
(4)其中代表干冰的是 (填序号),它属于 晶体,CO2分子间通过 结合。
(5)A、B、C所代表物质的熔点由高到低的排列顺序为 (填序号)。
解析 金刚石是原子晶体,碳原子间以共价键结合,B是金刚石的结构模型。石墨是层状结构,D是石墨的结构模型。氯化钠是Na+和Cl-按个数比1∶1堆积而成的离子晶体,A是氯化钠的结构模型。干冰晶体中,CO2分子间依靠分子间作用力结合,C是干冰的结构模型。一般来说,晶体的熔点:原子晶体>离子晶体>分子晶体。
答案 (1)B 原子 (2)D (3)A 离子键 (4)C 分子 分子间作用力 (5)B>A>C
