2022—2023学年上学期高一化学人教(2019)必修第一册第三章 铁 金属材料检测题(word版含答案)
文档属性
| 名称 | 2022—2023学年上学期高一化学人教(2019)必修第一册第三章 铁 金属材料检测题(word版含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 359.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-24 16:31:09 | ||
图片预览




文档简介
第三章 铁 金属材料检测题含答案2022—2023学年上学期高一化学人教(2019)必修第一册
人教版2019必修第一册第三章 铁 金属材料
一、选择题。(14题)
1、检验储存在密封性不佳的试剂瓶中的硫酸亚铁是否变质,可以加入的试剂是( )
A. 硫氰化钾 B. 硝酸银
C. 盐酸酸化的氯化钡 D. 硝酸酸化的硝酸钡
2、类比是研究物质性质的常用方法之一,可预测许多物质的性质。下列类比推测的说法中正确的是( )
A.已知Fe与O2能直接化合生成Fe3O4,推测Cu与O2可直接化合生成Cu3O4
B.已知Al与NaOH溶液反应产生H2,推测Fe与NaOH溶液反应也生成H2
C.已知Fe能与CuSO4溶液反应,推测Fe与AgNO3溶液也能反应
D.已知Na在常温下能与H2O反应,推测Fe在常温下也能与H2O反应
3、已知下述三个实验均能发生化学反应:
① ② ③
将铁钉放入硫酸铜溶液中 向硫酸亚铁溶液中滴入几滴氯水 将铜丝放入氯化铁溶液中
下列判断正确的是( )
A.实验①中铁钉只做还原剂
B.实验②中Fe2+既显氧化性又显还原性
C.实验③中发生的是置换反应
D.上述实验证明氧化性:Fe3+>Fe2+>Cu2+
4、下列说法正确的是 ( )
A.Al2O3难溶于水、不跟水反应,所以Al2O3不是Al(OH)3对应的氧化物
B.因为Al2O3是金属氧化物,所以它是碱性氧化物
C.Al2O3属于两性氧化物
D.Al2O3能与所有的酸、碱溶液反应
5、铁粉可与高温的水蒸气反应,若反应后得到的干燥固体质量比反应前铁粉的质量增加了32 g,则参加反应的铁粉的物质的量是( )
A.0.5 mol B.1 mol C.1.5 mol D.2 mol
6、设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 14gC2H4含有的单键数目为3NA
B. 99℃时,1LpH=6的纯水中,含有的OH-数目为1×10-8NA
C. 足量的Na与1molO2充分反应,转移的电子数目一定为2NA
D. 8.0gCu2S和CuO的混合物中含有的铜原子数为0.1NA
7、下列相关实验的说法正确的是( )
A. 称取4.0g固体NaOH,于250mL容量瓶中溶解定容,可制得0.4000mol/L的NaOH溶液
B. 向废铁屑溶于浓盐酸所得溶液中加入酸性KMnO4溶液,紫色褪去说明溶液中含有Fe2+
C. 将铂丝用硫酸洗净后,在外焰上灼烧至火焰颜色与酒精灯火焰一致,再蘸取碳酸钾灼烧,直接可观察到火焰呈紫色
D. 向NaAlO2中滴入NaHCO3溶液可析出氢氧化铝沉淀,说明AlO2-结合质子的能力比CO32-强
8、下列关于铁的说法错误的是( )
A.铁的发现比铜要晚 B.铁是人类应用最广泛的金属
C.铁是地壳中含量最多的金属 D.铁元素是人体不可缺少的重要元素
9、为了检验某FeCl2溶液是否变质,可向溶液中加入( )
A. KSCN溶液 B. 铁片 C. HCl溶液 D. 石蕊溶液
10、设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 2.8g14N2与14C16O的混合物中,中子数目为 1.4NA
B. 含 0. 1 molFeCl3的溶液与0. 1mol 锌充分反应,转移电子数为0.1NA
C. 标准状况下,5.6gC4H8中 C-C 的数目可能为0.4NA
D. 某温度下,1LpH=9 的 Na2CO3 溶液中,水电离产生的OH-数目为10-5 NA
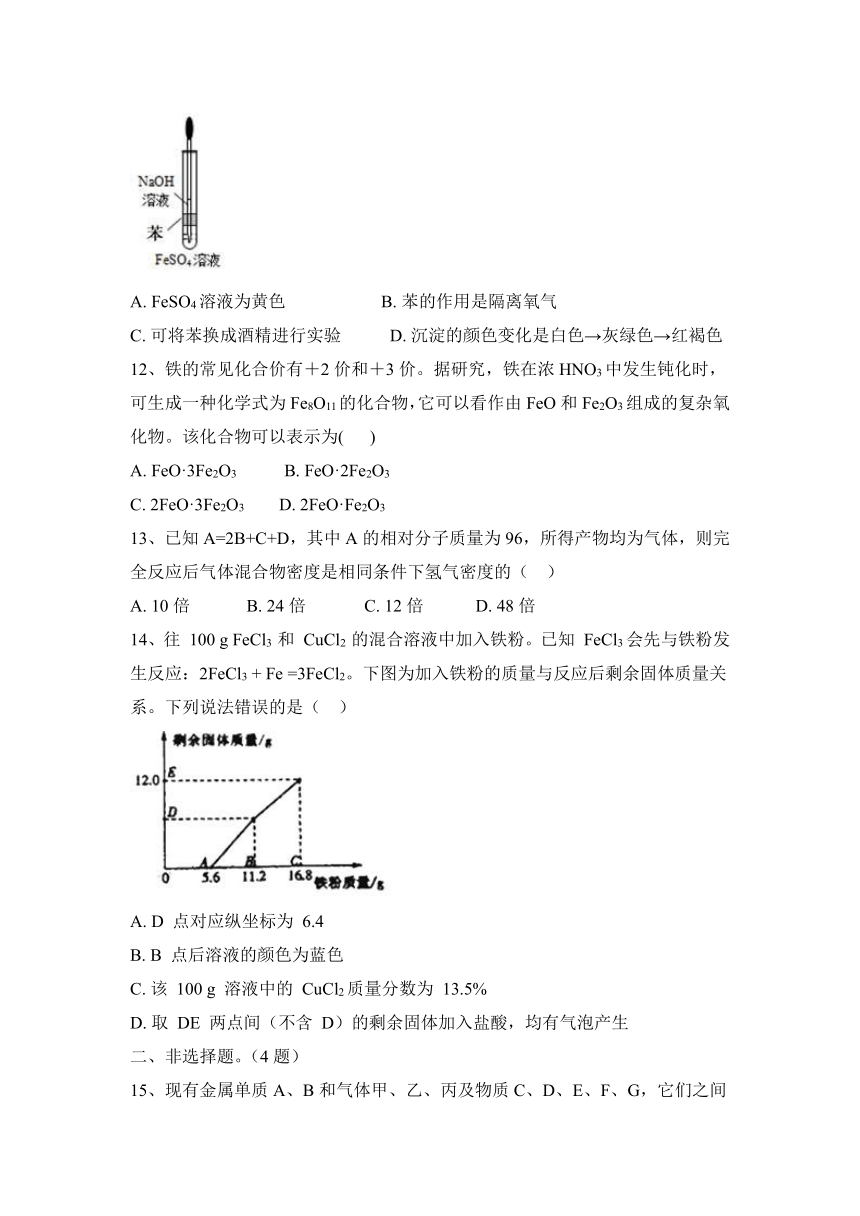
11、实验室用如图所示装置制取Fe(OH)2,下列说法正确的是( )
A. FeSO4溶液为黄色 B. 苯的作用是隔离氧气
C. 可将苯换成酒精进行实验 D. 沉淀的颜色变化是白色→灰绿色→红褐色
12、铁的常见化合价有+2价和+3价。据研究,铁在浓HNO3中发生钝化时,可生成一种化学式为Fe8O11的化合物,它可以看作由FeO和Fe2O3组成的复杂氧化物。该化合物可以表示为( )
A. FeO·3Fe2O3 B. FeO·2Fe2O3
C. 2FeO·3Fe2O3 D. 2FeO·Fe2O3
13、已知A=2B+C+D,其中A的相对分子质量为96,所得产物均为气体,则完全反应后气体混合物密度是相同条件下氢气密度的( )
A. 10倍 B. 24倍 C. 12倍 D. 48倍
14、往 100 g FeCl3 和 CuCl2 的混合溶液中加入铁粉。已知 FeCl3会先与铁粉发生反应:2FeCl3 + Fe =3FeCl2。下图为加入铁粉的质量与反应后剩余固体质量关系。下列说法错误的是( )
A. D 点对应纵坐标为 6.4
B. B 点后溶液的颜色为蓝色
C. 该 100 g 溶液中的 CuCl2质量分数为 13.5%
D. 取 DE 两点间(不含 D)的剩余固体加入盐酸,均有气泡产生
二、非选择题。(4题)
15、现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如图反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙 , F 。
(2)写出下列反应的离子方程式:
①金属A和水反应 。②红褐色沉淀C与物质E反应 。
③F与黄绿色气体乙反应 。
④实验室常用氢氧化钠吸收实验过程中的黄绿色气体乙,写出用氢氧化钠溶液吸收该气体的离子方程式 。
(3)将G溶液逐滴加入到沸水中会产生一种红褐色的液体。你认为该液体中的分散质粒子直径在 之间,验证的简单方法是: 。
16、请按要求完成下列填空:
(1)质量之比为16∶7∶6的SO2、CO、NO分子个数之比为________。
(2)1.204×1024个D2O的质量为________。
(3)9.2g NOx中含有N原子数为0.2mol,则x数值为________。
(4)1L1mol/L的AlCl3溶液中和1.5L________mol/L的MgCl2溶液中的氯离子浓度相等。
(5)在标准状况下,CO和CO2的混合气体共39.2 L,质量为61 g,则两种气体的物质的量之和为________mol,其中CO2为________mol。
(6)现有100mL 2mol/L的稀HCl溶液与足量的铁屑反应,将生成的FeCl2配成400mL溶液,此溶液中FeCl2的物质的量浓度是________。
(7)在标准状况下,将224L氯化氢气体溶于635mL的水(密度为1g/cm3)中,所得盐酸的密度为1.18g/cm3 , 该盐酸中溶质的质量分数________,该盐酸的物质的量浓度________。
17、如下图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化。实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选。填写下列空白。
(1)B中盛一定量的NaOH溶液,A中应预先加入的试剂是________,A中反应的离子方程式是:________。
(2)实验开始时就先将活塞E________(填“打开”或“关闭”),C中收集到气体的主要成分是________。
(3)简述生成Fe(OH)2的操作过程________。
(4)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:________。
18、固体化合物X由3种元素组成。某学习小组进行了如下实验:
请回答:
(1)由现象1得出化合物X含有 (填元素符号)元素。
(2)固体混合物Y的成分是 (填化学式)。
(3)X的化学式是 。
X与浓盐酸反应产生黄绿色气体,固体完全溶解,得到蓝色溶液,该反应的化学方程式是 。
第三章 铁 金属材料检测题含答案2022—2023学年上学期高一化学人教(2019)必修第一册
人教版2019必修第一册第三章 铁 金属材料
一、选择题。(14题)
1、检验储存在密封性不佳的试剂瓶中的硫酸亚铁是否变质,可以加入的试剂是( )
A. 硫氰化钾 B. 硝酸银
C. 盐酸酸化的氯化钡 D. 硝酸酸化的硝酸钡
【答案】A
2、类比是研究物质性质的常用方法之一,可预测许多物质的性质。下列类比推测的说法中正确的是( )
A.已知Fe与O2能直接化合生成Fe3O4,推测Cu与O2可直接化合生成Cu3O4
B.已知Al与NaOH溶液反应产生H2,推测Fe与NaOH溶液反应也生成H2
C.已知Fe能与CuSO4溶液反应,推测Fe与AgNO3溶液也能反应
D.已知Na在常温下能与H2O反应,推测Fe在常温下也能与H2O反应
【答案】C
3、已知下述三个实验均能发生化学反应:
① ② ③
将铁钉放入硫酸铜溶液中 向硫酸亚铁溶液中滴入几滴氯水 将铜丝放入氯化铁溶液中
下列判断正确的是( )
A.实验①中铁钉只做还原剂
B.实验②中Fe2+既显氧化性又显还原性
C.实验③中发生的是置换反应
D.上述实验证明氧化性:Fe3+>Fe2+>Cu2+
【答案】A
4、下列说法正确的是 ( )
A.Al2O3难溶于水、不跟水反应,所以Al2O3不是Al(OH)3对应的氧化物
B.因为Al2O3是金属氧化物,所以它是碱性氧化物
C.Al2O3属于两性氧化物
D.Al2O3能与所有的酸、碱溶液反应
【答案】C
5、铁粉可与高温的水蒸气反应,若反应后得到的干燥固体质量比反应前铁粉的质量增加了32 g,则参加反应的铁粉的物质的量是( )
A.0.5 mol B.1 mol C.1.5 mol D.2 mol
【答案】C
6、设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 14gC2H4含有的单键数目为3NA
B. 99℃时,1LpH=6的纯水中,含有的OH-数目为1×10-8NA
C. 足量的Na与1molO2充分反应,转移的电子数目一定为2NA
D. 8.0gCu2S和CuO的混合物中含有的铜原子数为0.1NA
【答案】D
7、下列相关实验的说法正确的是( )
A. 称取4.0g固体NaOH,于250mL容量瓶中溶解定容,可制得0.4000mol/L的NaOH溶液
B. 向废铁屑溶于浓盐酸所得溶液中加入酸性KMnO4溶液,紫色褪去说明溶液中含有Fe2+
C. 将铂丝用硫酸洗净后,在外焰上灼烧至火焰颜色与酒精灯火焰一致,再蘸取碳酸钾灼烧,直接可观察到火焰呈紫色
D. 向NaAlO2中滴入NaHCO3溶液可析出氢氧化铝沉淀,说明AlO2-结合质子的能力比CO32-强
【答案】D
8、下列关于铁的说法错误的是( )
A.铁的发现比铜要晚 B.铁是人类应用最广泛的金属
C.铁是地壳中含量最多的金属 D.铁元素是人体不可缺少的重要元素
【答案】C
9、为了检验某FeCl2溶液是否变质,可向溶液中加入( )
A. KSCN溶液 B. 铁片 C. HCl溶液 D. 石蕊溶液
【答案】A
10、设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 2.8g14N2与14C16O的混合物中,中子数目为 1.4NA
B. 含 0. 1 molFeCl3的溶液与0. 1mol 锌充分反应,转移电子数为0.1NA
C. 标准状况下,5.6gC4H8中 C-C 的数目可能为0.4NA
D. 某温度下,1LpH=9 的 Na2CO3 溶液中,水电离产生的OH-数目为10-5 NA
【答案】C
11、实验室用如图所示装置制取Fe(OH)2,下列说法正确的是( )
A. FeSO4溶液为黄色 B. 苯的作用是隔离氧气
C. 可将苯换成酒精进行实验 D. 沉淀的颜色变化是白色→灰绿色→红褐色
【答案】B
12、铁的常见化合价有+2价和+3价。据研究,铁在浓HNO3中发生钝化时,可生成一种化学式为Fe8O11的化合物,它可以看作由FeO和Fe2O3组成的复杂氧化物。该化合物可以表示为( )
A. FeO·3Fe2O3 B. FeO·2Fe2O3
C. 2FeO·3Fe2O3 D. 2FeO·Fe2O3
【答案】C
13、已知A=2B+C+D,其中A的相对分子质量为96,所得产物均为气体,则完全反应后气体混合物密度是相同条件下氢气密度的( )
A. 10倍 B. 24倍 C. 12倍 D. 48倍
【答案】C
14、往 100 g FeCl3 和 CuCl2 的混合溶液中加入铁粉。已知 FeCl3会先与铁粉发生反应:2FeCl3 + Fe =3FeCl2。下图为加入铁粉的质量与反应后剩余固体质量关系。下列说法错误的是( )
A. D 点对应纵坐标为 6.4
B. B 点后溶液的颜色为蓝色
C. 该 100 g 溶液中的 CuCl2质量分数为 13.5%
D. 取 DE 两点间(不含 D)的剩余固体加入盐酸,均有气泡产生
【答案】B
二、非选择题。(4题)
15、现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如图反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙 , F 。
(2)写出下列反应的离子方程式:
①金属A和水反应 。②红褐色沉淀C与物质E反应 。
③F与黄绿色气体乙反应 。
④实验室常用氢氧化钠吸收实验过程中的黄绿色气体乙,写出用氢氧化钠溶液吸收该气体的离子方程式 。
(3)将G溶液逐滴加入到沸水中会产生一种红褐色的液体。你认为该液体中的分散质粒子直径在 之间,验证的简单方法是: 。
【答案】 (1)Cl2;FeCl2
(2)2Na+2H2O=2Na++2OH﹣+H2↑;Fe(OH)3+3H+=Fe3++3H2O;2Fe2++Cl2=2Fe3++2Cl﹣;Cl2+2OH﹣=Cl﹣+ClO﹣+H2O
(3)1~100nm;是否有丁达尔现象
16、请按要求完成下列填空:
(1)质量之比为16∶7∶6的SO2、CO、NO分子个数之比为________。
(2)1.204×1024个D2O的质量为________。
(3)9.2g NOx中含有N原子数为0.2mol,则x数值为________。
(4)1L1mol/L的AlCl3溶液中和1.5L________mol/L的MgCl2溶液中的氯离子浓度相等。
(5)在标准状况下,CO和CO2的混合气体共39.2 L,质量为61 g,则两种气体的物质的量之和为________mol,其中CO2为________mol。
(6)现有100mL 2mol/L的稀HCl溶液与足量的铁屑反应,将生成的FeCl2配成400mL溶液,此溶液中FeCl2的物质的量浓度是________。
(7)在标准状况下,将224L氯化氢气体溶于635mL的水(密度为1g/cm3)中,所得盐酸的密度为1.18g/cm3 , 该盐酸中溶质的质量分数________,该盐酸的物质的量浓度________。
【答案】 (1)5∶5∶4 (2)40g (3)2
(4)1.5mol/L (5)1.75;0.75 (6)0.25mol/L
(7)36.5%;11.8mol/L
17、如下图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化。实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选。填写下列空白。
(1)B中盛一定量的NaOH溶液,A中应预先加入的试剂是________,A中反应的离子方程式是:________。
(2)实验开始时就先将活塞E________(填“打开”或“关闭”),C中收集到气体的主要成分是________。
(3)简述生成Fe(OH)2的操作过程________。
(4)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:________。
【答案】 (1)铁屑;Fe+2H+=Fe2++H2↑
(2)打开;H2
(3)关闭活塞E,使FeSO4溶液压入B瓶中进行反应
(4)4Fe(OH)2+O2+2H2O=4Fe(OH)3
18、固体化合物X由3种元素组成。某学习小组进行了如下实验:
请回答:
(1)由现象1得出化合物X含有 (填元素符号)元素。
(2)固体混合物Y的成分是 (填化学式)。
(3)X的化学式是 。
X与浓盐酸反应产生黄绿色气体,固体完全溶解,得到蓝色溶液,该反应的化学方程式是 。
【答案】(1)O (2)Cu和NaOH
(3)NaCuO2 2NaCuO2+8HCl2NaCl+2CuCl2+Cl2↑+4H2O
人教版2019必修第一册第三章 铁 金属材料
一、选择题。(14题)
1、检验储存在密封性不佳的试剂瓶中的硫酸亚铁是否变质,可以加入的试剂是( )
A. 硫氰化钾 B. 硝酸银
C. 盐酸酸化的氯化钡 D. 硝酸酸化的硝酸钡
2、类比是研究物质性质的常用方法之一,可预测许多物质的性质。下列类比推测的说法中正确的是( )
A.已知Fe与O2能直接化合生成Fe3O4,推测Cu与O2可直接化合生成Cu3O4
B.已知Al与NaOH溶液反应产生H2,推测Fe与NaOH溶液反应也生成H2
C.已知Fe能与CuSO4溶液反应,推测Fe与AgNO3溶液也能反应
D.已知Na在常温下能与H2O反应,推测Fe在常温下也能与H2O反应
3、已知下述三个实验均能发生化学反应:
① ② ③
将铁钉放入硫酸铜溶液中 向硫酸亚铁溶液中滴入几滴氯水 将铜丝放入氯化铁溶液中
下列判断正确的是( )
A.实验①中铁钉只做还原剂
B.实验②中Fe2+既显氧化性又显还原性
C.实验③中发生的是置换反应
D.上述实验证明氧化性:Fe3+>Fe2+>Cu2+
4、下列说法正确的是 ( )
A.Al2O3难溶于水、不跟水反应,所以Al2O3不是Al(OH)3对应的氧化物
B.因为Al2O3是金属氧化物,所以它是碱性氧化物
C.Al2O3属于两性氧化物
D.Al2O3能与所有的酸、碱溶液反应
5、铁粉可与高温的水蒸气反应,若反应后得到的干燥固体质量比反应前铁粉的质量增加了32 g,则参加反应的铁粉的物质的量是( )
A.0.5 mol B.1 mol C.1.5 mol D.2 mol
6、设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 14gC2H4含有的单键数目为3NA
B. 99℃时,1LpH=6的纯水中,含有的OH-数目为1×10-8NA
C. 足量的Na与1molO2充分反应,转移的电子数目一定为2NA
D. 8.0gCu2S和CuO的混合物中含有的铜原子数为0.1NA
7、下列相关实验的说法正确的是( )
A. 称取4.0g固体NaOH,于250mL容量瓶中溶解定容,可制得0.4000mol/L的NaOH溶液
B. 向废铁屑溶于浓盐酸所得溶液中加入酸性KMnO4溶液,紫色褪去说明溶液中含有Fe2+
C. 将铂丝用硫酸洗净后,在外焰上灼烧至火焰颜色与酒精灯火焰一致,再蘸取碳酸钾灼烧,直接可观察到火焰呈紫色
D. 向NaAlO2中滴入NaHCO3溶液可析出氢氧化铝沉淀,说明AlO2-结合质子的能力比CO32-强
8、下列关于铁的说法错误的是( )
A.铁的发现比铜要晚 B.铁是人类应用最广泛的金属
C.铁是地壳中含量最多的金属 D.铁元素是人体不可缺少的重要元素
9、为了检验某FeCl2溶液是否变质,可向溶液中加入( )
A. KSCN溶液 B. 铁片 C. HCl溶液 D. 石蕊溶液
10、设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 2.8g14N2与14C16O的混合物中,中子数目为 1.4NA
B. 含 0. 1 molFeCl3的溶液与0. 1mol 锌充分反应,转移电子数为0.1NA
C. 标准状况下,5.6gC4H8中 C-C 的数目可能为0.4NA
D. 某温度下,1LpH=9 的 Na2CO3 溶液中,水电离产生的OH-数目为10-5 NA
11、实验室用如图所示装置制取Fe(OH)2,下列说法正确的是( )
A. FeSO4溶液为黄色 B. 苯的作用是隔离氧气
C. 可将苯换成酒精进行实验 D. 沉淀的颜色变化是白色→灰绿色→红褐色
12、铁的常见化合价有+2价和+3价。据研究,铁在浓HNO3中发生钝化时,可生成一种化学式为Fe8O11的化合物,它可以看作由FeO和Fe2O3组成的复杂氧化物。该化合物可以表示为( )
A. FeO·3Fe2O3 B. FeO·2Fe2O3
C. 2FeO·3Fe2O3 D. 2FeO·Fe2O3
13、已知A=2B+C+D,其中A的相对分子质量为96,所得产物均为气体,则完全反应后气体混合物密度是相同条件下氢气密度的( )
A. 10倍 B. 24倍 C. 12倍 D. 48倍
14、往 100 g FeCl3 和 CuCl2 的混合溶液中加入铁粉。已知 FeCl3会先与铁粉发生反应:2FeCl3 + Fe =3FeCl2。下图为加入铁粉的质量与反应后剩余固体质量关系。下列说法错误的是( )
A. D 点对应纵坐标为 6.4
B. B 点后溶液的颜色为蓝色
C. 该 100 g 溶液中的 CuCl2质量分数为 13.5%
D. 取 DE 两点间(不含 D)的剩余固体加入盐酸,均有气泡产生
二、非选择题。(4题)
15、现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如图反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙 , F 。
(2)写出下列反应的离子方程式:
①金属A和水反应 。②红褐色沉淀C与物质E反应 。
③F与黄绿色气体乙反应 。
④实验室常用氢氧化钠吸收实验过程中的黄绿色气体乙,写出用氢氧化钠溶液吸收该气体的离子方程式 。
(3)将G溶液逐滴加入到沸水中会产生一种红褐色的液体。你认为该液体中的分散质粒子直径在 之间,验证的简单方法是: 。
16、请按要求完成下列填空:
(1)质量之比为16∶7∶6的SO2、CO、NO分子个数之比为________。
(2)1.204×1024个D2O的质量为________。
(3)9.2g NOx中含有N原子数为0.2mol,则x数值为________。
(4)1L1mol/L的AlCl3溶液中和1.5L________mol/L的MgCl2溶液中的氯离子浓度相等。
(5)在标准状况下,CO和CO2的混合气体共39.2 L,质量为61 g,则两种气体的物质的量之和为________mol,其中CO2为________mol。
(6)现有100mL 2mol/L的稀HCl溶液与足量的铁屑反应,将生成的FeCl2配成400mL溶液,此溶液中FeCl2的物质的量浓度是________。
(7)在标准状况下,将224L氯化氢气体溶于635mL的水(密度为1g/cm3)中,所得盐酸的密度为1.18g/cm3 , 该盐酸中溶质的质量分数________,该盐酸的物质的量浓度________。
17、如下图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化。实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选。填写下列空白。
(1)B中盛一定量的NaOH溶液,A中应预先加入的试剂是________,A中反应的离子方程式是:________。
(2)实验开始时就先将活塞E________(填“打开”或“关闭”),C中收集到气体的主要成分是________。
(3)简述生成Fe(OH)2的操作过程________。
(4)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:________。
18、固体化合物X由3种元素组成。某学习小组进行了如下实验:
请回答:
(1)由现象1得出化合物X含有 (填元素符号)元素。
(2)固体混合物Y的成分是 (填化学式)。
(3)X的化学式是 。
X与浓盐酸反应产生黄绿色气体,固体完全溶解,得到蓝色溶液,该反应的化学方程式是 。
第三章 铁 金属材料检测题含答案2022—2023学年上学期高一化学人教(2019)必修第一册
人教版2019必修第一册第三章 铁 金属材料
一、选择题。(14题)
1、检验储存在密封性不佳的试剂瓶中的硫酸亚铁是否变质,可以加入的试剂是( )
A. 硫氰化钾 B. 硝酸银
C. 盐酸酸化的氯化钡 D. 硝酸酸化的硝酸钡
【答案】A
2、类比是研究物质性质的常用方法之一,可预测许多物质的性质。下列类比推测的说法中正确的是( )
A.已知Fe与O2能直接化合生成Fe3O4,推测Cu与O2可直接化合生成Cu3O4
B.已知Al与NaOH溶液反应产生H2,推测Fe与NaOH溶液反应也生成H2
C.已知Fe能与CuSO4溶液反应,推测Fe与AgNO3溶液也能反应
D.已知Na在常温下能与H2O反应,推测Fe在常温下也能与H2O反应
【答案】C
3、已知下述三个实验均能发生化学反应:
① ② ③
将铁钉放入硫酸铜溶液中 向硫酸亚铁溶液中滴入几滴氯水 将铜丝放入氯化铁溶液中
下列判断正确的是( )
A.实验①中铁钉只做还原剂
B.实验②中Fe2+既显氧化性又显还原性
C.实验③中发生的是置换反应
D.上述实验证明氧化性:Fe3+>Fe2+>Cu2+
【答案】A
4、下列说法正确的是 ( )
A.Al2O3难溶于水、不跟水反应,所以Al2O3不是Al(OH)3对应的氧化物
B.因为Al2O3是金属氧化物,所以它是碱性氧化物
C.Al2O3属于两性氧化物
D.Al2O3能与所有的酸、碱溶液反应
【答案】C
5、铁粉可与高温的水蒸气反应,若反应后得到的干燥固体质量比反应前铁粉的质量增加了32 g,则参加反应的铁粉的物质的量是( )
A.0.5 mol B.1 mol C.1.5 mol D.2 mol
【答案】C
6、设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 14gC2H4含有的单键数目为3NA
B. 99℃时,1LpH=6的纯水中,含有的OH-数目为1×10-8NA
C. 足量的Na与1molO2充分反应,转移的电子数目一定为2NA
D. 8.0gCu2S和CuO的混合物中含有的铜原子数为0.1NA
【答案】D
7、下列相关实验的说法正确的是( )
A. 称取4.0g固体NaOH,于250mL容量瓶中溶解定容,可制得0.4000mol/L的NaOH溶液
B. 向废铁屑溶于浓盐酸所得溶液中加入酸性KMnO4溶液,紫色褪去说明溶液中含有Fe2+
C. 将铂丝用硫酸洗净后,在外焰上灼烧至火焰颜色与酒精灯火焰一致,再蘸取碳酸钾灼烧,直接可观察到火焰呈紫色
D. 向NaAlO2中滴入NaHCO3溶液可析出氢氧化铝沉淀,说明AlO2-结合质子的能力比CO32-强
【答案】D
8、下列关于铁的说法错误的是( )
A.铁的发现比铜要晚 B.铁是人类应用最广泛的金属
C.铁是地壳中含量最多的金属 D.铁元素是人体不可缺少的重要元素
【答案】C
9、为了检验某FeCl2溶液是否变质,可向溶液中加入( )
A. KSCN溶液 B. 铁片 C. HCl溶液 D. 石蕊溶液
【答案】A
10、设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 2.8g14N2与14C16O的混合物中,中子数目为 1.4NA
B. 含 0. 1 molFeCl3的溶液与0. 1mol 锌充分反应,转移电子数为0.1NA
C. 标准状况下,5.6gC4H8中 C-C 的数目可能为0.4NA
D. 某温度下,1LpH=9 的 Na2CO3 溶液中,水电离产生的OH-数目为10-5 NA
【答案】C
11、实验室用如图所示装置制取Fe(OH)2,下列说法正确的是( )
A. FeSO4溶液为黄色 B. 苯的作用是隔离氧气
C. 可将苯换成酒精进行实验 D. 沉淀的颜色变化是白色→灰绿色→红褐色
【答案】B
12、铁的常见化合价有+2价和+3价。据研究,铁在浓HNO3中发生钝化时,可生成一种化学式为Fe8O11的化合物,它可以看作由FeO和Fe2O3组成的复杂氧化物。该化合物可以表示为( )
A. FeO·3Fe2O3 B. FeO·2Fe2O3
C. 2FeO·3Fe2O3 D. 2FeO·Fe2O3
【答案】C
13、已知A=2B+C+D,其中A的相对分子质量为96,所得产物均为气体,则完全反应后气体混合物密度是相同条件下氢气密度的( )
A. 10倍 B. 24倍 C. 12倍 D. 48倍
【答案】C
14、往 100 g FeCl3 和 CuCl2 的混合溶液中加入铁粉。已知 FeCl3会先与铁粉发生反应:2FeCl3 + Fe =3FeCl2。下图为加入铁粉的质量与反应后剩余固体质量关系。下列说法错误的是( )
A. D 点对应纵坐标为 6.4
B. B 点后溶液的颜色为蓝色
C. 该 100 g 溶液中的 CuCl2质量分数为 13.5%
D. 取 DE 两点间(不含 D)的剩余固体加入盐酸,均有气泡产生
【答案】B
二、非选择题。(4题)
15、现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如图反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙 , F 。
(2)写出下列反应的离子方程式:
①金属A和水反应 。②红褐色沉淀C与物质E反应 。
③F与黄绿色气体乙反应 。
④实验室常用氢氧化钠吸收实验过程中的黄绿色气体乙,写出用氢氧化钠溶液吸收该气体的离子方程式 。
(3)将G溶液逐滴加入到沸水中会产生一种红褐色的液体。你认为该液体中的分散质粒子直径在 之间,验证的简单方法是: 。
【答案】 (1)Cl2;FeCl2
(2)2Na+2H2O=2Na++2OH﹣+H2↑;Fe(OH)3+3H+=Fe3++3H2O;2Fe2++Cl2=2Fe3++2Cl﹣;Cl2+2OH﹣=Cl﹣+ClO﹣+H2O
(3)1~100nm;是否有丁达尔现象
16、请按要求完成下列填空:
(1)质量之比为16∶7∶6的SO2、CO、NO分子个数之比为________。
(2)1.204×1024个D2O的质量为________。
(3)9.2g NOx中含有N原子数为0.2mol,则x数值为________。
(4)1L1mol/L的AlCl3溶液中和1.5L________mol/L的MgCl2溶液中的氯离子浓度相等。
(5)在标准状况下,CO和CO2的混合气体共39.2 L,质量为61 g,则两种气体的物质的量之和为________mol,其中CO2为________mol。
(6)现有100mL 2mol/L的稀HCl溶液与足量的铁屑反应,将生成的FeCl2配成400mL溶液,此溶液中FeCl2的物质的量浓度是________。
(7)在标准状况下,将224L氯化氢气体溶于635mL的水(密度为1g/cm3)中,所得盐酸的密度为1.18g/cm3 , 该盐酸中溶质的质量分数________,该盐酸的物质的量浓度________。
【答案】 (1)5∶5∶4 (2)40g (3)2
(4)1.5mol/L (5)1.75;0.75 (6)0.25mol/L
(7)36.5%;11.8mol/L
17、如下图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化。实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选。填写下列空白。
(1)B中盛一定量的NaOH溶液,A中应预先加入的试剂是________,A中反应的离子方程式是:________。
(2)实验开始时就先将活塞E________(填“打开”或“关闭”),C中收集到气体的主要成分是________。
(3)简述生成Fe(OH)2的操作过程________。
(4)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:________。
【答案】 (1)铁屑;Fe+2H+=Fe2++H2↑
(2)打开;H2
(3)关闭活塞E,使FeSO4溶液压入B瓶中进行反应
(4)4Fe(OH)2+O2+2H2O=4Fe(OH)3
18、固体化合物X由3种元素组成。某学习小组进行了如下实验:
请回答:
(1)由现象1得出化合物X含有 (填元素符号)元素。
(2)固体混合物Y的成分是 (填化学式)。
(3)X的化学式是 。
X与浓盐酸反应产生黄绿色气体,固体完全溶解,得到蓝色溶液,该反应的化学方程式是 。
【答案】(1)O (2)Cu和NaOH
(3)NaCuO2 2NaCuO2+8HCl2NaCl+2CuCl2+Cl2↑+4H2O
