2022—2023学年上学期高一化学人教(2019)必修第一册第四章 物质结构 元素周期律检测题(word版含答案)
文档属性
| 名称 | 2022—2023学年上学期高一化学人教(2019)必修第一册第四章 物质结构 元素周期律检测题(word版含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 472.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-24 16:32:19 | ||
图片预览




文档简介
第四章 物质结构 元素周期律检测题含答案2022—2023学年上学期高一化学人教(2019)必修第一册
人教版2019必修第一册第四章 物质结构 元素周期律
一、选择题。(15题)
1、与Na+具有相同电子总数和质子总数的微粒是 ( )
A.CH4 B.H3O+ C.N D.Cl-
2、有X和X+两种粒子,下列叙述正确的是( )
A.一定都是由质子、中子、电子构成的
B.化学性质几乎完全相同
C.质子数一定相等,质量数和中子数一定不相等
D.核电荷数和核外电子数一定相等
3、下列关于元素金属性、非金属性强弱判断不正确的是( )
A.高温下2C+SiO22CO↑+Si,说明非金属性:C>Si
B.碱性:KOH>Mg(OH)2,说明金属性:K>Mg
C.氟气与氢气在暗处相遇就会爆炸,氯气与氢气混合在光照或点燃时发生爆炸,说明非金属性:F>Cl
D.氧化性:Cu2+>Na+,说明金属性:Na>Cu
4、NA是阿伏加德罗常数的值。下列说法正确的是( )
A.12g14C中含有的质子数为6NA
B.23gNa在空气中点燃后充分反应,转移的电子数为NA
C.0.1molCu与浓硝酸充分反应最终得到NO2分子的数目为0.2NA
D.100g质量分数为30%的甲醛(HCHO)水溶液中氧原子的数目为NA
5、第 3 周期元素 R,它的最外层达到饱和时,所需电子数小于次外层和最内层电子数之差,并且等于最内层电子数的正整数倍,则关于 R 的正确说法是( )
①常温下能稳定存在的 R 的氧化物都是酸酐
②R 的气态氢化物受热都能分解
③R 元素都能以游离态存在于自然界中
④R 的最高价氧化物对应水化物都是强酸
⑤R 的氢化物在空气中都能燃烧生成+4 价 R 的氧化物
A.①③⑤ B.①②④ C.①②⑤ D.③④⑤
6、根据元素周期律,由下列事实进行归纳推测,推测不合理的是( )
选项 事实 推测
A CaCO3和BaCO3都难溶于水 SrCO3也难溶于水
B Si是半导体材料,同族的Ge也是半导体材料 第ⅣA族的元素的单质都可作半导体材料
C HCl在1 500 ℃时分解,HI在230 ℃时分解 HBr的分解温度介于二者之间
D Si与H2高温时反应,S与H2加热能反应 P与H2在高温时能反应
7、运用同主族性质递变规律分析下列推断正确的是( )
A.在氧气中,铷()的燃烧产物比钠的燃烧产物更复杂
B.砹化氢比溴化氢稳定
C.硫酸锶难溶于水,但易溶于盐酸
D.碲化氢是比硫化氢稳定的气体
8、以下关于分子间作用力的叙述不正确的是( )
A.是一种较弱的化学键
B.分子间作用力较弱,破坏它所需能量较少
C.分子间作用力对物质的熔点、沸点有影响
D.稀有气体原子间存在分子间作用力
9、氢化钠(NaH)是一种白色的离子化合物,其中钠元素显+1价;氢化钠与水反应生成H2和NaOH。下列叙述中,不正确的是( )
A.NaH的电子式为Na+[H]-
B.NaH中氢元素的离子的电子层排布与氦原子的电子层排布相同
C.微粒半径H-<Li+
D.NaH与H2O反应时,H2O做氧化剂
10、在4份碘化钾淀粉溶液中,分别加入下列物质,不能使溶液变蓝的是( )
A. 氯化氯 B. 溴水 C. 氯气 D. 碘的酒精溶液
11、短周期元素W、X、Y、Z的原子序数依次增大,由以上四种元素组成的化合物A在一定条件下完全分解,生成甲、乙、丙、丁四种气体,甲、乙分别能使无水硫酸铜、湿润的红色石蕊试纸变蓝,丙是导致酸雨的主要污染物,丁能参与大气循环。下列说法正确的是( )
A.原子半径:WB.简单氢化物的稳定性:X>Y>Z
C.W分别与X、Z形成的简单化合物之间能反应生成离子化合物
D.在化合物A的分解反应中丙为氧化产物,丁为还原产物
12、已知镓(Ga)有两种天然同位素,一种是Ga,其原子在天然同位素原子中所占的百分比为60%。实验测得溴化镓(GaBr3)的摩尔质量为309.8g/mol,则此推知镓的另一种同位素是( )
A.Ga B.Ga C.Ga D.Ga
13、部分短周期元素的原子半径及主要化合价如下表:
元素
原子半径/ 0.160 0.111 0.106 0.066
主要化合价 +2 +1 +2 +6、-2 -2
下列叙述正确的是( )
A.一定是金属元素
B.原子半径大小:
C.的简单氢化物的沸点比的大
D.、可能形成阴、阳离子个数比为的两种化合物
14、下列各组中每种物质都既有离子键又有共价键的一组是( )
A.NaOH H2SO4 (NH4)2SO4 B.MgO Na2SO4 HNO3
C.Na2O2 KOH Na3PO4 D.HCl Al2O3 MgCl2
15、向含有NaBr、NaI的溶液中通入过量的Cl2 , 然后将溶液蒸干,并灼烧固体,最后得到的物质是( )
A. NaCl B. NaCl和NaBr C. NaCl和NaI D. NaCl和I2
二、非选择题。(4题)
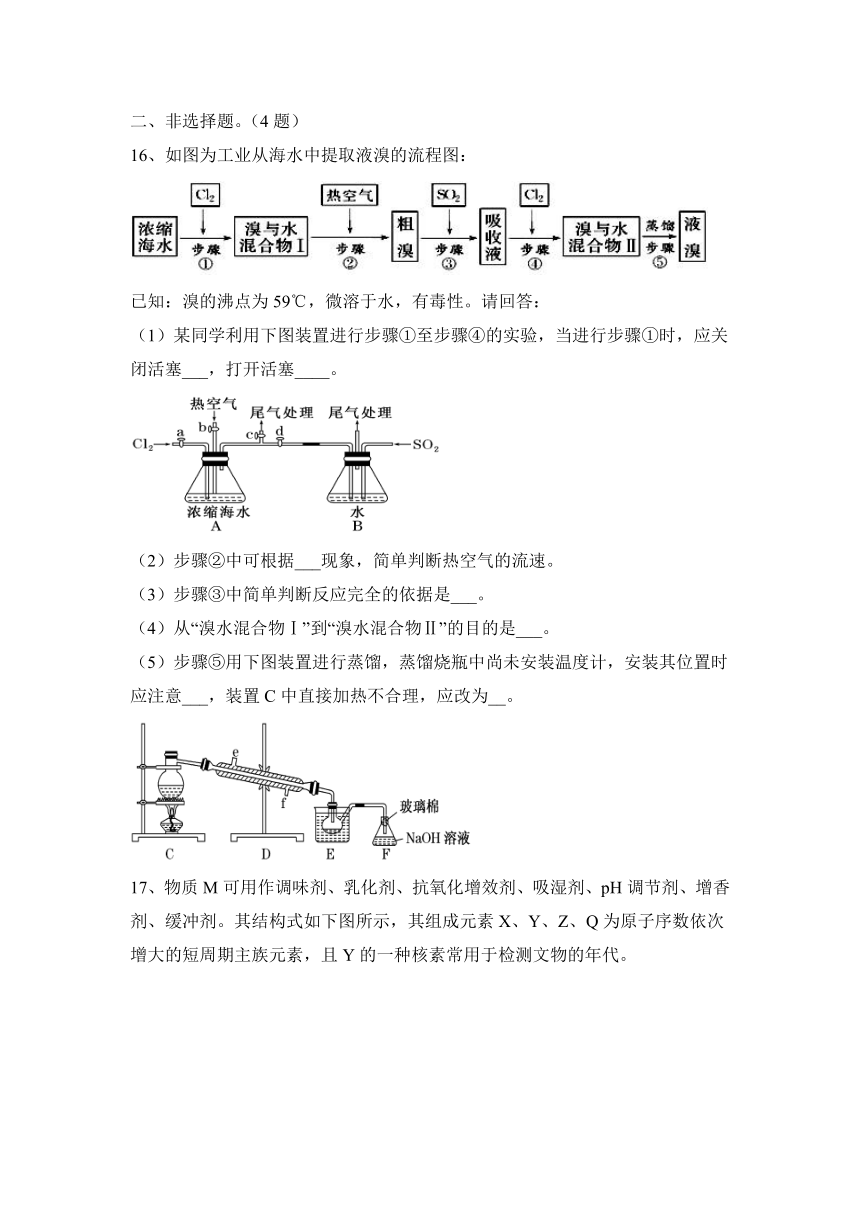
16、如图为工业从海水中提取液溴的流程图:
已知:溴的沸点为59℃,微溶于水,有毒性。请回答:
(1)某同学利用下图装置进行步骤①至步骤④的实验,当进行步骤①时,应关闭活塞___,打开活塞____。
(2)步骤②中可根据___现象,简单判断热空气的流速。
(3)步骤③中简单判断反应完全的依据是___。
(4)从“溴水混合物Ⅰ”到“溴水混合物Ⅱ”的目的是___。
(5)步骤⑤用下图装置进行蒸馏,蒸馏烧瓶中尚未安装温度计,安装其位置时应注意___,装置C中直接加热不合理,应改为__。
17、物质M可用作调味剂、乳化剂、抗氧化增效剂、吸湿剂、pH调节剂、增香剂、缓冲剂。其结构式如下图所示,其组成元素X、Y、Z、Q为原子序数依次增大的短周期主族元素,且Y的一种核素常用于检测文物的年代。
请回答下列问题:
(1)元素Q在周期表中的位置为 ,工业上采用 法冶炼Q的单质。
(2)物质M中所含化学键的类型为 ,物质M与稀硫酸反应生成有机物N,N中所含官能团的名称为 。
(3)相同条件下,等质量的Y的两种单质、分别在足量中燃烧,放出热量前者大于后者.则两种单质中, (填“”或“”)更稳定。Y与Z分别形成的简单氢化物的沸点由高到低的顺序为 (填化学式)。
(4)QX的电子式为 ,与水反应的化学方程式为 。
18、原子序数依次增加的前四周期的主族元素A~I,有关性质如下:
元素代号 A B C D E F G H I
原子半径/nm 0.037 0.074 0.073 0.071 0.143 0.102 0.099 0.197 0.114
主要化合价 +1 +5、-3 -2 -1 +4、-4 +6、-2 +7、-1 +2 +7、-1
已知E的单质是一种常见的半导体材料,分析表中数据,回答有关问题:
(1)元素G在周期表中的位置是________,元素C的气态氢化物的电子式为________。
(2)元素A、B、G可形成化合物B A4G,该化合物中存在的化学键有________, E的单质晶体属于________晶体(填“离子”、“分子”或“原子”),
(3)元素D、G、I的非金属性由强到弱的顺序是________(用元素符号表示),
(4)元素C,D的气态氢化物的稳定性顺序为________(用化学式表示),元素D的单质可以将元素C从化合物A2C中置换出来,该置换反应的化学方程式为________。
19、卤族元素的单质(F2、Cl2、Br2、I2)与H2反应过程中的能量变化如右图所示,
其中a、b、c、d分别表示卤族中某一元素的单质,△E为相同物质的量的单质与H2反应过程中的能量变化(△E越大,表明反应越容易发生).请回答下列问题:
(1)d为________,从d的水溶液中提取d的方法是________。
(2)红热的铜丝与b单质反应的现象为________。
(3)a与H2反应的化学方程式为________,b与H2反应的条件为________.
(4)由该能量变化示意图可得出的结论是同一主族,自上而下,元素的非金属性依次________。
第四章 物质结构 元素周期律检测题含答案2022—2023学年上学期高一化学人教(2019)必修第一册
人教版2019必修第一册第四章 物质结构 元素周期律
一、选择题。(15题)
1、与Na+具有相同电子总数和质子总数的微粒是 ( )
A.CH4 B.H3O+ C.N D.Cl-
【答案】B
2、有X和X+两种粒子,下列叙述正确的是( )
A.一定都是由质子、中子、电子构成的
B.化学性质几乎完全相同
C.质子数一定相等,质量数和中子数一定不相等
D.核电荷数和核外电子数一定相等
【答案】C
3、下列关于元素金属性、非金属性强弱判断不正确的是( )
A.高温下2C+SiO22CO↑+Si,说明非金属性:C>Si
B.碱性:KOH>Mg(OH)2,说明金属性:K>Mg
C.氟气与氢气在暗处相遇就会爆炸,氯气与氢气混合在光照或点燃时发生爆炸,说明非金属性:F>Cl
D.氧化性:Cu2+>Na+,说明金属性:Na>Cu
【答案】A
4、NA是阿伏加德罗常数的值。下列说法正确的是( )
A.12g14C中含有的质子数为6NA
B.23gNa在空气中点燃后充分反应,转移的电子数为NA
C.0.1molCu与浓硝酸充分反应最终得到NO2分子的数目为0.2NA
D.100g质量分数为30%的甲醛(HCHO)水溶液中氧原子的数目为NA
【答案】B
5、第 3 周期元素 R,它的最外层达到饱和时,所需电子数小于次外层和最内层电子数之差,并且等于最内层电子数的正整数倍,则关于 R 的正确说法是( )
①常温下能稳定存在的 R 的氧化物都是酸酐
②R 的气态氢化物受热都能分解
③R 元素都能以游离态存在于自然界中
④R 的最高价氧化物对应水化物都是强酸
⑤R 的氢化物在空气中都能燃烧生成+4 价 R 的氧化物
A.①③⑤ B.①②④ C.①②⑤ D.③④⑤
【答案】C
6、根据元素周期律,由下列事实进行归纳推测,推测不合理的是( )
选项 事实 推测
A CaCO3和BaCO3都难溶于水 SrCO3也难溶于水
B Si是半导体材料,同族的Ge也是半导体材料 第ⅣA族的元素的单质都可作半导体材料
C HCl在1 500 ℃时分解,HI在230 ℃时分解 HBr的分解温度介于二者之间
D Si与H2高温时反应,S与H2加热能反应 P与H2在高温时能反应
【答案】B
7、运用同主族性质递变规律分析下列推断正确的是( )
A.在氧气中,铷()的燃烧产物比钠的燃烧产物更复杂
B.砹化氢比溴化氢稳定
C.硫酸锶难溶于水,但易溶于盐酸
D.碲化氢是比硫化氢稳定的气体
【答案】A
8、以下关于分子间作用力的叙述不正确的是( )
A.是一种较弱的化学键
B.分子间作用力较弱,破坏它所需能量较少
C.分子间作用力对物质的熔点、沸点有影响
D.稀有气体原子间存在分子间作用力
【答案】A
9、氢化钠(NaH)是一种白色的离子化合物,其中钠元素显+1价;氢化钠与水反应生成H2和NaOH。下列叙述中,不正确的是( )
A.NaH的电子式为Na+[H]-
B.NaH中氢元素的离子的电子层排布与氦原子的电子层排布相同
C.微粒半径H-<Li+
D.NaH与H2O反应时,H2O做氧化剂
【答案】C
10、在4份碘化钾淀粉溶液中,分别加入下列物质,不能使溶液变蓝的是( )
A. 氯化氯 B. 溴水 C. 氯气 D. 碘的酒精溶液
【答案】 A
11、短周期元素W、X、Y、Z的原子序数依次增大,由以上四种元素组成的化合物A在一定条件下完全分解,生成甲、乙、丙、丁四种气体,甲、乙分别能使无水硫酸铜、湿润的红色石蕊试纸变蓝,丙是导致酸雨的主要污染物,丁能参与大气循环。下列说法正确的是( )
A.原子半径:WB.简单氢化物的稳定性:X>Y>Z
C.W分别与X、Z形成的简单化合物之间能反应生成离子化合物
D.在化合物A的分解反应中丙为氧化产物,丁为还原产物
【答案】C
12、已知镓(Ga)有两种天然同位素,一种是Ga,其原子在天然同位素原子中所占的百分比为60%。实验测得溴化镓(GaBr3)的摩尔质量为309.8g/mol,则此推知镓的另一种同位素是( )
A.Ga B.Ga C.Ga D.Ga
【答案】C
13、部分短周期元素的原子半径及主要化合价如下表:
元素
原子半径/ 0.160 0.111 0.106 0.066
主要化合价 +2 +1 +2 +6、-2 -2
下列叙述正确的是( )
A.一定是金属元素
B.原子半径大小:
C.的简单氢化物的沸点比的大
D.、可能形成阴、阳离子个数比为的两种化合物
【答案】D
14、下列各组中每种物质都既有离子键又有共价键的一组是( )
A.NaOH H2SO4 (NH4)2SO4 B.MgO Na2SO4 HNO3
C.Na2O2 KOH Na3PO4 D.HCl Al2O3 MgCl2
【答案】C
15、向含有NaBr、NaI的溶液中通入过量的Cl2 , 然后将溶液蒸干,并灼烧固体,最后得到的物质是( )
A. NaCl B. NaCl和NaBr C. NaCl和NaI D. NaCl和I2
【答案】 A
二、非选择题。(4题)
16、如图为工业从海水中提取液溴的流程图:
已知:溴的沸点为59℃,微溶于水,有毒性。请回答:
(1)某同学利用下图装置进行步骤①至步骤④的实验,当进行步骤①时,应关闭活塞___,打开活塞____。
(2)步骤②中可根据___现象,简单判断热空气的流速。
(3)步骤③中简单判断反应完全的依据是___。
(4)从“溴水混合物Ⅰ”到“溴水混合物Ⅱ”的目的是___。
(5)步骤⑤用下图装置进行蒸馏,蒸馏烧瓶中尚未安装温度计,安装其位置时应注意___,装置C中直接加热不合理,应改为__。
【答案】bd ac A中气泡产生的快慢 B中溶液褪色
浓缩Br2或富集溴 温度计的水银球在蒸馏烧瓶的支管口附近
水浴加热
17、物质M可用作调味剂、乳化剂、抗氧化增效剂、吸湿剂、pH调节剂、增香剂、缓冲剂。其结构式如下图所示,其组成元素X、Y、Z、Q为原子序数依次增大的短周期主族元素,且Y的一种核素常用于检测文物的年代。
请回答下列问题:
(1)元素Q在周期表中的位置为 ,工业上采用 法冶炼Q的单质。
(2)物质M中所含化学键的类型为 ,物质M与稀硫酸反应生成有机物N,N中所含官能团的名称为 。
(3)相同条件下,等质量的Y的两种单质、分别在足量中燃烧,放出热量前者大于后者.则两种单质中, (填“”或“”)更稳定。Y与Z分别形成的简单氢化物的沸点由高到低的顺序为 (填化学式)。
(4)QX的电子式为 ,与水反应的化学方程式为 。
【答案】(1)第三周期第ⅠA族; 电解
(2)离子键、共价键(极性键、非极性键); 羟基、羧基
(3);
(4);
18、原子序数依次增加的前四周期的主族元素A~I,有关性质如下:
元素代号 A B C D E F G H I
原子半径/nm 0.037 0.074 0.073 0.071 0.143 0.102 0.099 0.197 0.114
主要化合价 +1 +5、-3 -2 -1 +4、-4 +6、-2 +7、-1 +2 +7、-1
已知E的单质是一种常见的半导体材料,分析表中数据,回答有关问题:
(1)元素G在周期表中的位置是________,元素C的气态氢化物的电子式为________。
(2)元素A、B、G可形成化合物B A4G,该化合物中存在的化学键有________, E的单质晶体属于________晶体(填“离子”、“分子”或“原子”),
(3)元素D、G、I的非金属性由强到弱的顺序是________(用元素符号表示),
(4)元素C,D的气态氢化物的稳定性顺序为________(用化学式表示),元素D的单质可以将元素C从化合物A2C中置换出来,该置换反应的化学方程式为________。
【答案】 (1)第三周期ⅦA族;
(2)离子键、共价键;原子
(3)F﹥ Cl﹥ Br
(4)HF﹥H2O;2H2O + 2F2 = 4HF + O2
19、卤族元素的单质(F2、Cl2、Br2、I2)与H2反应过程中的能量变化如右图所示,
其中a、b、c、d分别表示卤族中某一元素的单质,△E为相同物质的量的单质与H2反应过程中的能量变化(△E越大,表明反应越容易发生).请回答下列问题:
(1)d为________,从d的水溶液中提取d的方法是________。
(2)红热的铜丝与b单质反应的现象为________。
(3)a与H2反应的化学方程式为________,b与H2反应的条件为________.
(4)由该能量变化示意图可得出的结论是同一主族,自上而下,元素的非金属性依次________。
【答案】(1)I2;萃取或萃取分液
(2)铜丝剧烈燃烧,产生棕黄色的烟
(3)H2+F2=2HF;点燃(或光照) (4)减弱
【解析】(1)因卤族元素的单质与氢气化合的越来越难,得出a、b、c、d分别为F2、Cl2、Br2 、I2 , d为I2 , 碘不易溶于水,易溶于有机溶剂,则选有机溶剂萃取、分液、蒸馏可得到碘,
故答案为:I2;萃取或萃取分液;
(2)红热的铜丝在b单质中燃烧的现象为剧烈燃烧,产生棕黄色的烟,
故答案为:铜丝剧烈燃烧,产生棕黄色的烟;
(3)F2非金属性强,与H2混合就能反应,反应的化学方程式为H2+F2═2HF,Cl2与H2在点燃(或光照)的条件下能够生成HCl,
故答案为:H2+F2═2HF;点燃(或光照);
(4)因卤族元素的单质与氢气化合的越来越难,说明同一主族,自上而下,元素的非金属性依次减弱,故答案为:减弱。
人教版2019必修第一册第四章 物质结构 元素周期律
一、选择题。(15题)
1、与Na+具有相同电子总数和质子总数的微粒是 ( )
A.CH4 B.H3O+ C.N D.Cl-
2、有X和X+两种粒子,下列叙述正确的是( )
A.一定都是由质子、中子、电子构成的
B.化学性质几乎完全相同
C.质子数一定相等,质量数和中子数一定不相等
D.核电荷数和核外电子数一定相等
3、下列关于元素金属性、非金属性强弱判断不正确的是( )
A.高温下2C+SiO22CO↑+Si,说明非金属性:C>Si
B.碱性:KOH>Mg(OH)2,说明金属性:K>Mg
C.氟气与氢气在暗处相遇就会爆炸,氯气与氢气混合在光照或点燃时发生爆炸,说明非金属性:F>Cl
D.氧化性:Cu2+>Na+,说明金属性:Na>Cu
4、NA是阿伏加德罗常数的值。下列说法正确的是( )
A.12g14C中含有的质子数为6NA
B.23gNa在空气中点燃后充分反应,转移的电子数为NA
C.0.1molCu与浓硝酸充分反应最终得到NO2分子的数目为0.2NA
D.100g质量分数为30%的甲醛(HCHO)水溶液中氧原子的数目为NA
5、第 3 周期元素 R,它的最外层达到饱和时,所需电子数小于次外层和最内层电子数之差,并且等于最内层电子数的正整数倍,则关于 R 的正确说法是( )
①常温下能稳定存在的 R 的氧化物都是酸酐
②R 的气态氢化物受热都能分解
③R 元素都能以游离态存在于自然界中
④R 的最高价氧化物对应水化物都是强酸
⑤R 的氢化物在空气中都能燃烧生成+4 价 R 的氧化物
A.①③⑤ B.①②④ C.①②⑤ D.③④⑤
6、根据元素周期律,由下列事实进行归纳推测,推测不合理的是( )
选项 事实 推测
A CaCO3和BaCO3都难溶于水 SrCO3也难溶于水
B Si是半导体材料,同族的Ge也是半导体材料 第ⅣA族的元素的单质都可作半导体材料
C HCl在1 500 ℃时分解,HI在230 ℃时分解 HBr的分解温度介于二者之间
D Si与H2高温时反应,S与H2加热能反应 P与H2在高温时能反应
7、运用同主族性质递变规律分析下列推断正确的是( )
A.在氧气中,铷()的燃烧产物比钠的燃烧产物更复杂
B.砹化氢比溴化氢稳定
C.硫酸锶难溶于水,但易溶于盐酸
D.碲化氢是比硫化氢稳定的气体
8、以下关于分子间作用力的叙述不正确的是( )
A.是一种较弱的化学键
B.分子间作用力较弱,破坏它所需能量较少
C.分子间作用力对物质的熔点、沸点有影响
D.稀有气体原子间存在分子间作用力
9、氢化钠(NaH)是一种白色的离子化合物,其中钠元素显+1价;氢化钠与水反应生成H2和NaOH。下列叙述中,不正确的是( )
A.NaH的电子式为Na+[H]-
B.NaH中氢元素的离子的电子层排布与氦原子的电子层排布相同
C.微粒半径H-<Li+
D.NaH与H2O反应时,H2O做氧化剂
10、在4份碘化钾淀粉溶液中,分别加入下列物质,不能使溶液变蓝的是( )
A. 氯化氯 B. 溴水 C. 氯气 D. 碘的酒精溶液
11、短周期元素W、X、Y、Z的原子序数依次增大,由以上四种元素组成的化合物A在一定条件下完全分解,生成甲、乙、丙、丁四种气体,甲、乙分别能使无水硫酸铜、湿润的红色石蕊试纸变蓝,丙是导致酸雨的主要污染物,丁能参与大气循环。下列说法正确的是( )
A.原子半径:W
C.W分别与X、Z形成的简单化合物之间能反应生成离子化合物
D.在化合物A的分解反应中丙为氧化产物,丁为还原产物
12、已知镓(Ga)有两种天然同位素,一种是Ga,其原子在天然同位素原子中所占的百分比为60%。实验测得溴化镓(GaBr3)的摩尔质量为309.8g/mol,则此推知镓的另一种同位素是( )
A.Ga B.Ga C.Ga D.Ga
13、部分短周期元素的原子半径及主要化合价如下表:
元素
原子半径/ 0.160 0.111 0.106 0.066
主要化合价 +2 +1 +2 +6、-2 -2
下列叙述正确的是( )
A.一定是金属元素
B.原子半径大小:
C.的简单氢化物的沸点比的大
D.、可能形成阴、阳离子个数比为的两种化合物
14、下列各组中每种物质都既有离子键又有共价键的一组是( )
A.NaOH H2SO4 (NH4)2SO4 B.MgO Na2SO4 HNO3
C.Na2O2 KOH Na3PO4 D.HCl Al2O3 MgCl2
15、向含有NaBr、NaI的溶液中通入过量的Cl2 , 然后将溶液蒸干,并灼烧固体,最后得到的物质是( )
A. NaCl B. NaCl和NaBr C. NaCl和NaI D. NaCl和I2
二、非选择题。(4题)
16、如图为工业从海水中提取液溴的流程图:
已知:溴的沸点为59℃,微溶于水,有毒性。请回答:
(1)某同学利用下图装置进行步骤①至步骤④的实验,当进行步骤①时,应关闭活塞___,打开活塞____。
(2)步骤②中可根据___现象,简单判断热空气的流速。
(3)步骤③中简单判断反应完全的依据是___。
(4)从“溴水混合物Ⅰ”到“溴水混合物Ⅱ”的目的是___。
(5)步骤⑤用下图装置进行蒸馏,蒸馏烧瓶中尚未安装温度计,安装其位置时应注意___,装置C中直接加热不合理,应改为__。
17、物质M可用作调味剂、乳化剂、抗氧化增效剂、吸湿剂、pH调节剂、增香剂、缓冲剂。其结构式如下图所示,其组成元素X、Y、Z、Q为原子序数依次增大的短周期主族元素,且Y的一种核素常用于检测文物的年代。
请回答下列问题:
(1)元素Q在周期表中的位置为 ,工业上采用 法冶炼Q的单质。
(2)物质M中所含化学键的类型为 ,物质M与稀硫酸反应生成有机物N,N中所含官能团的名称为 。
(3)相同条件下,等质量的Y的两种单质、分别在足量中燃烧,放出热量前者大于后者.则两种单质中, (填“”或“”)更稳定。Y与Z分别形成的简单氢化物的沸点由高到低的顺序为 (填化学式)。
(4)QX的电子式为 ,与水反应的化学方程式为 。
18、原子序数依次增加的前四周期的主族元素A~I,有关性质如下:
元素代号 A B C D E F G H I
原子半径/nm 0.037 0.074 0.073 0.071 0.143 0.102 0.099 0.197 0.114
主要化合价 +1 +5、-3 -2 -1 +4、-4 +6、-2 +7、-1 +2 +7、-1
已知E的单质是一种常见的半导体材料,分析表中数据,回答有关问题:
(1)元素G在周期表中的位置是________,元素C的气态氢化物的电子式为________。
(2)元素A、B、G可形成化合物B A4G,该化合物中存在的化学键有________, E的单质晶体属于________晶体(填“离子”、“分子”或“原子”),
(3)元素D、G、I的非金属性由强到弱的顺序是________(用元素符号表示),
(4)元素C,D的气态氢化物的稳定性顺序为________(用化学式表示),元素D的单质可以将元素C从化合物A2C中置换出来,该置换反应的化学方程式为________。
19、卤族元素的单质(F2、Cl2、Br2、I2)与H2反应过程中的能量变化如右图所示,
其中a、b、c、d分别表示卤族中某一元素的单质,△E为相同物质的量的单质与H2反应过程中的能量变化(△E越大,表明反应越容易发生).请回答下列问题:
(1)d为________,从d的水溶液中提取d的方法是________。
(2)红热的铜丝与b单质反应的现象为________。
(3)a与H2反应的化学方程式为________,b与H2反应的条件为________.
(4)由该能量变化示意图可得出的结论是同一主族,自上而下,元素的非金属性依次________。
第四章 物质结构 元素周期律检测题含答案2022—2023学年上学期高一化学人教(2019)必修第一册
人教版2019必修第一册第四章 物质结构 元素周期律
一、选择题。(15题)
1、与Na+具有相同电子总数和质子总数的微粒是 ( )
A.CH4 B.H3O+ C.N D.Cl-
【答案】B
2、有X和X+两种粒子,下列叙述正确的是( )
A.一定都是由质子、中子、电子构成的
B.化学性质几乎完全相同
C.质子数一定相等,质量数和中子数一定不相等
D.核电荷数和核外电子数一定相等
【答案】C
3、下列关于元素金属性、非金属性强弱判断不正确的是( )
A.高温下2C+SiO22CO↑+Si,说明非金属性:C>Si
B.碱性:KOH>Mg(OH)2,说明金属性:K>Mg
C.氟气与氢气在暗处相遇就会爆炸,氯气与氢气混合在光照或点燃时发生爆炸,说明非金属性:F>Cl
D.氧化性:Cu2+>Na+,说明金属性:Na>Cu
【答案】A
4、NA是阿伏加德罗常数的值。下列说法正确的是( )
A.12g14C中含有的质子数为6NA
B.23gNa在空气中点燃后充分反应,转移的电子数为NA
C.0.1molCu与浓硝酸充分反应最终得到NO2分子的数目为0.2NA
D.100g质量分数为30%的甲醛(HCHO)水溶液中氧原子的数目为NA
【答案】B
5、第 3 周期元素 R,它的最外层达到饱和时,所需电子数小于次外层和最内层电子数之差,并且等于最内层电子数的正整数倍,则关于 R 的正确说法是( )
①常温下能稳定存在的 R 的氧化物都是酸酐
②R 的气态氢化物受热都能分解
③R 元素都能以游离态存在于自然界中
④R 的最高价氧化物对应水化物都是强酸
⑤R 的氢化物在空气中都能燃烧生成+4 价 R 的氧化物
A.①③⑤ B.①②④ C.①②⑤ D.③④⑤
【答案】C
6、根据元素周期律,由下列事实进行归纳推测,推测不合理的是( )
选项 事实 推测
A CaCO3和BaCO3都难溶于水 SrCO3也难溶于水
B Si是半导体材料,同族的Ge也是半导体材料 第ⅣA族的元素的单质都可作半导体材料
C HCl在1 500 ℃时分解,HI在230 ℃时分解 HBr的分解温度介于二者之间
D Si与H2高温时反应,S与H2加热能反应 P与H2在高温时能反应
【答案】B
7、运用同主族性质递变规律分析下列推断正确的是( )
A.在氧气中,铷()的燃烧产物比钠的燃烧产物更复杂
B.砹化氢比溴化氢稳定
C.硫酸锶难溶于水,但易溶于盐酸
D.碲化氢是比硫化氢稳定的气体
【答案】A
8、以下关于分子间作用力的叙述不正确的是( )
A.是一种较弱的化学键
B.分子间作用力较弱,破坏它所需能量较少
C.分子间作用力对物质的熔点、沸点有影响
D.稀有气体原子间存在分子间作用力
【答案】A
9、氢化钠(NaH)是一种白色的离子化合物,其中钠元素显+1价;氢化钠与水反应生成H2和NaOH。下列叙述中,不正确的是( )
A.NaH的电子式为Na+[H]-
B.NaH中氢元素的离子的电子层排布与氦原子的电子层排布相同
C.微粒半径H-<Li+
D.NaH与H2O反应时,H2O做氧化剂
【答案】C
10、在4份碘化钾淀粉溶液中,分别加入下列物质,不能使溶液变蓝的是( )
A. 氯化氯 B. 溴水 C. 氯气 D. 碘的酒精溶液
【答案】 A
11、短周期元素W、X、Y、Z的原子序数依次增大,由以上四种元素组成的化合物A在一定条件下完全分解,生成甲、乙、丙、丁四种气体,甲、乙分别能使无水硫酸铜、湿润的红色石蕊试纸变蓝,丙是导致酸雨的主要污染物,丁能参与大气循环。下列说法正确的是( )
A.原子半径:W
C.W分别与X、Z形成的简单化合物之间能反应生成离子化合物
D.在化合物A的分解反应中丙为氧化产物,丁为还原产物
【答案】C
12、已知镓(Ga)有两种天然同位素,一种是Ga,其原子在天然同位素原子中所占的百分比为60%。实验测得溴化镓(GaBr3)的摩尔质量为309.8g/mol,则此推知镓的另一种同位素是( )
A.Ga B.Ga C.Ga D.Ga
【答案】C
13、部分短周期元素的原子半径及主要化合价如下表:
元素
原子半径/ 0.160 0.111 0.106 0.066
主要化合价 +2 +1 +2 +6、-2 -2
下列叙述正确的是( )
A.一定是金属元素
B.原子半径大小:
C.的简单氢化物的沸点比的大
D.、可能形成阴、阳离子个数比为的两种化合物
【答案】D
14、下列各组中每种物质都既有离子键又有共价键的一组是( )
A.NaOH H2SO4 (NH4)2SO4 B.MgO Na2SO4 HNO3
C.Na2O2 KOH Na3PO4 D.HCl Al2O3 MgCl2
【答案】C
15、向含有NaBr、NaI的溶液中通入过量的Cl2 , 然后将溶液蒸干,并灼烧固体,最后得到的物质是( )
A. NaCl B. NaCl和NaBr C. NaCl和NaI D. NaCl和I2
【答案】 A
二、非选择题。(4题)
16、如图为工业从海水中提取液溴的流程图:
已知:溴的沸点为59℃,微溶于水,有毒性。请回答:
(1)某同学利用下图装置进行步骤①至步骤④的实验,当进行步骤①时,应关闭活塞___,打开活塞____。
(2)步骤②中可根据___现象,简单判断热空气的流速。
(3)步骤③中简单判断反应完全的依据是___。
(4)从“溴水混合物Ⅰ”到“溴水混合物Ⅱ”的目的是___。
(5)步骤⑤用下图装置进行蒸馏,蒸馏烧瓶中尚未安装温度计,安装其位置时应注意___,装置C中直接加热不合理,应改为__。
【答案】bd ac A中气泡产生的快慢 B中溶液褪色
浓缩Br2或富集溴 温度计的水银球在蒸馏烧瓶的支管口附近
水浴加热
17、物质M可用作调味剂、乳化剂、抗氧化增效剂、吸湿剂、pH调节剂、增香剂、缓冲剂。其结构式如下图所示,其组成元素X、Y、Z、Q为原子序数依次增大的短周期主族元素,且Y的一种核素常用于检测文物的年代。
请回答下列问题:
(1)元素Q在周期表中的位置为 ,工业上采用 法冶炼Q的单质。
(2)物质M中所含化学键的类型为 ,物质M与稀硫酸反应生成有机物N,N中所含官能团的名称为 。
(3)相同条件下,等质量的Y的两种单质、分别在足量中燃烧,放出热量前者大于后者.则两种单质中, (填“”或“”)更稳定。Y与Z分别形成的简单氢化物的沸点由高到低的顺序为 (填化学式)。
(4)QX的电子式为 ,与水反应的化学方程式为 。
【答案】(1)第三周期第ⅠA族; 电解
(2)离子键、共价键(极性键、非极性键); 羟基、羧基
(3);
(4);
18、原子序数依次增加的前四周期的主族元素A~I,有关性质如下:
元素代号 A B C D E F G H I
原子半径/nm 0.037 0.074 0.073 0.071 0.143 0.102 0.099 0.197 0.114
主要化合价 +1 +5、-3 -2 -1 +4、-4 +6、-2 +7、-1 +2 +7、-1
已知E的单质是一种常见的半导体材料,分析表中数据,回答有关问题:
(1)元素G在周期表中的位置是________,元素C的气态氢化物的电子式为________。
(2)元素A、B、G可形成化合物B A4G,该化合物中存在的化学键有________, E的单质晶体属于________晶体(填“离子”、“分子”或“原子”),
(3)元素D、G、I的非金属性由强到弱的顺序是________(用元素符号表示),
(4)元素C,D的气态氢化物的稳定性顺序为________(用化学式表示),元素D的单质可以将元素C从化合物A2C中置换出来,该置换反应的化学方程式为________。
【答案】 (1)第三周期ⅦA族;
(2)离子键、共价键;原子
(3)F﹥ Cl﹥ Br
(4)HF﹥H2O;2H2O + 2F2 = 4HF + O2
19、卤族元素的单质(F2、Cl2、Br2、I2)与H2反应过程中的能量变化如右图所示,
其中a、b、c、d分别表示卤族中某一元素的单质,△E为相同物质的量的单质与H2反应过程中的能量变化(△E越大,表明反应越容易发生).请回答下列问题:
(1)d为________,从d的水溶液中提取d的方法是________。
(2)红热的铜丝与b单质反应的现象为________。
(3)a与H2反应的化学方程式为________,b与H2反应的条件为________.
(4)由该能量变化示意图可得出的结论是同一主族,自上而下,元素的非金属性依次________。
【答案】(1)I2;萃取或萃取分液
(2)铜丝剧烈燃烧,产生棕黄色的烟
(3)H2+F2=2HF;点燃(或光照) (4)减弱
【解析】(1)因卤族元素的单质与氢气化合的越来越难,得出a、b、c、d分别为F2、Cl2、Br2 、I2 , d为I2 , 碘不易溶于水,易溶于有机溶剂,则选有机溶剂萃取、分液、蒸馏可得到碘,
故答案为:I2;萃取或萃取分液;
(2)红热的铜丝在b单质中燃烧的现象为剧烈燃烧,产生棕黄色的烟,
故答案为:铜丝剧烈燃烧,产生棕黄色的烟;
(3)F2非金属性强,与H2混合就能反应,反应的化学方程式为H2+F2═2HF,Cl2与H2在点燃(或光照)的条件下能够生成HCl,
故答案为:H2+F2═2HF;点燃(或光照);
(4)因卤族元素的单质与氢气化合的越来越难,说明同一主族,自上而下,元素的非金属性依次减弱,故答案为:减弱。
