第三章 第一节 第2课时《铁盐和亚铁盐》课件2021-2022学年上学期高一化学人教版(2019)必修第一册(19张ppt)
文档属性
| 名称 | 第三章 第一节 第2课时《铁盐和亚铁盐》课件2021-2022学年上学期高一化学人教版(2019)必修第一册(19张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 73.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-25 19:31:37 | ||
图片预览






文档简介
(共19张PPT)
铁盐和亚铁盐
第三章 第一节 铁及其化合物
中国红石公园——丹霞山
丹霞山的岩石土壤为什么是红色的?
猜想:可能含有Fe2O3
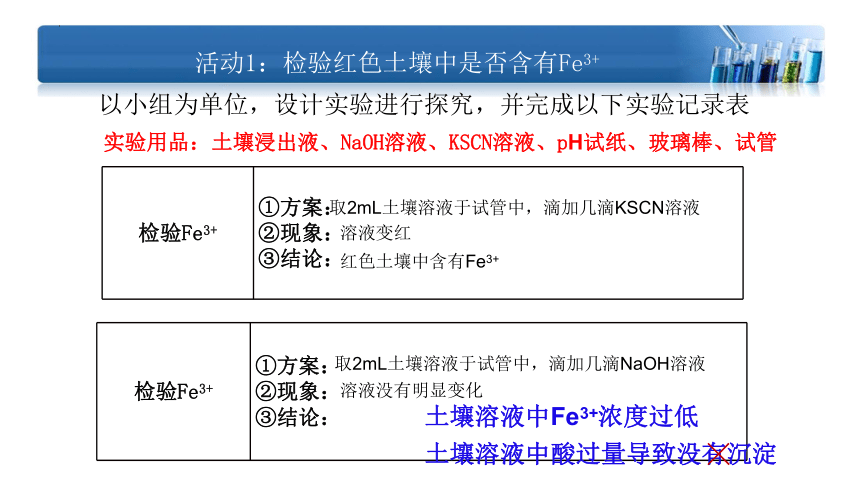
活动1:检验红色土壤中是否含有Fe3+
过滤
加酸
溶解
得到土壤浸出液
方法一:
观察颜色
方法二:
滴加NaOH溶液
方法三:
往溶液中滴加KSCN溶液
检验Fe3+的方法
Fe3+为棕黄色
Fe3+ + 3SCN- Fe(SCN)3
溶液变为红色
产生红褐色沉淀
实验用品:土壤浸出液、NaOH溶液、KSCN溶液、pH试纸、玻璃棒、试管
检验Fe3+ ①方案: ②现象:
③结论:
活动1:检验红色土壤中是否含有Fe3+
检验Fe3+ ①方案: ②现象:
③结论:
以小组为单位,设计实验进行探究,并完成以下实验记录表
取2mL土壤溶液于试管中,滴加几滴KSCN溶液
溶液变红
红色土壤中含有Fe3+
取2mL土壤溶液于试管中,滴加几滴NaOH溶液
溶液没有明显变化
土壤溶液中酸过量导致没有沉淀
土壤溶液中Fe3+浓度过低
×
沾有KSCN的滤纸
活动2: 画出红色的丹霞山
涂上FeCl3溶液
七彩丹霞的颜色与沉积物以及沉积物的氧化-还原有关。沉积物中钙、铁离子的含量很大程度影响了地层颜色的变化,尤其是铁离子。当Fe3+被还原时,颜色发生了改变。
神奇的“五花肉”是如何形成的?
活动3: 画出不同层次颜色的丹霞山
Fe3+
Fe2+
还原剂:维生素C,金属单质,如铁、Cu,草酸,SO2等
氧化剂
还原剂
总结归纳:
氧化剂:H2O2 、 O2 、 HNO3、KMnO4、Cl2等
Fe3+和Fe2+的相互转化
氧化性
还原性
氧化性
【活动4】完成实验并书写离子方程式
现象 离子方程式
向盛有少量FeCl2溶液的试管中,滴加几滴KSCN溶液,观察现象,再加入几滴氯水,继续观察
向盛有少量FeCl3溶液的试管中,滴加几滴KSCN溶液,再加入少量Fe粉,充分振荡,观察并记录现象
2Fe3++Fe=3Fe2+
2Fe2++Cl2=2Fe3++2Cl-
加入KSCN不显红色,加入氯水后溶液显红色
加入KSCN显红色,加入铁粉后溶液显红色
运用1——补铁剂与维c同服效果更佳
亚铁具有还原性,容易被氧化为三价铁,三价铁不易被吸收,所以可以同时服用维生素c,提高铁元素的吸收。
运用2——茶水变色小魔术
茶
“红酒”
茶
两次变色分别往茶水中添加了什么物质?
(提示:茶水中的鞣酸遇三价铁离子生成黑色的鞣酸铁)
硫酸亚铁
维生素C
运用3——用Fe3+制作电路板
电路板的制作过程:
(1)在镀有一层铜的覆铜板上,给设计好的铜线路涂上一层油墨;
(2)把覆铜板浸到氯化铁溶液中;
(3)被油墨覆盖的铜被保护,形成铜线路,没有覆盖油墨的铜被反应掉。
【实验】取一小块覆铜板,用油性笔在覆铜板上画上设计好的图案,然后浸入盛有FeCl3溶液的小烧杯中。过一段时间后,取出覆铜板并用水清洗干净。观察实验现象。
2Fe3++Cu=2Fe2++Cu2+
运用3——用Fe3+制作电路板
【课堂小结】
1、学习Fe3+的检验方法
2、掌握Fe2+与Fe3+的转化条件
3、了解它们在生活中的应用
练一练
如何除去FeCl2中的FeCl3( )
KMnO4溶液 B. 铁粉
C. KSCN溶液 D. 铜片
如何除去FeCl3中的FeCl2( )
KI 溶液 B. 铁粉
C. KSCN溶液 D. 氯水
B
D
为了检验某FeCl2溶液是否变质可向溶液中加入( )
NaOH 溶液 B. 铁粉
C. KSCN溶液 D. 石蕊试液
C
铁盐和亚铁盐
第三章 第一节 铁及其化合物
中国红石公园——丹霞山
丹霞山的岩石土壤为什么是红色的?
猜想:可能含有Fe2O3
活动1:检验红色土壤中是否含有Fe3+
过滤
加酸
溶解
得到土壤浸出液
方法一:
观察颜色
方法二:
滴加NaOH溶液
方法三:
往溶液中滴加KSCN溶液
检验Fe3+的方法
Fe3+为棕黄色
Fe3+ + 3SCN- Fe(SCN)3
溶液变为红色
产生红褐色沉淀
实验用品:土壤浸出液、NaOH溶液、KSCN溶液、pH试纸、玻璃棒、试管
检验Fe3+ ①方案: ②现象:
③结论:
活动1:检验红色土壤中是否含有Fe3+
检验Fe3+ ①方案: ②现象:
③结论:
以小组为单位,设计实验进行探究,并完成以下实验记录表
取2mL土壤溶液于试管中,滴加几滴KSCN溶液
溶液变红
红色土壤中含有Fe3+
取2mL土壤溶液于试管中,滴加几滴NaOH溶液
溶液没有明显变化
土壤溶液中酸过量导致没有沉淀
土壤溶液中Fe3+浓度过低
×
沾有KSCN的滤纸
活动2: 画出红色的丹霞山
涂上FeCl3溶液
七彩丹霞的颜色与沉积物以及沉积物的氧化-还原有关。沉积物中钙、铁离子的含量很大程度影响了地层颜色的变化,尤其是铁离子。当Fe3+被还原时,颜色发生了改变。
神奇的“五花肉”是如何形成的?
活动3: 画出不同层次颜色的丹霞山
Fe3+
Fe2+
还原剂:维生素C,金属单质,如铁、Cu,草酸,SO2等
氧化剂
还原剂
总结归纳:
氧化剂:H2O2 、 O2 、 HNO3、KMnO4、Cl2等
Fe3+和Fe2+的相互转化
氧化性
还原性
氧化性
【活动4】完成实验并书写离子方程式
现象 离子方程式
向盛有少量FeCl2溶液的试管中,滴加几滴KSCN溶液,观察现象,再加入几滴氯水,继续观察
向盛有少量FeCl3溶液的试管中,滴加几滴KSCN溶液,再加入少量Fe粉,充分振荡,观察并记录现象
2Fe3++Fe=3Fe2+
2Fe2++Cl2=2Fe3++2Cl-
加入KSCN不显红色,加入氯水后溶液显红色
加入KSCN显红色,加入铁粉后溶液显红色
运用1——补铁剂与维c同服效果更佳
亚铁具有还原性,容易被氧化为三价铁,三价铁不易被吸收,所以可以同时服用维生素c,提高铁元素的吸收。
运用2——茶水变色小魔术
茶
“红酒”
茶
两次变色分别往茶水中添加了什么物质?
(提示:茶水中的鞣酸遇三价铁离子生成黑色的鞣酸铁)
硫酸亚铁
维生素C
运用3——用Fe3+制作电路板
电路板的制作过程:
(1)在镀有一层铜的覆铜板上,给设计好的铜线路涂上一层油墨;
(2)把覆铜板浸到氯化铁溶液中;
(3)被油墨覆盖的铜被保护,形成铜线路,没有覆盖油墨的铜被反应掉。
【实验】取一小块覆铜板,用油性笔在覆铜板上画上设计好的图案,然后浸入盛有FeCl3溶液的小烧杯中。过一段时间后,取出覆铜板并用水清洗干净。观察实验现象。
2Fe3++Cu=2Fe2++Cu2+
运用3——用Fe3+制作电路板
【课堂小结】
1、学习Fe3+的检验方法
2、掌握Fe2+与Fe3+的转化条件
3、了解它们在生活中的应用
练一练
如何除去FeCl2中的FeCl3( )
KMnO4溶液 B. 铁粉
C. KSCN溶液 D. 铜片
如何除去FeCl3中的FeCl2( )
KI 溶液 B. 铁粉
C. KSCN溶液 D. 氯水
B
D
为了检验某FeCl2溶液是否变质可向溶液中加入( )
NaOH 溶液 B. 铁粉
C. KSCN溶液 D. 石蕊试液
C
