10.1常见的酸和碱(第二课时)
文档属性
| 名称 | 10.1常见的酸和碱(第二课时) |  | |
| 格式 | zip | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-08-22 16:34:46 | ||
图片预览




文档简介
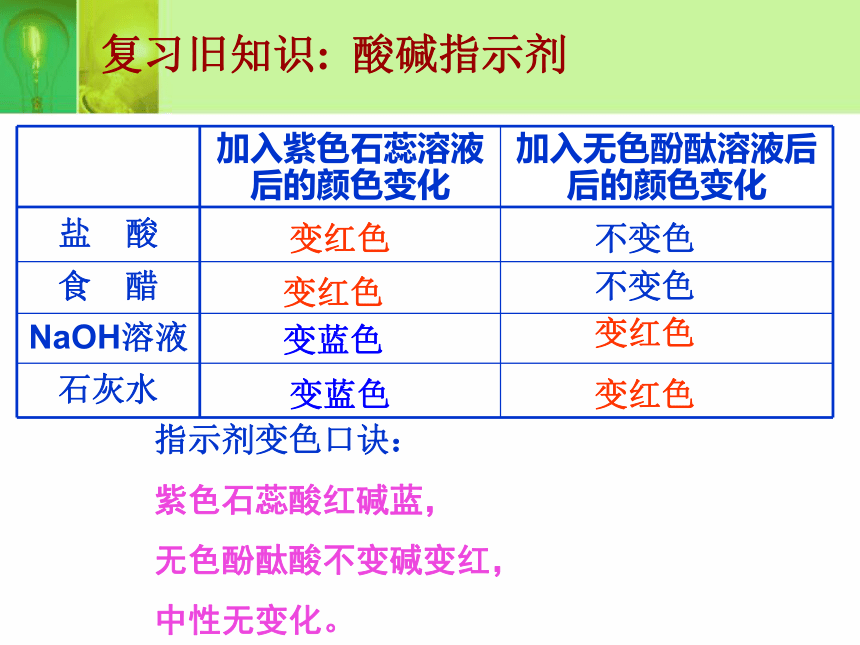
课件18张PPT。课题1 常见的酸和碱第二课时 酸的化学性质 一次妈妈在做饭,小莉在帮妈妈凉拌紫萝卜丝时,倒入食醋后,发现紫萝卜丝变成了红色,这是怎么回事呢? 紫萝卜中含有一种植物色素,它遇到酸性溶液能变成红色。 想一想复习旧知识: 酸碱指示剂变红色变红色变红色变红色变蓝色变蓝色不变色不变色指示剂变色口诀:
紫色石蕊酸红碱蓝,
无色酚酞酸不变碱变红,
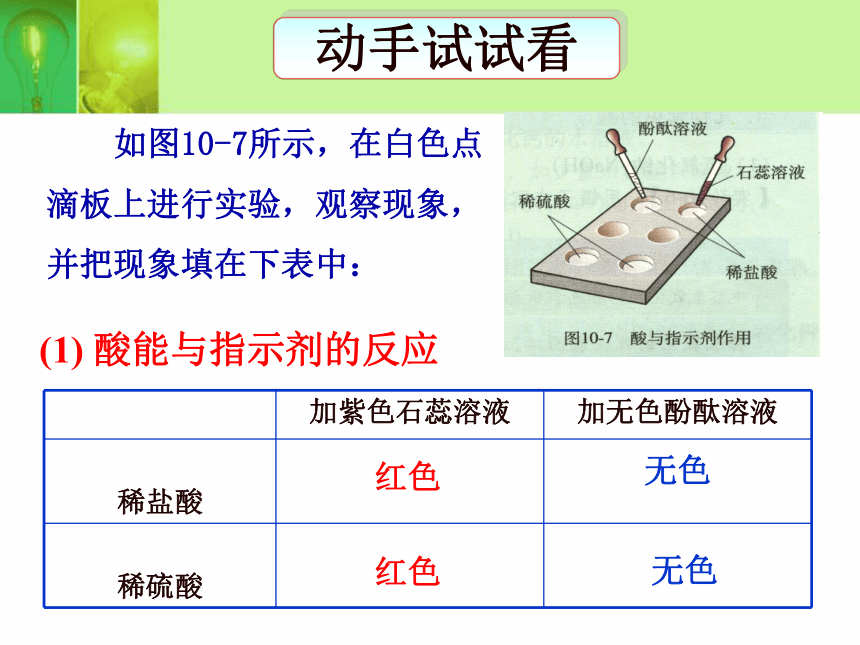
中性无变化。红色无色无色红色(1) 酸能与指示剂的反应动手试试看 如图10-7所示,在白色点
滴板上进行实验,观察现象,
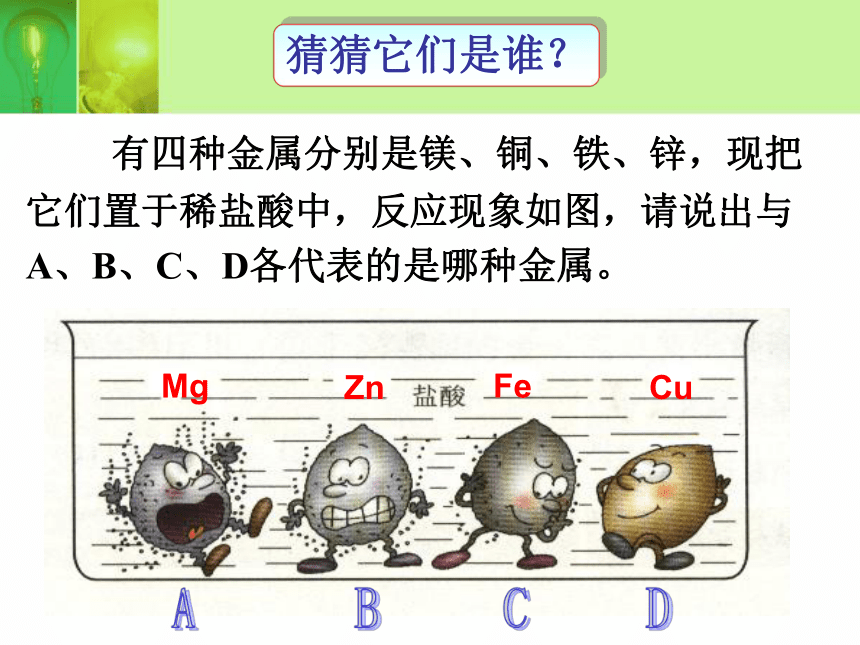
并把现象填在下表中: 有四种金属分别是镁、铜、铁、锌,现把
它们置于稀盐酸中,反应现象如图,请说出与
A、B、C、D各代表的是哪种金属。 MgZnFeCu猜猜它们是谁?结论:酸能与较活泼的金属反应产生氢气反应非常剧烈,产生气泡反应非常剧烈,产生气泡反应速度适中,产生气泡反应速度适中,产生气泡反应比较慢,产生气泡反应比较慢,产生气泡酸能与金属反应 生活中我们都提倡使用铁锅炒菜。因为铁锅中有铁元素,如果在炒菜或煮东西时,加上醋,铁和酸反应,生成有铁离子的盐类,使铁元素更易融入菜中,人吃了饭菜就可以补充人体中的铁元素,可有效减少缺铁性贫血。有人做过试验,用铁锅炒洋葱,把油加热5分钟以后,洋葱里含铁量比原来提高一两倍。如果加上盐和醋后再同样加热5分钟,含铁量提高到原来的15到19倍。所以我们中国的铁锅可是世界有名的。... ...回归生活闻名于世的中国铁锅 酸能与金属铁反应,能否与铁锈反应?想一想砂纸温馨提示:
1、稀盐酸、稀硫酸具有一定的腐蚀性,使用时要十分小心,防止沾到皮肤上
2、如果不说明用量,液体取1-2ml为宜活动与探究 分别将生锈的铁钉放入稀盐酸和稀硫酸中,观察现象。 刚才同学们在实验中观察到实验现象归纳起来有两种:
1、开始时观察到铁锈逐渐消失,溶液由无色慢慢变成黄色 。这是为什么呢?加入的酸量不同!酸也是除锈专家 !2、开始时观察到铁锈逐渐消失,溶液由无色慢慢变成黄色,当铁锈消失以后,铁钉表面会冒出气泡。讨论:
1、利用上述反应清除金属制品表面的锈时,能否将金属制品长时间浸在酸中?为什么?
2、氧化铜能与稀硫酸发生化学反应吗?
为什么? 当长时间浸泡时,与铁锈反应剩余的酸就会继续与铁反应。 实验证明,氧化铜也能与酸反应。
请你写出氧化铜与盐酸或硫酸反应的化学方程式并归纳酸的性质:CuO+2HCl=CuCl2+H2O
CuO+H2SO4=CuSO4+H2O结论:酸能与金属氧化物反应有水生成酸能与金属氧化物反应复分解反应CuO + 2HClCuCl2+ H2O= 像这类由两种化合物相互交换成分,生成另外两种化合物的反应,叫做复分解反应+2-2+1-1+2-1+1-2双交换,价不变。相信你能理解四种基本反应类型:1、化合反应:2、分解反应:3、置换反应:4、复分解反应:相信你能归纳A + B = ABAB = A + BA + BC = AC + BAB + CD = AD + CB一、酸能使酸碱指示剂显示不同的颜色;二、酸能与多种活泼金属反应,生成氢气;三、酸能与某些金属氧化物反应,生成水。酸有一些相似的化学性质:盘点一下我们的收获吧!你还有什么收获?从个别推导到一般1、下列物质放入或通入水中能使紫色石蕊试液变红的是?(??)
A.Cu(OH)2 B.NaOH C.CO2 D.NaCl
2、下列金属与盐酸反应,剧烈程度排列顺序正确的是( )
A.Fe>Al>Mg>Zn B.Mg>Al>Zn>Fe
C.Mg>Fe>Al>Zn D.Zn>Fe>Mg>AlCB相信你能选择我也来试一把Al2O3 + 6HCl = 2AlCl3 + 3H2O
2Al + 6HCl = 2AlCl3 + 3H2 ↑
4、铝片(表面已氧化)和过量的稀盐酸反应的现象,
并用化学方程式解释为什么?答:一开始铝片的表面没有气泡冒出,一段时间后,有少量气泡冒出,后来反应越来越剧烈。Al2O3 + 6HCl = 2AlCl3 + 3H2O
2Al + 6HCl = 2AlCl3 + 3H2 ↑
3、铝片(表面已氧化)和过量的稀盐酸反应的现象,
并用化学方程式解释为什么?答:一开始铝片的表面没有气泡冒出,一段时间后,有少量气泡冒出,后来反应越来越剧烈。相信你能解释 4、实验室有两瓶失去标签的溶液可能是
稀硫酸和浓硫酸,你用那些方法区分它
们?并说出你的理由?相信你会鉴别
紫色石蕊酸红碱蓝,
无色酚酞酸不变碱变红,
中性无变化。红色无色无色红色(1) 酸能与指示剂的反应动手试试看 如图10-7所示,在白色点
滴板上进行实验,观察现象,
并把现象填在下表中: 有四种金属分别是镁、铜、铁、锌,现把
它们置于稀盐酸中,反应现象如图,请说出与
A、B、C、D各代表的是哪种金属。 MgZnFeCu猜猜它们是谁?结论:酸能与较活泼的金属反应产生氢气反应非常剧烈,产生气泡反应非常剧烈,产生气泡反应速度适中,产生气泡反应速度适中,产生气泡反应比较慢,产生气泡反应比较慢,产生气泡酸能与金属反应 生活中我们都提倡使用铁锅炒菜。因为铁锅中有铁元素,如果在炒菜或煮东西时,加上醋,铁和酸反应,生成有铁离子的盐类,使铁元素更易融入菜中,人吃了饭菜就可以补充人体中的铁元素,可有效减少缺铁性贫血。有人做过试验,用铁锅炒洋葱,把油加热5分钟以后,洋葱里含铁量比原来提高一两倍。如果加上盐和醋后再同样加热5分钟,含铁量提高到原来的15到19倍。所以我们中国的铁锅可是世界有名的。... ...回归生活闻名于世的中国铁锅 酸能与金属铁反应,能否与铁锈反应?想一想砂纸温馨提示:
1、稀盐酸、稀硫酸具有一定的腐蚀性,使用时要十分小心,防止沾到皮肤上
2、如果不说明用量,液体取1-2ml为宜活动与探究 分别将生锈的铁钉放入稀盐酸和稀硫酸中,观察现象。 刚才同学们在实验中观察到实验现象归纳起来有两种:
1、开始时观察到铁锈逐渐消失,溶液由无色慢慢变成黄色 。这是为什么呢?加入的酸量不同!酸也是除锈专家 !2、开始时观察到铁锈逐渐消失,溶液由无色慢慢变成黄色,当铁锈消失以后,铁钉表面会冒出气泡。讨论:
1、利用上述反应清除金属制品表面的锈时,能否将金属制品长时间浸在酸中?为什么?
2、氧化铜能与稀硫酸发生化学反应吗?
为什么? 当长时间浸泡时,与铁锈反应剩余的酸就会继续与铁反应。 实验证明,氧化铜也能与酸反应。
请你写出氧化铜与盐酸或硫酸反应的化学方程式并归纳酸的性质:CuO+2HCl=CuCl2+H2O
CuO+H2SO4=CuSO4+H2O结论:酸能与金属氧化物反应有水生成酸能与金属氧化物反应复分解反应CuO + 2HClCuCl2+ H2O= 像这类由两种化合物相互交换成分,生成另外两种化合物的反应,叫做复分解反应+2-2+1-1+2-1+1-2双交换,价不变。相信你能理解四种基本反应类型:1、化合反应:2、分解反应:3、置换反应:4、复分解反应:相信你能归纳A + B = ABAB = A + BA + BC = AC + BAB + CD = AD + CB一、酸能使酸碱指示剂显示不同的颜色;二、酸能与多种活泼金属反应,生成氢气;三、酸能与某些金属氧化物反应,生成水。酸有一些相似的化学性质:盘点一下我们的收获吧!你还有什么收获?从个别推导到一般1、下列物质放入或通入水中能使紫色石蕊试液变红的是?(??)
A.Cu(OH)2 B.NaOH C.CO2 D.NaCl
2、下列金属与盐酸反应,剧烈程度排列顺序正确的是( )
A.Fe>Al>Mg>Zn B.Mg>Al>Zn>Fe
C.Mg>Fe>Al>Zn D.Zn>Fe>Mg>AlCB相信你能选择我也来试一把Al2O3 + 6HCl = 2AlCl3 + 3H2O
2Al + 6HCl = 2AlCl3 + 3H2 ↑
4、铝片(表面已氧化)和过量的稀盐酸反应的现象,
并用化学方程式解释为什么?答:一开始铝片的表面没有气泡冒出,一段时间后,有少量气泡冒出,后来反应越来越剧烈。Al2O3 + 6HCl = 2AlCl3 + 3H2O
2Al + 6HCl = 2AlCl3 + 3H2 ↑
3、铝片(表面已氧化)和过量的稀盐酸反应的现象,
并用化学方程式解释为什么?答:一开始铝片的表面没有气泡冒出,一段时间后,有少量气泡冒出,后来反应越来越剧烈。相信你能解释 4、实验室有两瓶失去标签的溶液可能是
稀硫酸和浓硫酸,你用那些方法区分它
们?并说出你的理由?相信你会鉴别
同课章节目录
