高中化学苏教版2019必修一 2.2.1 物质的量浓度 课件(19张PPT)
文档属性
| 名称 | 高中化学苏教版2019必修一 2.2.1 物质的量浓度 课件(19张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 547.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-27 21:13:57 | ||
图片预览





文档简介
(共19张PPT)
专题 2 研究物质的基本方法
第二单元 溶液组成的定量研究
第 1课时 物质的量浓度
1.了解物质的量浓度的含义、计算公式(重点)
2.学会配制一定物质的量浓度溶液的实验技能(重点)
3.物质的量浓度在化学反应计算中的应用(难点)
学习目标
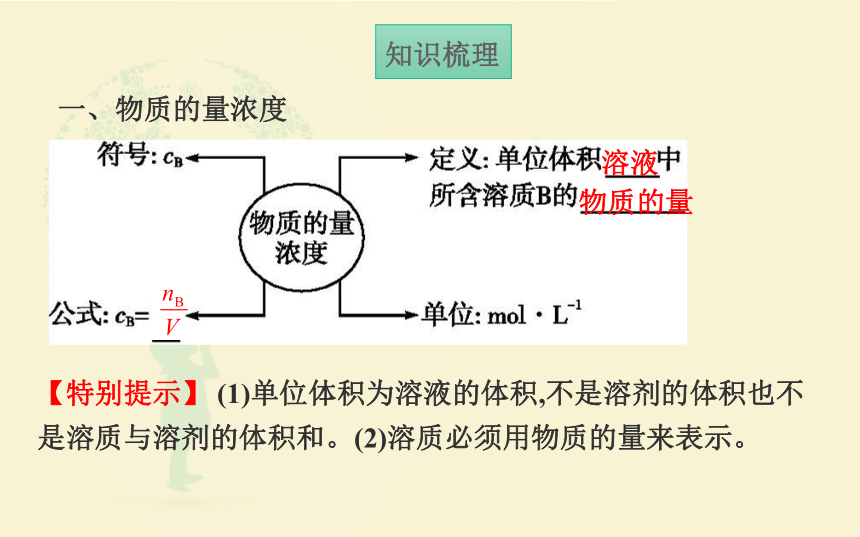
一、物质的量浓度
溶液
物质的量
【特别提示】 (1)单位体积为溶液的体积,不是溶剂的体积也不是溶质与溶剂的体积和。(2)溶质必须用物质的量来表示。
知识梳理
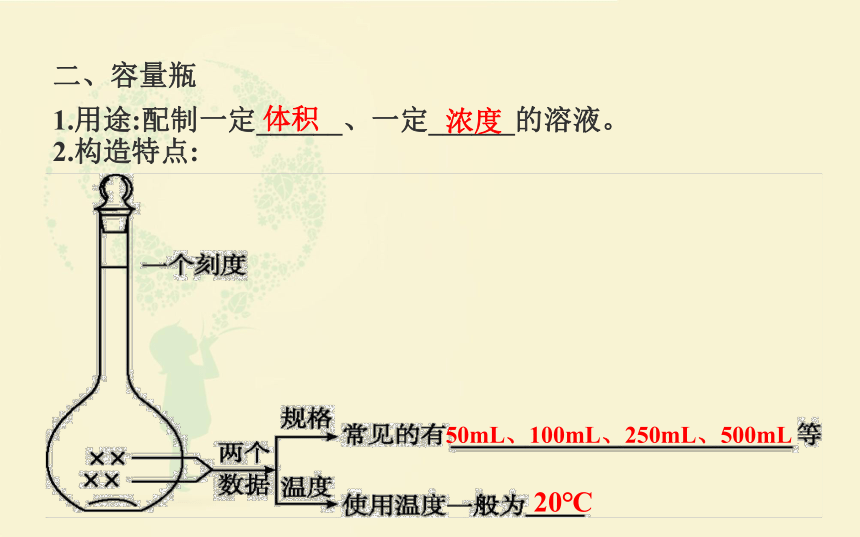
二、容量瓶
1.用途:配制一定______、一定______的溶液。
体积
浓度
2.构造特点:
50mL、100mL、250mL、500mL
20℃
3.读数:溶液的_______正好与刻度线_______时,容量瓶中溶液的体积即为容量瓶上所标记体积。
【思考1】 容量瓶使用前首先进行的操作是什么
提示:容量瓶使用前首先检查是否漏水。
三、一定物质的量浓度溶液的配制
以配制100 mL 0.100 mol·L-1 Na2CO3溶液为例
1.主要仪器
托盘天平、药匙、烧杯、玻璃棒、_____________、胶头滴管。
2.配制步骤
(1)计算:所需要Na2CO3固体的质量为 g。
(2)称量:用托盘天平准确称取Na2CO3固体。
凹液面
相切
100 mL容量瓶
1.1
(3)溶解:将Na2CO3固体转移至100 mL烧杯中,加适量蒸馏水溶解,并冷却至 。
(4)转移:用_______引流,将溶液转移到 中。
(5)洗涤:用蒸馏水洗涤 和 2~3次,将洗涤液全部转移到 中。轻轻振荡容量瓶,使溶液混合均匀。
(6)定容:先加蒸馏水至接近刻度线_______处,再改用________滴加蒸馏水至溶液凹液面正好与刻度线相切。
(7)摇匀:盖好瓶塞,反复 颠倒,使溶液混合均匀。
【思考2】 容量瓶用蒸馏水洗净后,不干燥是否可立即使用
提示:可以。容量瓶洗净后不需干燥,因为后面还要加蒸馏水定容。
室温
玻璃棒
100 mL容量瓶
烧杯内壁
玻璃棒
容量瓶
1~2 cm
胶头滴管
上下
有关物质的量浓度的计算要充分利用物质的量的四个基本公式:
2.已知标准状况下V L气体溶于1 L水后形成溶液,求cB
核心突破
(2)若已知溶液的密度为ρ(g·cm-3)
3.溶液稀释或混合时,求cB
(1)溶液稀释时溶质的物质的量不变
c1V1=c2V2(c1、c2为稀释前后溶液的物质的量浓度,V1、V2为稀释前后溶液的体积)。
(2)不同物质的量浓度溶液混合
不同浓度的溶液,溶质相同,其物质的量在混合前后不变,
c1V1+c2V2=c(混)·V(混)[c(混)为混合后溶液的物质的量浓度,V(混)为混合后溶液的体积]。
【特别提示】
(1)溶质可以是单质和化合物,也可以是离子或其他特定组合。
(2)带结晶水的物质作“溶质”时,溶质是不含结晶水的化合物,其物质的量的计算,用带结晶水的物质质量除以带结晶水的物质的摩尔质量即可。
1.1 mol·L-1硫酸溶液的含义是( )
A.1 L水中含有1 mol硫酸
B.1 L溶液中含1 mol H+
C.将98 g硫酸溶于1 L水所配成的溶液
D.1 L硫酸溶液中含有98 g H2SO4
课堂巩固
答案:D
解析:根据物质的量浓度的定义,A选项说法错误,不是1 L水,应该是1 L溶液;B选项,溶液的体积为1 L时含有 2 mol H+;C选项的错误仍在98 g H2SO4溶于1 L水,溶液的体积不清楚,故溶液的物质的量浓度也不清楚;D选项正确,因硫酸的相对分子质量为98,故98 g为1 mol。
2.用98%的浓H2SO4(ρ=1.84 g·mL-1)配制1 mol·L-1的稀H2SO4 100 mL,配制过程中可能用到下列仪器:①100 mL量筒 ②10 mL量筒 ③50 mL烧杯 ④托盘天平 ⑤100 mL 容量瓶 ⑥胶头滴管 ⑦玻璃棒。按使用时出现的先后顺序排列正确的是( )
A.②⑥③⑦⑤ B.④③⑤⑦⑥
C.①③⑦⑤⑥ D.②⑤⑦⑥
解析:浓溶液配稀溶液的过程为:①计算所需浓溶液体积:5.3 mL;②选用合适量筒量取浓溶液:10 mL量筒,并用胶头滴管滴加浓H2SO4到刻度线;③稀释浓H2SO4:将少量水放入50 mL烧杯中,沿玻璃棒缓缓将浓H2SO4注入水中;④将冷却至室温的稀溶液转移至100 mL容量瓶中;⑤定容。
答案:A
3.利用碳酸钠晶体(Na2CO3·10H2O)来配制0.5 mol·L-1的Na2CO3溶液1000mL,假如其他操作均是准确无误的,下列情况会引起配制溶液的浓度偏高的是( )
A.称取碳酸钠晶体100 g
B.定容时,俯视观察刻度线
C.移液时,对用于溶解碳酸钠晶体的烧杯没有进行冲洗
D.定容后,将容量瓶上下颠倒,摇匀,静置时发现液面低于刻度线,于是又加入少量水至刻度线
解析:本题考查一定物质的量浓度溶液的配制过程及误差分析。Na2CO3·10H2O的质量为286 g·mol-1×0.5 mol=143 g,所以A项应偏低;B项平视时,凹液面的最低点与刻度线刚好相平,俯视时液面的最低点低于刻度线,导致浓度偏高;C项对用于稀释或溶解的烧杯,如不数次加水冲洗并将洗涤液也转入容量瓶,会使溶质损失,使所配制的溶液浓度偏低;D项定容后,上下颠倒,摇匀,静置,发现液面低于刻度线,这是由于液体沾在瓶壁和磨口等处所致,不会造成偏差,若加水,则使所配溶液浓度偏低。
答案:B
4.某学生计划用12 mol·L-1的浓盐酸配制0.10 mol·L-1的稀盐酸450 mL。回答下列问题:
(1)量取浓盐酸的体积为 mL,应选用的量筒规格为
。
(2)配制时应选用的容量瓶规格为 。
(3)配制时(除容量瓶外)还需选用的仪器主要有 、
、 、 和试剂瓶。
解析:配制稀盐酸450 mL,由于没有此种规格的容量瓶,所以用500 mL的容量瓶。设量取浓盐酸的体积为V,根据稀释前后HCl物质的量守恒建立关系式:12 mol·L-1×V=0.10 mol·L-1×500 mL,V=4.2 mL;根据量筒的规格选取10 mL量筒;结合配制步骤选取仪器。
答案:(1)4.2 10 mL (2)500 mL (3)量筒 烧杯 玻璃棒 胶头滴管
本节内容结束
专题 2 研究物质的基本方法
第二单元 溶液组成的定量研究
第 1课时 物质的量浓度
1.了解物质的量浓度的含义、计算公式(重点)
2.学会配制一定物质的量浓度溶液的实验技能(重点)
3.物质的量浓度在化学反应计算中的应用(难点)
学习目标
一、物质的量浓度
溶液
物质的量
【特别提示】 (1)单位体积为溶液的体积,不是溶剂的体积也不是溶质与溶剂的体积和。(2)溶质必须用物质的量来表示。
知识梳理
二、容量瓶
1.用途:配制一定______、一定______的溶液。
体积
浓度
2.构造特点:
50mL、100mL、250mL、500mL
20℃
3.读数:溶液的_______正好与刻度线_______时,容量瓶中溶液的体积即为容量瓶上所标记体积。
【思考1】 容量瓶使用前首先进行的操作是什么
提示:容量瓶使用前首先检查是否漏水。
三、一定物质的量浓度溶液的配制
以配制100 mL 0.100 mol·L-1 Na2CO3溶液为例
1.主要仪器
托盘天平、药匙、烧杯、玻璃棒、_____________、胶头滴管。
2.配制步骤
(1)计算:所需要Na2CO3固体的质量为 g。
(2)称量:用托盘天平准确称取Na2CO3固体。
凹液面
相切
100 mL容量瓶
1.1
(3)溶解:将Na2CO3固体转移至100 mL烧杯中,加适量蒸馏水溶解,并冷却至 。
(4)转移:用_______引流,将溶液转移到 中。
(5)洗涤:用蒸馏水洗涤 和 2~3次,将洗涤液全部转移到 中。轻轻振荡容量瓶,使溶液混合均匀。
(6)定容:先加蒸馏水至接近刻度线_______处,再改用________滴加蒸馏水至溶液凹液面正好与刻度线相切。
(7)摇匀:盖好瓶塞,反复 颠倒,使溶液混合均匀。
【思考2】 容量瓶用蒸馏水洗净后,不干燥是否可立即使用
提示:可以。容量瓶洗净后不需干燥,因为后面还要加蒸馏水定容。
室温
玻璃棒
100 mL容量瓶
烧杯内壁
玻璃棒
容量瓶
1~2 cm
胶头滴管
上下
有关物质的量浓度的计算要充分利用物质的量的四个基本公式:
2.已知标准状况下V L气体溶于1 L水后形成溶液,求cB
核心突破
(2)若已知溶液的密度为ρ(g·cm-3)
3.溶液稀释或混合时,求cB
(1)溶液稀释时溶质的物质的量不变
c1V1=c2V2(c1、c2为稀释前后溶液的物质的量浓度,V1、V2为稀释前后溶液的体积)。
(2)不同物质的量浓度溶液混合
不同浓度的溶液,溶质相同,其物质的量在混合前后不变,
c1V1+c2V2=c(混)·V(混)[c(混)为混合后溶液的物质的量浓度,V(混)为混合后溶液的体积]。
【特别提示】
(1)溶质可以是单质和化合物,也可以是离子或其他特定组合。
(2)带结晶水的物质作“溶质”时,溶质是不含结晶水的化合物,其物质的量的计算,用带结晶水的物质质量除以带结晶水的物质的摩尔质量即可。
1.1 mol·L-1硫酸溶液的含义是( )
A.1 L水中含有1 mol硫酸
B.1 L溶液中含1 mol H+
C.将98 g硫酸溶于1 L水所配成的溶液
D.1 L硫酸溶液中含有98 g H2SO4
课堂巩固
答案:D
解析:根据物质的量浓度的定义,A选项说法错误,不是1 L水,应该是1 L溶液;B选项,溶液的体积为1 L时含有 2 mol H+;C选项的错误仍在98 g H2SO4溶于1 L水,溶液的体积不清楚,故溶液的物质的量浓度也不清楚;D选项正确,因硫酸的相对分子质量为98,故98 g为1 mol。
2.用98%的浓H2SO4(ρ=1.84 g·mL-1)配制1 mol·L-1的稀H2SO4 100 mL,配制过程中可能用到下列仪器:①100 mL量筒 ②10 mL量筒 ③50 mL烧杯 ④托盘天平 ⑤100 mL 容量瓶 ⑥胶头滴管 ⑦玻璃棒。按使用时出现的先后顺序排列正确的是( )
A.②⑥③⑦⑤ B.④③⑤⑦⑥
C.①③⑦⑤⑥ D.②⑤⑦⑥
解析:浓溶液配稀溶液的过程为:①计算所需浓溶液体积:5.3 mL;②选用合适量筒量取浓溶液:10 mL量筒,并用胶头滴管滴加浓H2SO4到刻度线;③稀释浓H2SO4:将少量水放入50 mL烧杯中,沿玻璃棒缓缓将浓H2SO4注入水中;④将冷却至室温的稀溶液转移至100 mL容量瓶中;⑤定容。
答案:A
3.利用碳酸钠晶体(Na2CO3·10H2O)来配制0.5 mol·L-1的Na2CO3溶液1000mL,假如其他操作均是准确无误的,下列情况会引起配制溶液的浓度偏高的是( )
A.称取碳酸钠晶体100 g
B.定容时,俯视观察刻度线
C.移液时,对用于溶解碳酸钠晶体的烧杯没有进行冲洗
D.定容后,将容量瓶上下颠倒,摇匀,静置时发现液面低于刻度线,于是又加入少量水至刻度线
解析:本题考查一定物质的量浓度溶液的配制过程及误差分析。Na2CO3·10H2O的质量为286 g·mol-1×0.5 mol=143 g,所以A项应偏低;B项平视时,凹液面的最低点与刻度线刚好相平,俯视时液面的最低点低于刻度线,导致浓度偏高;C项对用于稀释或溶解的烧杯,如不数次加水冲洗并将洗涤液也转入容量瓶,会使溶质损失,使所配制的溶液浓度偏低;D项定容后,上下颠倒,摇匀,静置,发现液面低于刻度线,这是由于液体沾在瓶壁和磨口等处所致,不会造成偏差,若加水,则使所配溶液浓度偏低。
答案:B
4.某学生计划用12 mol·L-1的浓盐酸配制0.10 mol·L-1的稀盐酸450 mL。回答下列问题:
(1)量取浓盐酸的体积为 mL,应选用的量筒规格为
。
(2)配制时应选用的容量瓶规格为 。
(3)配制时(除容量瓶外)还需选用的仪器主要有 、
、 、 和试剂瓶。
解析:配制稀盐酸450 mL,由于没有此种规格的容量瓶,所以用500 mL的容量瓶。设量取浓盐酸的体积为V,根据稀释前后HCl物质的量守恒建立关系式:12 mol·L-1×V=0.10 mol·L-1×500 mL,V=4.2 mL;根据量筒的规格选取10 mL量筒;结合配制步骤选取仪器。
答案:(1)4.2 10 mL (2)500 mL (3)量筒 烧杯 玻璃棒 胶头滴管
本节内容结束
