高中化学苏教版2019必修一 2.3.2 原子核外电子排布 课件(24张PPT)
文档属性
| 名称 | 高中化学苏教版2019必修一 2.3.2 原子核外电子排布 课件(24张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 466.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-27 00:00:00 | ||
图片预览






文档简介
(共24张PPT)
专题 2 研究物质的基本方法
第三单元 人类对原子结构的认识
第2课时 原子核外电子排布
学习目标
1.知道核外电子能量高低与分层排布的关系。
2.能够根据核外电子排布规律写出常见简单原子的原子结构示意图
原子构成
化学
元素
原子
旧知回顾
一、原子核外电子的排布
根据所给的一些数据请你总结电子运动的特征
①核外电子的质量:9.10×10-31kg
②炮弹的速度2km/s,人造卫星7.8 km/s,宇宙飞船11 km/s;氢核外电子2.2×108m/s
③原子核半径:10-15——10-14m;
原子半径:约10-10m
1.核外电子运动特征
新知梳理
电子的质量很小,体积也很小;电子所占据的运动空间相对于原子核的体积却很大(绝对空间也很小);电子在核 外做高速(光速)运动。
2.电子的能量
(1)在多电子原子里,电子的能量不同。
(2)在离核较近的区域内运动的电子能量较低,在离核较远的区域内运动的电子能量较高。
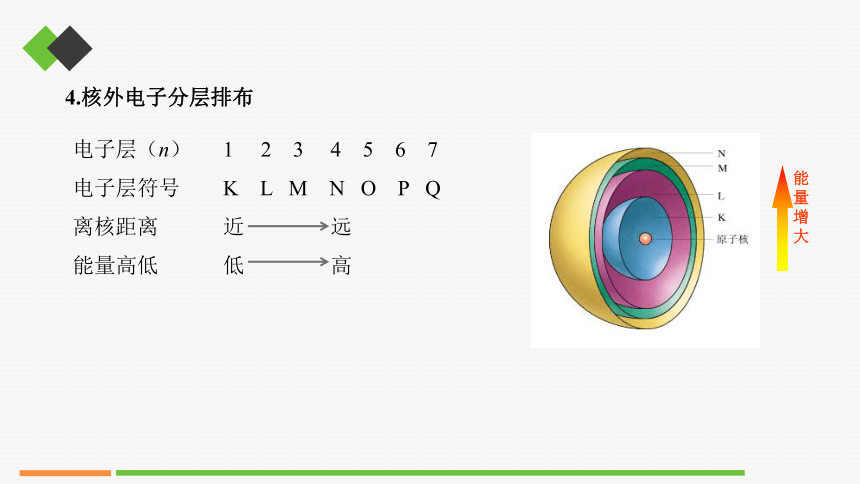
3.电子层
(1)定义:在含有多个电子的原子里,电子分别在能量不同的区域内运动,我们把不同的区域简化为不连续的壳层,称作电子层。
电子层(n) 1 2 3 4 5 6 7
电子层符号 K L M N O P Q
离核距离 近 远
能量高低 低 高
4.核外电子分层排布
能
量
增
大
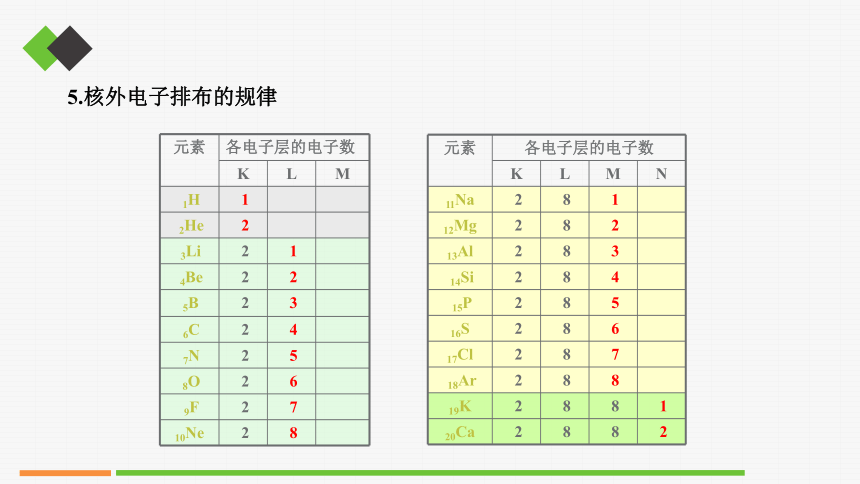
元素 各电子层的电子数 K L M
1H 1
2He 2
3Li 2 1
4Be 2 2
5B 2 3
6C 2 4
7N 2 5
8O 2 6
9F 2 7
10Ne 2 8
元素 各电子层的电子数 K L M N
11Na 2 8 1
12Mg 2 8 2
13Al 2 8 3
14Si 2 8 4
15P 2 8 5
16S 2 8 6
17Cl 2 8 7
18Ar 2 8 8
19K 2 8 8 1
20Ca 2 8 8 2
5.核外电子排布的规律
核电 荷数 元素 名称 元素 符号 各电子层的电子数 K L M N O P
2 氦 He 2
10 氖 Ne 2 8
18 氩 Ar 2 8 8
36 氪 Kr 2 8 18 8
54 氙 Xe 2 8 18 18 8
86 氡 Rn 2 8 18 32 18 8
电子在原子核外距核由近到远、能量由低到高的不同电子层分层排布
电子一般总是尽先排布在能量最低的电子层里,即最先排在第一层,当第一层排满后,再排满第二层……
各层最多能容纳2n2(n为电子层数)
最外层电子数不超过8个(K层为最外层时,电子数不超过2);次外层电子数不超过18,倒数第三层电子数不超过32
6.原子结构示意图
7.离子结构示意图
8.元素性质与核外电子排布关系
+11
2
8
1
Na
失去1个电子
+11
2
8
Na+
Na表现出金属性
+16
2
8
6
S
得到2个电子
S表现出非金属性
S2-
+16
2
8
8
(1)最外层电子数为1的原子有:
(2)最外层电子数为2的原子有:
(3)最外层电子数跟次外层电子数相等的原子有:
(4)最外层电子数是次外层电子数2倍的原子是:
(5)最外层电子数是次外层电子数3倍的原子是:
1.依据核电荷数1~18号的元素的核外电子排布特点,完成下列问题
H、Li、Na
He、Be、Mg
Be、Ar
C
O
当堂练习
(6)最外层电子数是次外层电子数4倍的原子是:
(7)次外层电子数是最外层电子数2倍的原子有:
(8)内层电子总数是最外层电子数2倍的原子有:
(9)电子层数跟最外层电子数相等的原子有:
(10)电子层数是最外层电子数2倍的原子是:
(11)最外层电子数是电子层数2倍的原子有:
(12)最外层电子数是电子层数3倍的原子是:
(13)原子核中无中子的原子是:
Ne
Li、Si
Li、P
H、Be、Al
Li
He、C、S
O
2.核电荷数为1~18的元素中,下列叙述正确的是( )
A.最外层只有1个电子的元素一定是金属元素
B.最外层只有2个电子的元素一定是金属元素
C.原子核外各层电子数相等的元素不一定是金属元素
D.核电荷数为17的元素容易获得1个电子
D
3.下列说法中正确的是( )
A.锂的原子结构示意图是 。
B.原子核外电子离核越近,能量越高。
C.某原子L层为K层的3倍,该原子为O。
D.某原子M层电子数为L层电子数的4倍。
C
4.判断下列示意图是否正确?为什么?
寻找“10电子”微粒和“18电子”微粒的方法
(1)“10电子”微粒
规律总结
(2)“18电子”微粒
(9电子微粒×2)—F、—OH、
—NH2、—CH3
CH3—CH3、H2N—NH2、HO—OH、F—F、F—CH3、CH3—OH……
5.今有 结构示意图,试指出x的可能数值及相应微粒符号,并画出该微粒的结构示意图。
X值
微粒符号
结构示意图
9
10
11
12
13
F-
Ne
Na+
Mg2+
Al3+
+9
2
8
+11
2
8
+10
2
8
+12
2
8
+13
2
8
6. A元素原子的L层比B元素原子的L层少3个电子,B原子核外电子总数比A原子核外电子总数多5个,则A与B形成的化合物的化学式为( )
A. A2B3 B. BA2 C. AB4 D.B3A2
D
本节内容结束
专题 2 研究物质的基本方法
第三单元 人类对原子结构的认识
第2课时 原子核外电子排布
学习目标
1.知道核外电子能量高低与分层排布的关系。
2.能够根据核外电子排布规律写出常见简单原子的原子结构示意图
原子构成
化学
元素
原子
旧知回顾
一、原子核外电子的排布
根据所给的一些数据请你总结电子运动的特征
①核外电子的质量:9.10×10-31kg
②炮弹的速度2km/s,人造卫星7.8 km/s,宇宙飞船11 km/s;氢核外电子2.2×108m/s
③原子核半径:10-15——10-14m;
原子半径:约10-10m
1.核外电子运动特征
新知梳理
电子的质量很小,体积也很小;电子所占据的运动空间相对于原子核的体积却很大(绝对空间也很小);电子在核 外做高速(光速)运动。
2.电子的能量
(1)在多电子原子里,电子的能量不同。
(2)在离核较近的区域内运动的电子能量较低,在离核较远的区域内运动的电子能量较高。
3.电子层
(1)定义:在含有多个电子的原子里,电子分别在能量不同的区域内运动,我们把不同的区域简化为不连续的壳层,称作电子层。
电子层(n) 1 2 3 4 5 6 7
电子层符号 K L M N O P Q
离核距离 近 远
能量高低 低 高
4.核外电子分层排布
能
量
增
大
元素 各电子层的电子数 K L M
1H 1
2He 2
3Li 2 1
4Be 2 2
5B 2 3
6C 2 4
7N 2 5
8O 2 6
9F 2 7
10Ne 2 8
元素 各电子层的电子数 K L M N
11Na 2 8 1
12Mg 2 8 2
13Al 2 8 3
14Si 2 8 4
15P 2 8 5
16S 2 8 6
17Cl 2 8 7
18Ar 2 8 8
19K 2 8 8 1
20Ca 2 8 8 2
5.核外电子排布的规律
核电 荷数 元素 名称 元素 符号 各电子层的电子数 K L M N O P
2 氦 He 2
10 氖 Ne 2 8
18 氩 Ar 2 8 8
36 氪 Kr 2 8 18 8
54 氙 Xe 2 8 18 18 8
86 氡 Rn 2 8 18 32 18 8
电子在原子核外距核由近到远、能量由低到高的不同电子层分层排布
电子一般总是尽先排布在能量最低的电子层里,即最先排在第一层,当第一层排满后,再排满第二层……
各层最多能容纳2n2(n为电子层数)
最外层电子数不超过8个(K层为最外层时,电子数不超过2);次外层电子数不超过18,倒数第三层电子数不超过32
6.原子结构示意图
7.离子结构示意图
8.元素性质与核外电子排布关系
+11
2
8
1
Na
失去1个电子
+11
2
8
Na+
Na表现出金属性
+16
2
8
6
S
得到2个电子
S表现出非金属性
S2-
+16
2
8
8
(1)最外层电子数为1的原子有:
(2)最外层电子数为2的原子有:
(3)最外层电子数跟次外层电子数相等的原子有:
(4)最外层电子数是次外层电子数2倍的原子是:
(5)最外层电子数是次外层电子数3倍的原子是:
1.依据核电荷数1~18号的元素的核外电子排布特点,完成下列问题
H、Li、Na
He、Be、Mg
Be、Ar
C
O
当堂练习
(6)最外层电子数是次外层电子数4倍的原子是:
(7)次外层电子数是最外层电子数2倍的原子有:
(8)内层电子总数是最外层电子数2倍的原子有:
(9)电子层数跟最外层电子数相等的原子有:
(10)电子层数是最外层电子数2倍的原子是:
(11)最外层电子数是电子层数2倍的原子有:
(12)最外层电子数是电子层数3倍的原子是:
(13)原子核中无中子的原子是:
Ne
Li、Si
Li、P
H、Be、Al
Li
He、C、S
O
2.核电荷数为1~18的元素中,下列叙述正确的是( )
A.最外层只有1个电子的元素一定是金属元素
B.最外层只有2个电子的元素一定是金属元素
C.原子核外各层电子数相等的元素不一定是金属元素
D.核电荷数为17的元素容易获得1个电子
D
3.下列说法中正确的是( )
A.锂的原子结构示意图是 。
B.原子核外电子离核越近,能量越高。
C.某原子L层为K层的3倍,该原子为O。
D.某原子M层电子数为L层电子数的4倍。
C
4.判断下列示意图是否正确?为什么?
寻找“10电子”微粒和“18电子”微粒的方法
(1)“10电子”微粒
规律总结
(2)“18电子”微粒
(9电子微粒×2)—F、—OH、
—NH2、—CH3
CH3—CH3、H2N—NH2、HO—OH、F—F、F—CH3、CH3—OH……
5.今有 结构示意图,试指出x的可能数值及相应微粒符号,并画出该微粒的结构示意图。
X值
微粒符号
结构示意图
9
10
11
12
13
F-
Ne
Na+
Mg2+
Al3+
+9
2
8
+11
2
8
+10
2
8
+12
2
8
+13
2
8
6. A元素原子的L层比B元素原子的L层少3个电子,B原子核外电子总数比A原子核外电子总数多5个,则A与B形成的化合物的化学式为( )
A. A2B3 B. BA2 C. AB4 D.B3A2
D
本节内容结束
