高中化学苏教版2019必修一 1.2.1 物质的量 课件(29张PPT)
文档属性
| 名称 | 高中化学苏教版2019必修一 1.2.1 物质的量 课件(29张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 597.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-27 21:30:09 | ||
图片预览






文档简介
(共29张PPT)
专题1 物质的分类及计量
第二单元 物质的化学计量
第1课时 物质的量
新课导入
曹冲称象原理
思考2
已知托盘天平的最小刻度为0.1g,你能用它称量出一粒大米的质量吗?若不能,你有什么方法吗?
指导思想:聚小成多、聚微为宏
方法:取100粒,称其质量,除以100,得一粒大米质量
思考1
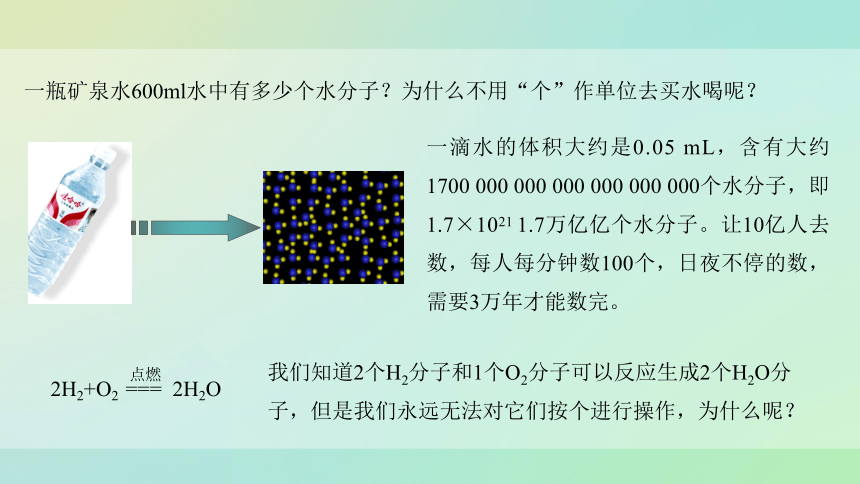
一瓶矿泉水600ml水中有多少个水分子?为什么不用“个”作单位去买水喝呢?
2H2+O2 === 2H2O
点燃
一滴水的体积大约是0.05 mL,含有大约1700 000 000 000 000 000 000个水分子,即1.7×1021 1.7万亿亿个水分子。让10亿人去数,每人每分钟数100个,日夜不停的数,需要3万年才能数完。
我们知道2个H2分子和1个O2分子可以反应生成2个H2O分子,但是我们永远无法对它们按个进行操作,为什么呢?
因此,我们为了研究微观粒子的 方便,必须引入一个新的物理量
——物质的量
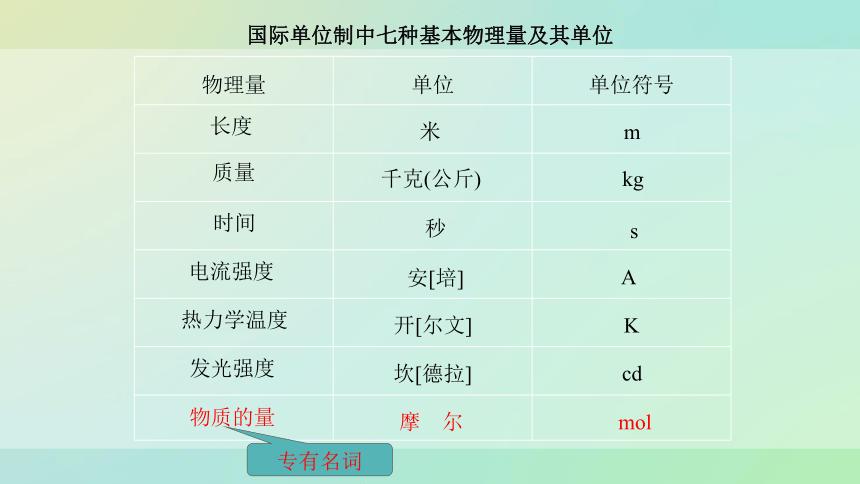
它是国际单位制中的七大基本物理量之一
国际单位制中七种基本物理量及其单位
物理量 单位 单位符号
长度
质量
时间
电流强度
热力学温度
物质的量
发光强度
米
m
千克(公斤)
kg
秒
s
安[培]
A
开[尔文]
K
cd
坎[德拉]
摩 尔
mol
专有名词
一、物质的量
1. 概念:
表示一定数目微粒集合体的物理量
2. 符号:n
单位:摩尔(mol),简称:摩
知识梳理
3. 强调:
①物理量:国际单位制中的基本物理量之一
②专有名称,四个字是一个整体,不能说成:物质的质量,物质的数量或物质量等
③摩尔是单位,不是物理量,它与米、秒、克一样
④计量对象:微观粒子(如分子、原子、离子、质子、中子、电子等)及它们的特定组合(如NaCl),不能用于计量宏观物体,如1mol人、0.5mol大米等。
⑤使用物质的量时,用化学式指明微粒的种类,而不能用名称表示,如1molH,不能写成1mol氢
1. 下列叙述正确的是( )
A、物质的量就是物质的质量
B、物质的量指物质的数量
C、物质的量是国际单位制中的一个基本物理量
D、物质的量是描述物质多少的单位
C
2. 判断下列说法是否正确?
×
1mol小米( )
1molH2 ( )
1mol氧( )
1molH2O ( )
1molNa+ ( )
×
√
√
√
练习
一双筷子有两根,
一打铅笔有12个,
那么1摩尔粒子规定为多少比较合适呢?
规定:
1mol某种微粒集合体中所含的微粒数与0.012kgC-12中所含的原子数相同。
阿伏加德罗对此贡献很大,为了纪念他,又把0.012kgC-12中所含的原子数称为阿伏加德罗常数。
那么, 0.012kgC-12中所含的原子数又究竟含有多少个呢?
已知一个C-12原子的质量为1.993×10-26 kg
答案:6.02×1023个(是个约数)
二、阿伏加德罗常数
1. 定义: 0.012kgC-12中所含的原子数称为阿伏加德罗常数
2. 符号:NA,单位: mol-1
3. 近似值:6.02×1023 mol-1
4. 1mol某种微粒集合体中所含的微粒数与0.012kgC-12中所含的原子数相同
总结: 1mol微粒数 = 0.012kgC-12中所含的原子数
= 阿伏加德罗常数个
≈ 6.02×1023
体会:阿伏加德罗常数有多大!!!
1mol大米:全球60亿人口,每人每天吃500g,可供全球吃14万年
1mol硬币:可往返太阳-地球240.8亿次
强调:1. 计量对象:微观粒子及它们的特定组合, 而不能用于计量宏观物体;
2. 6.02×1023为约数。
1. 判断下列说法的正误,错误的要说明原因。
①摩尔是物质的量的单位,是国际基本物理量之一。
②0.012kgC-12所含的原子数精确值是6.02×1023
③物质的量就是物质的质量
④物质的量就是物质所含微粒数目的多少
⑤阿伏加德罗常数就是6.02×1023mol-1
⑥摩尔是表示物质粒子数目多少的物理量
⑦物质的量的单位是摩尔,它只适用于原子、分子或离子
⑧ 1 mol任何物质都含有约6.02×1023个分子
⑨ 1 mol水中含有2 mol氢和1 mol氧
【即使练习】
×
×
×
×
×
×
×
×
×
2. 下列说法正确的是 ( )
6.02×1023个鸡蛋为1mol鸡蛋 B. 6.02×1023个氧为1mol O2
C.1molNa+中约含有6.02×1023个Na+ D.1mol硫酸溶液
3. 下列关于阿伏加德罗常数的说法正确的是 ( )
A.阿伏加德罗常数是12g碳中所含的碳原子数
B.阿伏加德罗常数是 0.012kgC-12中所含的原子数
C.阿伏加德罗常数是6.02×1023 mol-1
D.阿伏加德罗常数的符号为NA,近似值为6.02×1023 mol-1
C
D
1 mol 任何粒子的粒子数为NA个 。
(1)1mol碳原子含有 个碳原子
(2)0.3mol硫酸分子含有 个硫酸分子
(3)10mol钠离子含有 个钠离子
(4)6mol电子含有 个电子
(5)0.5mol中子含有 个中子
物质的量n、阿伏加德罗常数NA 、粒子数N之间有怎样的关系呢?
1×NA
0.3×NA
10×NA
6×NA
0.5×NA
三、物质的量(n)、阿伏加德罗常数(NA)与微粒数(N)之间的关系:
N
n = ——
NA
变形:
N = n× NA
N
NA = ——
n
或
1.(1)在0.5molO2中含有的氧分子数目是多少?
解:O2的分子数为
N = n × NA= 0.5 mol× 6.02 ×1023mol-1= 3.01 × 1023
答:O2的分子数为3.01 × 1023个。
(2)1.204×1024个H2O,其物质的量是多少?
解:H2O的物质的量为
NA
N
n=
= 2 mol
答:1.204×1024个H2O,其物质的量是2mol。
6.02 ×1023mol-1
1.204×1024
=
【即使练习】
分析: H2O-----2H-----O
2.(1)1mol H2O中多少mol H,多少mol O?
2
1
3×6.02×1023
结论:粒子之间的个数之比等于物质的量之比。
1 2 1
NA 2NA NA
1mol 2mol 1mol
=
3. 3.01×1023个P4中含有多少摩尔磷原子?
解:P4的物质的量为
NA
N
n=
磷原子的物质的量为:0.5mol×4=2mol
答: 3.01×1023个P4中含有2mol磷原子。
6.02 ×1023mol-1
3.01×1023
=0.5mol
4. 在0.5molO2中含有的电子数目是多少?
解:O2的电子数为
N = n ×16 × NA
= 0.5 mol×16× 6.02 ×1023mol-1
= 4.816 × 1024
答: 0.5molO2的电子数为4.816 × 1024个。
1mol分子、原子、离子等含有的微粒数目相同(NA个)
但由于不同微粒的质量有差异
1mol不同物质的质量通常也不相同
我们把单位物质的量(即1mol)的物质所具有的质量称为该物质的摩尔质量
微粒总质量= 一个微粒质量×微粒数目
四、摩尔质量
1. 概念:单位物质的量的物质所具有的质量
2. 符号:M 单位:g/mol或g·mol-1
3. 强调:
①当物质的质量以克为单位时,摩尔质量在数值上等于该物质的相对原子质量(即原子量)或相对分子质量(即分子量)
②摩尔质量是物质本身的性质,不会随温度、压强、数量、质量等的改变而改变,如无论1gH2还是2kgH2,其摩尔质量都是2g/mol
五、物质的量(n)、摩尔质量(M)与物质的质量(m)之间的关系:
m
n = ——
M
变形:
m = n× M
m
M = ——
n
或
【即使练习】
(1)Na的摩尔质量___________
(2)NaCl的摩尔质量__________
(3)NaHCO3的相对分子质量是_______,它的摩尔质量为__________
(4)0.01mol某物质的质量为1.08克,此物质的摩尔质量为____________
23g/mol
58.5g/mol
84g/mol
84
108g/mol
(5)9.8g H2SO4的物质的量_____________;
(6)5.3g Na2CO3的物质的量____________;
(7)0.25mol CaCO3的质量_____________;
(8)2.0mol H2O的质量________________。
0.1mol
0.05mol
25g
36g
六、物质的量的应用
m
= ——
M
N
n = ——
NA
【即时练习】
(1)已知水的质量为54克,则此水中所含的水分子数目为______________个
(2)3.01×1023个H2分子,其质量为_____ 克
1.806×1024
1
七、有关化学方程 式
2H2 + O2 === 2H2O
数目 2个 1个 2个
×NA 2NA NA 2 NA
物质的量 2mol 1mol 2mol
分子量 2 32 18
摩尔质量 2g/mol 32g/mol 18g/mol
质量 4g 32g 36g
1. 物质的量是联系微观“个数”与宏观“质量”的桥梁纽带
2. 化学方程式表示了反应物和生成物之间物质的量的关系,化学计量数之比等于其物质的量之比。
课堂小结
本节内容结束
专题1 物质的分类及计量
第二单元 物质的化学计量
第1课时 物质的量
新课导入
曹冲称象原理
思考2
已知托盘天平的最小刻度为0.1g,你能用它称量出一粒大米的质量吗?若不能,你有什么方法吗?
指导思想:聚小成多、聚微为宏
方法:取100粒,称其质量,除以100,得一粒大米质量
思考1
一瓶矿泉水600ml水中有多少个水分子?为什么不用“个”作单位去买水喝呢?
2H2+O2 === 2H2O
点燃
一滴水的体积大约是0.05 mL,含有大约1700 000 000 000 000 000 000个水分子,即1.7×1021 1.7万亿亿个水分子。让10亿人去数,每人每分钟数100个,日夜不停的数,需要3万年才能数完。
我们知道2个H2分子和1个O2分子可以反应生成2个H2O分子,但是我们永远无法对它们按个进行操作,为什么呢?
因此,我们为了研究微观粒子的 方便,必须引入一个新的物理量
——物质的量
它是国际单位制中的七大基本物理量之一
国际单位制中七种基本物理量及其单位
物理量 单位 单位符号
长度
质量
时间
电流强度
热力学温度
物质的量
发光强度
米
m
千克(公斤)
kg
秒
s
安[培]
A
开[尔文]
K
cd
坎[德拉]
摩 尔
mol
专有名词
一、物质的量
1. 概念:
表示一定数目微粒集合体的物理量
2. 符号:n
单位:摩尔(mol),简称:摩
知识梳理
3. 强调:
①物理量:国际单位制中的基本物理量之一
②专有名称,四个字是一个整体,不能说成:物质的质量,物质的数量或物质量等
③摩尔是单位,不是物理量,它与米、秒、克一样
④计量对象:微观粒子(如分子、原子、离子、质子、中子、电子等)及它们的特定组合(如NaCl),不能用于计量宏观物体,如1mol人、0.5mol大米等。
⑤使用物质的量时,用化学式指明微粒的种类,而不能用名称表示,如1molH,不能写成1mol氢
1. 下列叙述正确的是( )
A、物质的量就是物质的质量
B、物质的量指物质的数量
C、物质的量是国际单位制中的一个基本物理量
D、物质的量是描述物质多少的单位
C
2. 判断下列说法是否正确?
×
1mol小米( )
1molH2 ( )
1mol氧( )
1molH2O ( )
1molNa+ ( )
×
√
√
√
练习
一双筷子有两根,
一打铅笔有12个,
那么1摩尔粒子规定为多少比较合适呢?
规定:
1mol某种微粒集合体中所含的微粒数与0.012kgC-12中所含的原子数相同。
阿伏加德罗对此贡献很大,为了纪念他,又把0.012kgC-12中所含的原子数称为阿伏加德罗常数。
那么, 0.012kgC-12中所含的原子数又究竟含有多少个呢?
已知一个C-12原子的质量为1.993×10-26 kg
答案:6.02×1023个(是个约数)
二、阿伏加德罗常数
1. 定义: 0.012kgC-12中所含的原子数称为阿伏加德罗常数
2. 符号:NA,单位: mol-1
3. 近似值:6.02×1023 mol-1
4. 1mol某种微粒集合体中所含的微粒数与0.012kgC-12中所含的原子数相同
总结: 1mol微粒数 = 0.012kgC-12中所含的原子数
= 阿伏加德罗常数个
≈ 6.02×1023
体会:阿伏加德罗常数有多大!!!
1mol大米:全球60亿人口,每人每天吃500g,可供全球吃14万年
1mol硬币:可往返太阳-地球240.8亿次
强调:1. 计量对象:微观粒子及它们的特定组合, 而不能用于计量宏观物体;
2. 6.02×1023为约数。
1. 判断下列说法的正误,错误的要说明原因。
①摩尔是物质的量的单位,是国际基本物理量之一。
②0.012kgC-12所含的原子数精确值是6.02×1023
③物质的量就是物质的质量
④物质的量就是物质所含微粒数目的多少
⑤阿伏加德罗常数就是6.02×1023mol-1
⑥摩尔是表示物质粒子数目多少的物理量
⑦物质的量的单位是摩尔,它只适用于原子、分子或离子
⑧ 1 mol任何物质都含有约6.02×1023个分子
⑨ 1 mol水中含有2 mol氢和1 mol氧
【即使练习】
×
×
×
×
×
×
×
×
×
2. 下列说法正确的是 ( )
6.02×1023个鸡蛋为1mol鸡蛋 B. 6.02×1023个氧为1mol O2
C.1molNa+中约含有6.02×1023个Na+ D.1mol硫酸溶液
3. 下列关于阿伏加德罗常数的说法正确的是 ( )
A.阿伏加德罗常数是12g碳中所含的碳原子数
B.阿伏加德罗常数是 0.012kgC-12中所含的原子数
C.阿伏加德罗常数是6.02×1023 mol-1
D.阿伏加德罗常数的符号为NA,近似值为6.02×1023 mol-1
C
D
1 mol 任何粒子的粒子数为NA个 。
(1)1mol碳原子含有 个碳原子
(2)0.3mol硫酸分子含有 个硫酸分子
(3)10mol钠离子含有 个钠离子
(4)6mol电子含有 个电子
(5)0.5mol中子含有 个中子
物质的量n、阿伏加德罗常数NA 、粒子数N之间有怎样的关系呢?
1×NA
0.3×NA
10×NA
6×NA
0.5×NA
三、物质的量(n)、阿伏加德罗常数(NA)与微粒数(N)之间的关系:
N
n = ——
NA
变形:
N = n× NA
N
NA = ——
n
或
1.(1)在0.5molO2中含有的氧分子数目是多少?
解:O2的分子数为
N = n × NA= 0.5 mol× 6.02 ×1023mol-1= 3.01 × 1023
答:O2的分子数为3.01 × 1023个。
(2)1.204×1024个H2O,其物质的量是多少?
解:H2O的物质的量为
NA
N
n=
= 2 mol
答:1.204×1024个H2O,其物质的量是2mol。
6.02 ×1023mol-1
1.204×1024
=
【即使练习】
分析: H2O-----2H-----O
2.(1)1mol H2O中多少mol H,多少mol O?
2
1
3×6.02×1023
结论:粒子之间的个数之比等于物质的量之比。
1 2 1
NA 2NA NA
1mol 2mol 1mol
=
3. 3.01×1023个P4中含有多少摩尔磷原子?
解:P4的物质的量为
NA
N
n=
磷原子的物质的量为:0.5mol×4=2mol
答: 3.01×1023个P4中含有2mol磷原子。
6.02 ×1023mol-1
3.01×1023
=0.5mol
4. 在0.5molO2中含有的电子数目是多少?
解:O2的电子数为
N = n ×16 × NA
= 0.5 mol×16× 6.02 ×1023mol-1
= 4.816 × 1024
答: 0.5molO2的电子数为4.816 × 1024个。
1mol分子、原子、离子等含有的微粒数目相同(NA个)
但由于不同微粒的质量有差异
1mol不同物质的质量通常也不相同
我们把单位物质的量(即1mol)的物质所具有的质量称为该物质的摩尔质量
微粒总质量= 一个微粒质量×微粒数目
四、摩尔质量
1. 概念:单位物质的量的物质所具有的质量
2. 符号:M 单位:g/mol或g·mol-1
3. 强调:
①当物质的质量以克为单位时,摩尔质量在数值上等于该物质的相对原子质量(即原子量)或相对分子质量(即分子量)
②摩尔质量是物质本身的性质,不会随温度、压强、数量、质量等的改变而改变,如无论1gH2还是2kgH2,其摩尔质量都是2g/mol
五、物质的量(n)、摩尔质量(M)与物质的质量(m)之间的关系:
m
n = ——
M
变形:
m = n× M
m
M = ——
n
或
【即使练习】
(1)Na的摩尔质量___________
(2)NaCl的摩尔质量__________
(3)NaHCO3的相对分子质量是_______,它的摩尔质量为__________
(4)0.01mol某物质的质量为1.08克,此物质的摩尔质量为____________
23g/mol
58.5g/mol
84g/mol
84
108g/mol
(5)9.8g H2SO4的物质的量_____________;
(6)5.3g Na2CO3的物质的量____________;
(7)0.25mol CaCO3的质量_____________;
(8)2.0mol H2O的质量________________。
0.1mol
0.05mol
25g
36g
六、物质的量的应用
m
= ——
M
N
n = ——
NA
【即时练习】
(1)已知水的质量为54克,则此水中所含的水分子数目为______________个
(2)3.01×1023个H2分子,其质量为_____ 克
1.806×1024
1
七、有关化学方程 式
2H2 + O2 === 2H2O
数目 2个 1个 2个
×NA 2NA NA 2 NA
物质的量 2mol 1mol 2mol
分子量 2 32 18
摩尔质量 2g/mol 32g/mol 18g/mol
质量 4g 32g 36g
1. 物质的量是联系微观“个数”与宏观“质量”的桥梁纽带
2. 化学方程式表示了反应物和生成物之间物质的量的关系,化学计量数之比等于其物质的量之比。
课堂小结
本节内容结束
