高中化学苏教版(2019)必修一 1.2.2 气体摩尔体积 课件(32张PPT)
文档属性
| 名称 | 高中化学苏教版(2019)必修一 1.2.2 气体摩尔体积 课件(32张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 896.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-27 21:19:23 | ||
图片预览








文档简介
(共32张PPT)
专题1 物质的分类及计量
第二单元 物质的化学计量
第2课时 气体摩尔体积
1. 了解物质的聚集状态
2. 认识决定物质体积的因素
3. 掌握气体摩尔体积的概念
学习目标
一、物质的聚集状态
物质的三态
液态(liquid)
气态(gas)
固态(solid) 晶体(crystal)、非晶态物质(amorphous material)
知识梳理
晶体——具有规则的几何外形和固定的溶点。
如 氯化钠 NaCl 方解石CaCO3 萤石CaF2
熔点: 801℃ 强热分解 1402℃
非晶态物质——没有固定熔点和规则的几何外形。
石蜡:12~18个碳的碳氢化合物,易燃,没有固定熔点
玻璃 :二氧化硅、硅酸钙,硅酸钠的混合物,无固定熔沸点
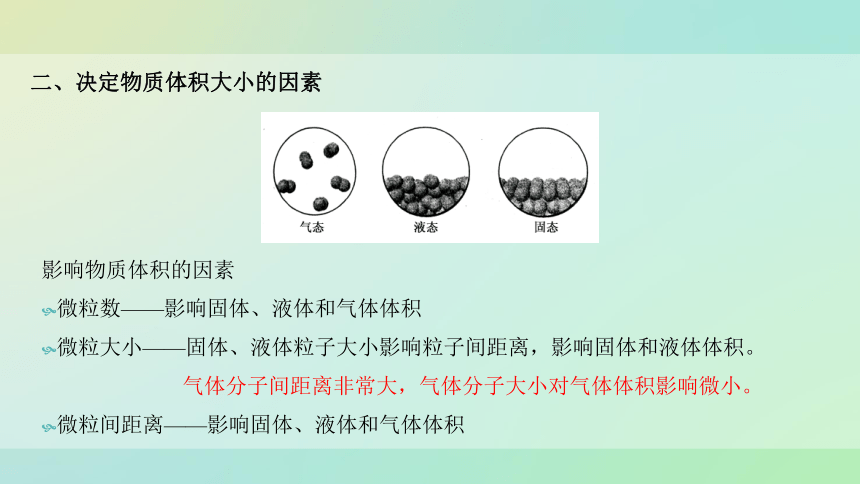
二、决定物质体积大小的因素
影响物质体积的因素
微粒数——影响固体、液体和气体体积
微粒大小——固体、液体粒子大小影响粒子间距离,影响固体和液体体积。
气体分子间距离非常大,气体分子大小对气体体积影响微小。
微粒间距离——影响固体、液体和气体体积
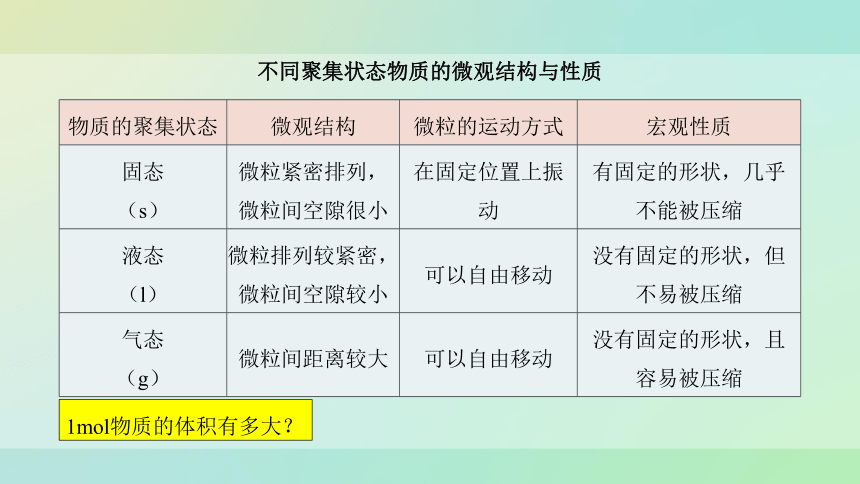
不同聚集状态物质的微观结构与性质
物质的聚集状态 微观结构 微粒的运动方式 宏观性质
固态 (s) 微粒紧密排列,微粒间空隙很小 在固定位置上振动 有固定的形状,几乎不能被压缩
液态 (l) 微粒排列较紧密,微粒间空隙较小 可以自由移动 没有固定的形状,但不易被压缩
气态 (g) 微粒间距离较大 可以自由移动 没有固定的形状,且容易被压缩
1mol物质的体积有多大?
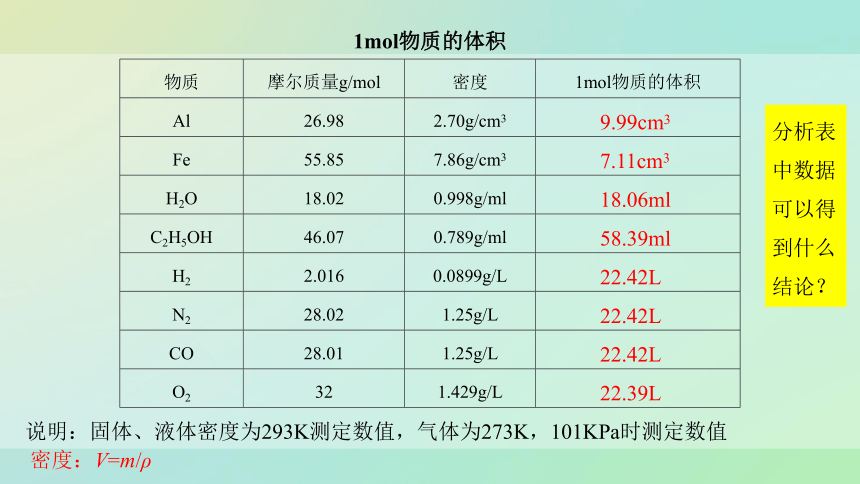
1mol物质的体积
物质 摩尔质量g/mol 密度 1mol物质的体积
Al 26.98 2.70g/cm3
Fe 55.85 7.86g/cm3
H2O 18.02 0.998g/ml
C2H5OH 46.07 0.789g/ml
H2 2.016 0.0899g/L
N2 28.02 1.25g/L
CO 28.01 1.25g/L
O2 32 1.429g/L
9.99cm3
7.11cm3
18.06ml
58.39ml
22.42L
22.42L
22.42L
22.39L
说明:固体、液体密度为293K测定数值,气体为273K,101KPa时测定数值
密度:V=m/ρ
分析表中数据可以得到什么结论?
分析表中数据得到结论
1.1mol不同固态或液态物质,体积不同。
2.在相同条件下,1mol不同气体物质体积基本相同。
不同状态的物质,体积大小跟哪些因素有关呢?
首先我们来分析1mol固态和液态物质体积为什么不同。
固态结构微粒间的距离很小
液态结构微粒间的距离也小
影响1mol固体和液体物质体积的因素有哪些?
粒子数目
粒子间距
粒子大小
7.2cm3
1mol铁
10cm3
1mol铝
18.3cm3
1mol铅
固体物质
1mol固体或液体的体积只与构成这种物质的粒子大小有关,由于不同物质微粒大小不相等,所以不同固体或液体的体积不同
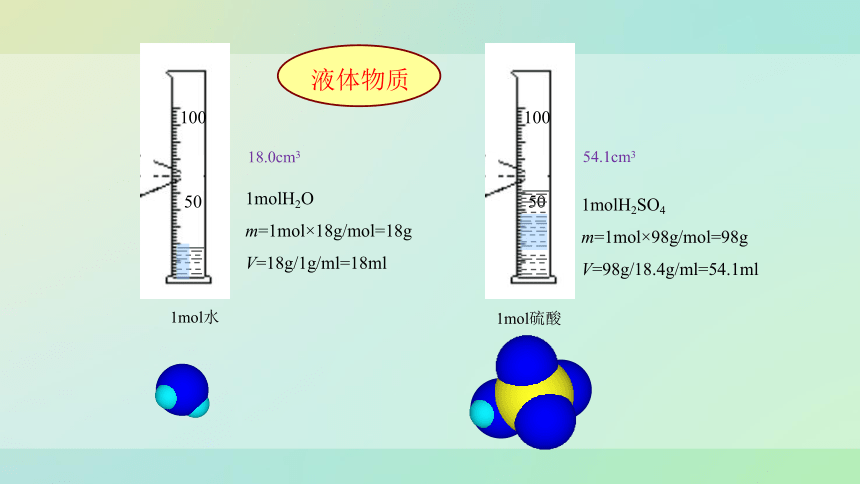
1mol水
18.0cm3
54.1cm3
1mol硫酸
100
50
100
50
液体物质
1molH2O
m=1mol×18g/mol=18g
V=18g/1g/ml=18ml
1molH2SO4
m=1mol×98g/mol=98g
V=98g/18.4g/ml=54.1ml
下面我们来分析1mol不同气态物质在相同条件下体积为什么基本相同。
首先我们来研究水的汽化
100℃H2O(g)
3.06×104mL
1mol
约1700倍
原因:由液态到气态,粒子间距显著增大。
100
50
18.0mL
1mol H2O(l)
结论:温度升高,体积增大,温度降低,体积减小
原因:温度升高,粒子间距增大,温度降低,粒子间距减小。
现在我们来分析一下温度和压强对气体体积的影响
结论:压强增大,体积减小,压强减小,体积增大
原因:压强增大,粒子间距减小,压强减小,粒子间距增大。
影响气体体积的因素
1. 气体分子间距离——温度和压强
2. 气体分子平均距离是分子直径的10倍左右,气体分子大小可做忽略处理
3. 气体分子数
影响1mol不同气体体积的因素是什么
粒子数目 粒子间距 粒子大小
受温度和压强影响
影响1mol物质体积大小的因素
1.微粒的大小
2.微粒间的距离
固体、液体体积
气体体积
决定
如果温度和压强一定,微粒间平均距离一定,体积也就一定。
受温度和压强影响
决定
三、气体的摩尔体积
条件:标准状况(STP) 0℃、 1.01×105 Pa
对象:1mol任何气体,可以是单一纯净的气体,也可以是混合气体。
体积约为22.4L
6.02×1023分子
标态下的气体摩尔体积
标况下,1mol任何气体的体积都约为22.4L,与气体的种类无关,与是否为混合气体无关
2. 在同温同压下,相同体积的任何气体,其粒子数 ;
3. 在同温同压下,相同粒子数的任何气体,其体积 ;
4. 在同温同压下,任何气体体积的大小与分子数目成 比。
(相同,但不一定是22.4L)
相同
正
1. 在一定温度和压强下,并不一定是标准状况,1mol任何气体体积是否相同?
相同
【练习】
气体摩尔体积
同温同压下,相同体积的任何气体具有相同的体积——阿伏伽德罗定律
定义:单位物质的量的气体所占的体积。
符号:Vm
单位:L/mol或m3/mol等
公式:Vm= ——
标准状况下,Vm=22.4 L/mol
V
n
填写下列空白:
(1)标况下,0.5molH2占有的体积是 L
(2)标况下, 2molO2占有的体积是 L
(3)标况下,4.48LCO2的物质的量是 mol
(4)标况下,33.6LH2 的物质的量是 mol
(5)标况下,16gO2 的体积为 L
(6)标况下, 11.2LN2 中含有N2分子的个数是
11.2
44.8
0.2
1.5
11.2
3.01×1023个
【练习】
气体的摩尔体积考查常见干扰点
1. 非标况下使用22.4L/mol或者不标明状态
2. 描述对象是气态物质,注意标况下非气态物质干扰
3. 气体体积与是否为混合气体无关
4. 注意除分子数外,温度和压强共同决定气体体积,所以非标况下气体的摩尔体积也可能为22.4L/mol
5. 同温同压不一定是标况
【练习】
1. 标准状况下,1mol任何物质的体积都约是22.4L。
2. 1mol气体的体积约为22.4L。
3. 标准状况下,1molO2和N2混合气体的体积约为22.4L。
(错,物质应是气体)
(错,应标明条件-标准状况)
(对,气体体积与分子种类无关)
(错,未指明气体体积是否在相同条件下测定)
4. 22.4L气体所含分子数一定大于11.2L气体所含的分子数。
5. 只有在标准状况下,气体的摩尔体积才可能约为22.4L/mol。
(错,不一定)
6. 标况下,18gH2O的体积为22.4L。
(错,标况下H2O不为气态)
【总结】
1. 若考查题目中出现物质体积,先考虑是否为气体,如果是气体再考虑是否为标况。
2. 常见标况下是液体或固体的物质:CCl4、H2O、SO3、苯、酒精、CHCl3、己烷、辛烷等。
3. 一定温度和压强下,气体体积大小只与气体分子数有关,与气体分子种类和是否为混合气体无关。
4. 气体的摩尔体积不一定只有在标况下才为22.4L/mol。
1. 影响物质体积的因素:微粒大小、微粒间距离、微粒数。
2. 影响气体体积的因素:气体分子数、分子间距离。
3. 影响气体分子间距离因素:温度、压强。
4. 标况下气体摩尔体积公式 。
5. 进行气体摩尔体积计算时需要注意
条件:标准况状 0℃ 101kPa
对象:所有气体,既可以为纯净气体也可以为混合气体
课堂小结
1. 一定能够影响物质体积的因素有( )
A.微粒数目 B.分子间距离
C.微粒大小不同 D.物质粒子的质量
A
当堂检测
2. 关于O2气体叙述正确的是( )
A.O2摩尔体积为22.4L
B.常温常压下1molO2的体积为22.4L
C.标况下22.4LO2的质量为32g
D.NA个O2分子的体积为22.4L
C
【解析】气体的摩尔体积只有在标况下才是22.4L/mol,A、B错;标况下22.4L为1mol,质量为1mol×32g/mol=32g,C正确;D项D.NA个O2分子为1mol,标况下为22.4L,D错。
3. 下列叙述正确的是( )
A.标况下,22.4L己烷含有的分子数为NA
B.常温常压下,28gCO和N2混合气体体积为22.4L
C.1molFe与足量盐酸反应生成22.4LH2
D.标况下,22.4LH2和O2混合气体所含的分子数为NA
D
【解析】己烷标况下为液态,A错;B项非标况,体积不一定为22.4L,B错;C项没有注明状况,错;D项,气体体积与气体分子种类无关,与是否为混合气体无关,D正确。
4. 下列两种气体的分子数一定相等的是( )
A.等温、等压的SO2和O2
B.等温等体积的N2和O2
C.等压等体积的H2和CO2
D.等质量的N2和CO
D
【解析】同温同压下,相同体积的任何气体具有相同的分子数,“三同定一同”,A、B、C只有“两个同”,不能确定分子数是否相等,错;D项N2和CO的摩尔质量都是24g/mol,质量相同时物质的量相同,分子数相等,D正确。
5. 同温同压下,质量相同的下列气体体积最大的是( )
A.O2 B.Cl2 C.SO2 D. CH4
D
V1
V2
n1
n2
【解析】由 ,n=m/M可得,同温同压下,质量相同时,V与M成反比,O2 32g/mol,Cl271g/mol,SO264g/mol,CH416g/mol,D项正确
本节内容结束
专题1 物质的分类及计量
第二单元 物质的化学计量
第2课时 气体摩尔体积
1. 了解物质的聚集状态
2. 认识决定物质体积的因素
3. 掌握气体摩尔体积的概念
学习目标
一、物质的聚集状态
物质的三态
液态(liquid)
气态(gas)
固态(solid) 晶体(crystal)、非晶态物质(amorphous material)
知识梳理
晶体——具有规则的几何外形和固定的溶点。
如 氯化钠 NaCl 方解石CaCO3 萤石CaF2
熔点: 801℃ 强热分解 1402℃
非晶态物质——没有固定熔点和规则的几何外形。
石蜡:12~18个碳的碳氢化合物,易燃,没有固定熔点
玻璃 :二氧化硅、硅酸钙,硅酸钠的混合物,无固定熔沸点
二、决定物质体积大小的因素
影响物质体积的因素
微粒数——影响固体、液体和气体体积
微粒大小——固体、液体粒子大小影响粒子间距离,影响固体和液体体积。
气体分子间距离非常大,气体分子大小对气体体积影响微小。
微粒间距离——影响固体、液体和气体体积
不同聚集状态物质的微观结构与性质
物质的聚集状态 微观结构 微粒的运动方式 宏观性质
固态 (s) 微粒紧密排列,微粒间空隙很小 在固定位置上振动 有固定的形状,几乎不能被压缩
液态 (l) 微粒排列较紧密,微粒间空隙较小 可以自由移动 没有固定的形状,但不易被压缩
气态 (g) 微粒间距离较大 可以自由移动 没有固定的形状,且容易被压缩
1mol物质的体积有多大?
1mol物质的体积
物质 摩尔质量g/mol 密度 1mol物质的体积
Al 26.98 2.70g/cm3
Fe 55.85 7.86g/cm3
H2O 18.02 0.998g/ml
C2H5OH 46.07 0.789g/ml
H2 2.016 0.0899g/L
N2 28.02 1.25g/L
CO 28.01 1.25g/L
O2 32 1.429g/L
9.99cm3
7.11cm3
18.06ml
58.39ml
22.42L
22.42L
22.42L
22.39L
说明:固体、液体密度为293K测定数值,气体为273K,101KPa时测定数值
密度:V=m/ρ
分析表中数据可以得到什么结论?
分析表中数据得到结论
1.1mol不同固态或液态物质,体积不同。
2.在相同条件下,1mol不同气体物质体积基本相同。
不同状态的物质,体积大小跟哪些因素有关呢?
首先我们来分析1mol固态和液态物质体积为什么不同。
固态结构微粒间的距离很小
液态结构微粒间的距离也小
影响1mol固体和液体物质体积的因素有哪些?
粒子数目
粒子间距
粒子大小
7.2cm3
1mol铁
10cm3
1mol铝
18.3cm3
1mol铅
固体物质
1mol固体或液体的体积只与构成这种物质的粒子大小有关,由于不同物质微粒大小不相等,所以不同固体或液体的体积不同
1mol水
18.0cm3
54.1cm3
1mol硫酸
100
50
100
50
液体物质
1molH2O
m=1mol×18g/mol=18g
V=18g/1g/ml=18ml
1molH2SO4
m=1mol×98g/mol=98g
V=98g/18.4g/ml=54.1ml
下面我们来分析1mol不同气态物质在相同条件下体积为什么基本相同。
首先我们来研究水的汽化
100℃H2O(g)
3.06×104mL
1mol
约1700倍
原因:由液态到气态,粒子间距显著增大。
100
50
18.0mL
1mol H2O(l)
结论:温度升高,体积增大,温度降低,体积减小
原因:温度升高,粒子间距增大,温度降低,粒子间距减小。
现在我们来分析一下温度和压强对气体体积的影响
结论:压强增大,体积减小,压强减小,体积增大
原因:压强增大,粒子间距减小,压强减小,粒子间距增大。
影响气体体积的因素
1. 气体分子间距离——温度和压强
2. 气体分子平均距离是分子直径的10倍左右,气体分子大小可做忽略处理
3. 气体分子数
影响1mol不同气体体积的因素是什么
粒子数目 粒子间距 粒子大小
受温度和压强影响
影响1mol物质体积大小的因素
1.微粒的大小
2.微粒间的距离
固体、液体体积
气体体积
决定
如果温度和压强一定,微粒间平均距离一定,体积也就一定。
受温度和压强影响
决定
三、气体的摩尔体积
条件:标准状况(STP) 0℃、 1.01×105 Pa
对象:1mol任何气体,可以是单一纯净的气体,也可以是混合气体。
体积约为22.4L
6.02×1023分子
标态下的气体摩尔体积
标况下,1mol任何气体的体积都约为22.4L,与气体的种类无关,与是否为混合气体无关
2. 在同温同压下,相同体积的任何气体,其粒子数 ;
3. 在同温同压下,相同粒子数的任何气体,其体积 ;
4. 在同温同压下,任何气体体积的大小与分子数目成 比。
(相同,但不一定是22.4L)
相同
正
1. 在一定温度和压强下,并不一定是标准状况,1mol任何气体体积是否相同?
相同
【练习】
气体摩尔体积
同温同压下,相同体积的任何气体具有相同的体积——阿伏伽德罗定律
定义:单位物质的量的气体所占的体积。
符号:Vm
单位:L/mol或m3/mol等
公式:Vm= ——
标准状况下,Vm=22.4 L/mol
V
n
填写下列空白:
(1)标况下,0.5molH2占有的体积是 L
(2)标况下, 2molO2占有的体积是 L
(3)标况下,4.48LCO2的物质的量是 mol
(4)标况下,33.6LH2 的物质的量是 mol
(5)标况下,16gO2 的体积为 L
(6)标况下, 11.2LN2 中含有N2分子的个数是
11.2
44.8
0.2
1.5
11.2
3.01×1023个
【练习】
气体的摩尔体积考查常见干扰点
1. 非标况下使用22.4L/mol或者不标明状态
2. 描述对象是气态物质,注意标况下非气态物质干扰
3. 气体体积与是否为混合气体无关
4. 注意除分子数外,温度和压强共同决定气体体积,所以非标况下气体的摩尔体积也可能为22.4L/mol
5. 同温同压不一定是标况
【练习】
1. 标准状况下,1mol任何物质的体积都约是22.4L。
2. 1mol气体的体积约为22.4L。
3. 标准状况下,1molO2和N2混合气体的体积约为22.4L。
(错,物质应是气体)
(错,应标明条件-标准状况)
(对,气体体积与分子种类无关)
(错,未指明气体体积是否在相同条件下测定)
4. 22.4L气体所含分子数一定大于11.2L气体所含的分子数。
5. 只有在标准状况下,气体的摩尔体积才可能约为22.4L/mol。
(错,不一定)
6. 标况下,18gH2O的体积为22.4L。
(错,标况下H2O不为气态)
【总结】
1. 若考查题目中出现物质体积,先考虑是否为气体,如果是气体再考虑是否为标况。
2. 常见标况下是液体或固体的物质:CCl4、H2O、SO3、苯、酒精、CHCl3、己烷、辛烷等。
3. 一定温度和压强下,气体体积大小只与气体分子数有关,与气体分子种类和是否为混合气体无关。
4. 气体的摩尔体积不一定只有在标况下才为22.4L/mol。
1. 影响物质体积的因素:微粒大小、微粒间距离、微粒数。
2. 影响气体体积的因素:气体分子数、分子间距离。
3. 影响气体分子间距离因素:温度、压强。
4. 标况下气体摩尔体积公式 。
5. 进行气体摩尔体积计算时需要注意
条件:标准况状 0℃ 101kPa
对象:所有气体,既可以为纯净气体也可以为混合气体
课堂小结
1. 一定能够影响物质体积的因素有( )
A.微粒数目 B.分子间距离
C.微粒大小不同 D.物质粒子的质量
A
当堂检测
2. 关于O2气体叙述正确的是( )
A.O2摩尔体积为22.4L
B.常温常压下1molO2的体积为22.4L
C.标况下22.4LO2的质量为32g
D.NA个O2分子的体积为22.4L
C
【解析】气体的摩尔体积只有在标况下才是22.4L/mol,A、B错;标况下22.4L为1mol,质量为1mol×32g/mol=32g,C正确;D项D.NA个O2分子为1mol,标况下为22.4L,D错。
3. 下列叙述正确的是( )
A.标况下,22.4L己烷含有的分子数为NA
B.常温常压下,28gCO和N2混合气体体积为22.4L
C.1molFe与足量盐酸反应生成22.4LH2
D.标况下,22.4LH2和O2混合气体所含的分子数为NA
D
【解析】己烷标况下为液态,A错;B项非标况,体积不一定为22.4L,B错;C项没有注明状况,错;D项,气体体积与气体分子种类无关,与是否为混合气体无关,D正确。
4. 下列两种气体的分子数一定相等的是( )
A.等温、等压的SO2和O2
B.等温等体积的N2和O2
C.等压等体积的H2和CO2
D.等质量的N2和CO
D
【解析】同温同压下,相同体积的任何气体具有相同的分子数,“三同定一同”,A、B、C只有“两个同”,不能确定分子数是否相等,错;D项N2和CO的摩尔质量都是24g/mol,质量相同时物质的量相同,分子数相等,D正确。
5. 同温同压下,质量相同的下列气体体积最大的是( )
A.O2 B.Cl2 C.SO2 D. CH4
D
V1
V2
n1
n2
【解析】由 ,n=m/M可得,同温同压下,质量相同时,V与M成反比,O2 32g/mol,Cl271g/mol,SO264g/mol,CH416g/mol,D项正确
本节内容结束
