沪教版(全国)化学九年级上册课课练:基础实验4 常见金属的性质(word版有答案)
文档属性
| 名称 | 沪教版(全国)化学九年级上册课课练:基础实验4 常见金属的性质(word版有答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 191.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-28 15:05:58 | ||
图片预览


文档简介
基础实验4
常见金属的性质
一、选择题
1.[2020·南京] 下列金属中,熔点最高的是 ( )
A.铜 B.汞 C.钨 D.铝
2.黄铜是铜与锌的合金。下列关于黄铜的说法正确的是 ( )
A.比纯铜耐腐蚀 B.加热不与空气反应
C.硬度小于纯铜 D.可以完全溶解在稀盐酸中
3.把一枚无锈铁钉放在硫酸铜溶液中,一段时间后,观察到的现象是 ( )
A.溶液蓝色变浅直至变为无色 B.铁钉表面析出红色物质
C.产生大量气泡 D.溶液质量增加
4.纳米铁粉在空气中不易自燃,但稍加热即可剧烈燃烧,如所示是纳米铁粉在锥形瓶中燃烧的实验。下列说法不正确的是( )
A. 纳米铁粉燃烧的化学方程式为3Fe+2O2Fe3O4
B.水可防止生成物溅落炸裂瓶底
C.激光手电照射使纳米铁粉的着火点降低
D.气球先膨胀后变瘪
5.下列现象、分析或结论正确的是 ( )
A.铜片表面有气泡产生 B.盛有镁片的试管外壁发烫
C.反应后试管中液体都呈无色 D.该实验不能比较铁、铜、镁的活动性
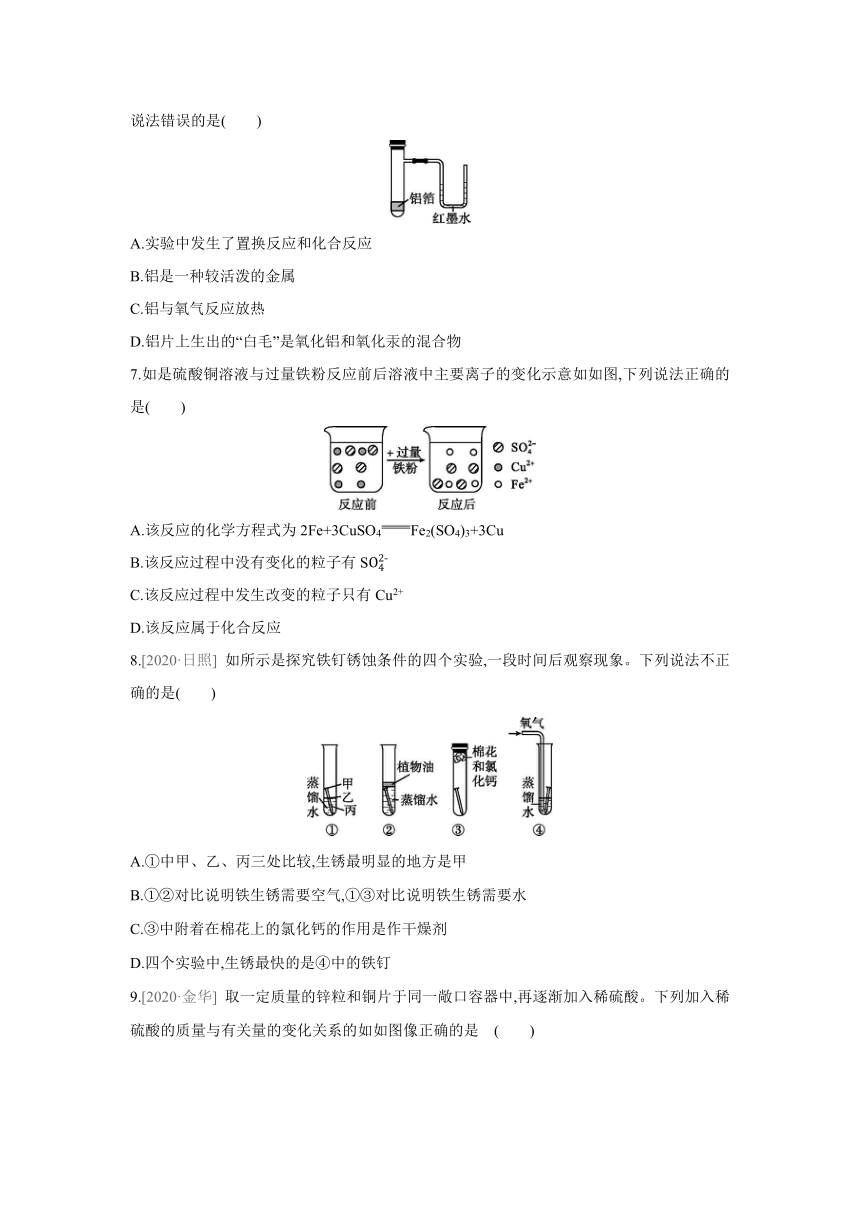
6.常温下,铝易与空气中的氧气反应生成一层致密的氧化铝薄膜,该氧化膜使内部的铝不再与氧气反应,硝酸汞[Hg(NO3)2]溶液可穿透致密的氧化铝薄膜,与铝反应生成汞,而汞的存在使铝表面的氧化膜疏松。用一张铝箔紧紧包裹在试管外壁(如),将试管浸入硝酸汞溶液中,片刻后取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨右侧水柱上升。根据实验现象判断下列说法错误的是( )
A.实验中发生了置换反应和化合反应
B.铝是一种较活泼的金属
C.铝与氧气反应放热
D.铝片上生出的“白毛”是氧化铝和氧化汞的混合物
7.如是硫酸铜溶液与过量铁粉反应前后溶液中主要离子的变化示意如如图,下列说法正确的是( )
A.该反应的化学方程式为2Fe+3CuSO4Fe2(SO4)3+3Cu
B.该反应过程中没有变化的粒子有S
C.该反应过程中发生改变的粒子只有Cu2+
D.该反应属于化合反应
8.[2020·日照] 如所示是探究铁钉锈蚀条件的四个实验,一段时间后观察现象。下列说法不正确的是( )
A.①中甲、乙、丙三处比较,生锈最明显的地方是甲
B.①②对比说明铁生锈需要空气,①③对比说明铁生锈需要水
C.③中附着在棉花上的氯化钙的作用是作干燥剂
D.四个实验中,生锈最快的是④中的铁钉
9.[2020·金华] 取一定质量的锌粒和铜片于同一敞口容器中,再逐渐加入稀硫酸。下列加入稀硫酸的质量与有关量的变化关系的如如图像正确的是 ( )
二、填空题
10.通过观察和实验的方法可获知物质的性质,从物质的状态、颜色、温度变化、有无沉淀或气体生成等方面可寻找物质发生变化的证据,分析各种证据能加深对物质变化和变化规律的认识。
(1)将锌粒放入稀硫酸中,锌粒表面产生气泡,反应的化学方程式为 。
(2)经引燃的铁丝在氧气中可以燃烧。支持铁和氧气发生化学反应的最主要证据是 。
11.[2020·青岛] 近年来,我国高铁飞速发展,已成为世界上唯一高铁成网运行的国家。请回答下列问题。
(1)制造高铁列车使用了多种材料。下列高铁列车的部件中,其主要材料属于金属材料的是
(填字母)。
A.玻璃车窗 B.镁铝合金车体
C.塑料小桌板 D.涤纶座套
(2)高铁电路多用铜质导线,这是利用了铜的延展性和 性。
(3)高铁刹车片由合金锻钢制作,时速300 km以上的列车紧急制动时,轮毂盘面和刹车片的温度瞬间达到700 ℃以上,合金锻钢应该具备耐磨和 等特性。
(4)建造高铁需要消耗大量的铝、铁等金属。工业炼铁的原理是氧化铁(Fe2O3)和一氧化碳在高温条件下反应,其化学方程式为 。
(5)车身表面烤漆不仅美观,还能起到防锈的作用。其防锈的原理是 。
(6)目前世界上已有50%以上的铁得到了回收利用。回收利用废旧金属的社会意义是
(写出一条即可)。
12.如所示,在已调平的托盘天平两边各放一只等质量的烧杯,再向烧杯中各倒入质量相等、质量分数也相等的稀硫酸,然后在左盘的烧杯中放入锌粉,同时在右盘的烧杯中放入等质量的铁粉。两只烧杯中都可以观察到的现象是 。完全反应后,观察到天平左、右两只烧杯中的金属粉末均无剩余,最终天平指针的指向是 (填“偏左”“中央”或“偏右”)。
附|加|题
13.将等质量的镁和铁分别放入等质量、相同浓度的稀盐酸中,产生氢气的质量和反应时间的关系如所示,下列说法错误的是 ( )
A. O~t1时段,产生氢气的质量镁比铁大
B.O~t2时段,参加反应的镁的质量与铁相等
C.反应结束后镁一定有剩余
D.反应消耗盐酸的总质量一定相等
14.已知:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O;二氧化硫具有与二氧化碳相似的化学性质,能与水反应生成酸;氢氧化钠溶液能吸收二氧化硫。为探究铜和浓硫酸的反应,某同学设计如所示实验(如如图中脱脂棉团蘸有紫色石蕊试液,石蕊遇酸变红)。关于该实验的说法错误的是 ( )
A. 与鼓气球相连接的导管需插入浓硫酸中
B.该装置便于控制铜和浓硫酸反应的发生和停止
C.铜丝绕成螺旋状是为了增大铜和浓硫酸的接触面积
D.实验中可观察到脱脂棉团变红
答案
1.C 由金属的物理性质可知,熔点最高的金属是钨。
2.A 黄铜是铜与锌的合金,铜、锌在加热条件下均能与空气中的氧气反应;铜不与稀盐酸反应,黄铜不能完全溶解在稀盐酸中。
3.B 铁能与硫酸铜溶液反应生成硫酸亚铁溶液和铜,溶液由蓝色变为浅绿色,铁钉表面析出红色物质;根据化学方程式,每56份质量的铁可置换出64份质量的铜,固体质量增加,溶液质量减少。
4.C 着火点是物质的固有属性,一般不能改变;纳米铁粉燃烧放出大量的热,锥形瓶内的气体受热膨胀,压强增大,气球膨胀,由于氧气被消耗,装置冷却后,压强变小,气球变瘪。
5.B 铜与盐酸不反应;金属与酸的反应属于放热反应;铁与盐酸反应生成氯化亚铁,溶液呈浅绿色;铜与盐酸不反应,铁和镁与盐酸反应的剧烈程度不同,通过这些现象可判断三种金属的活动性顺序。
6.D 从铝的氧化以及铝与硝酸汞的反应可知铝片上生成的“白毛”是氧化铝,汞的化学性质不活泼,“白毛”不可能是氧化汞。
7.B 铁与硫酸铜溶液反应生成硫酸亚铁溶液和铜,由硫酸铜溶液与过量铁粉反应前后溶液中主要离子变化示意如如图可知,铁与硫酸铜溶液发生反应中变化的微观粒子是铁原子和铜离子,硫酸根离子没有变。
8.A ①中甲、乙、丙三处比较,生锈最明显的地方是乙,乙处铁钉最易与氧气、水充分接触;一段时间后,①中的铁钉生锈,②和③中的铁钉没有生锈,对比①②可知道铁生锈需要空气,对比①③可知铁生锈需要水;氯化钙具有吸水性,③中附着在棉花上的氯化钙的作用是作干燥剂;④中铁钉接触到的是纯氧气,四个实验中,生锈最快的是④中的铁钉。
9.C 铜与硫酸不反应,随着稀硫酸的加入,铜片的质量不变;锌和稀硫酸反应生成硫酸锌和氢气,随着稀硫酸的加入,锌粒不断减少到完全反应;锌和稀硫酸反应生成硫酸锌和氢气,随着稀硫酸的不断加入,氢气的质量与硫酸锌的质量不断增加,当锌完全消耗后,氢气的质量不再改变,硫酸锌的质量不再改变。
10.(1)Zn+H2SO4ZnSO4+H2↑
(2)有黑色固体生成
11.(1)B (2)导电
(3)熔点高
(4)Fe2O3+3CO2Fe+3CO2
(5)隔绝氧气和水
(6)减少环境污染(合理即可)
(3)为防止制动时产生高温损坏刹车片,合金锻钢需要具备耐磨和熔点高等特性。(4)氧化铁和一氧化碳在高温条件下发生反应生成铁和二氧化碳,反应的化学方程式为Fe2O3+3CO2Fe+3CO2。(5)汽车车身表面的烤漆能隔绝氧气和水,从而使铁不易生锈。(6)回收利用废旧金属能减少环境污染,保护金属资源。
12.有气泡产生 偏左
锌和铁都会与稀硫酸反应产生氢气,故都会观察到有气泡产生。金属的质量相等,酸足量,则最终金属全部参加反应,锌产生的氢气的质量小于铁产生的氢气的质量,故最终加锌粉的这边质量大,天平指针偏向左边。
13.B O~t1时段,由如如图像可以看出产生氢气的质量镁比铁大;根据镁、铁和盐酸反应的化学方程式和镁、铁的相对原子质量可知,产生等质量的氢气,消耗铁的质量比镁大,在O~t2时段,产生氢气的质量相等,因此参加反应的镁的质量小于铁,又因为加入金属的质量相等,所以反应结束后镁一定有剩余;根据质量守恒定律,产生氢气的质量等于氯化氢中氢元素的质量,由于两种金属生成氢气的质量相等且盐酸浓度相同,因此反应消耗盐酸的总质量一定相等。
14.A 鼓气是为了使反应生成的二氧化硫全部导出,与鼓气球相连接的导管不能插入浓硫酸中;通过上下移动粗铜丝能使铜和浓硫酸随时接触或分离,从而控制反应随时发生或停止;铜丝绕成螺旋状是为了增大反应物的接触面积,从而加快铜和浓硫酸的反应;二氧化硫能和紫色石蕊试液中的水反应生成酸,使蘸有石蕊试液的脱脂棉团变红。
常见金属的性质
一、选择题
1.[2020·南京] 下列金属中,熔点最高的是 ( )
A.铜 B.汞 C.钨 D.铝
2.黄铜是铜与锌的合金。下列关于黄铜的说法正确的是 ( )
A.比纯铜耐腐蚀 B.加热不与空气反应
C.硬度小于纯铜 D.可以完全溶解在稀盐酸中
3.把一枚无锈铁钉放在硫酸铜溶液中,一段时间后,观察到的现象是 ( )
A.溶液蓝色变浅直至变为无色 B.铁钉表面析出红色物质
C.产生大量气泡 D.溶液质量增加
4.纳米铁粉在空气中不易自燃,但稍加热即可剧烈燃烧,如所示是纳米铁粉在锥形瓶中燃烧的实验。下列说法不正确的是( )
A. 纳米铁粉燃烧的化学方程式为3Fe+2O2Fe3O4
B.水可防止生成物溅落炸裂瓶底
C.激光手电照射使纳米铁粉的着火点降低
D.气球先膨胀后变瘪
5.下列现象、分析或结论正确的是 ( )
A.铜片表面有气泡产生 B.盛有镁片的试管外壁发烫
C.反应后试管中液体都呈无色 D.该实验不能比较铁、铜、镁的活动性
6.常温下,铝易与空气中的氧气反应生成一层致密的氧化铝薄膜,该氧化膜使内部的铝不再与氧气反应,硝酸汞[Hg(NO3)2]溶液可穿透致密的氧化铝薄膜,与铝反应生成汞,而汞的存在使铝表面的氧化膜疏松。用一张铝箔紧紧包裹在试管外壁(如),将试管浸入硝酸汞溶液中,片刻后取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨右侧水柱上升。根据实验现象判断下列说法错误的是( )
A.实验中发生了置换反应和化合反应
B.铝是一种较活泼的金属
C.铝与氧气反应放热
D.铝片上生出的“白毛”是氧化铝和氧化汞的混合物
7.如是硫酸铜溶液与过量铁粉反应前后溶液中主要离子的变化示意如如图,下列说法正确的是( )
A.该反应的化学方程式为2Fe+3CuSO4Fe2(SO4)3+3Cu
B.该反应过程中没有变化的粒子有S
C.该反应过程中发生改变的粒子只有Cu2+
D.该反应属于化合反应
8.[2020·日照] 如所示是探究铁钉锈蚀条件的四个实验,一段时间后观察现象。下列说法不正确的是( )
A.①中甲、乙、丙三处比较,生锈最明显的地方是甲
B.①②对比说明铁生锈需要空气,①③对比说明铁生锈需要水
C.③中附着在棉花上的氯化钙的作用是作干燥剂
D.四个实验中,生锈最快的是④中的铁钉
9.[2020·金华] 取一定质量的锌粒和铜片于同一敞口容器中,再逐渐加入稀硫酸。下列加入稀硫酸的质量与有关量的变化关系的如如图像正确的是 ( )
二、填空题
10.通过观察和实验的方法可获知物质的性质,从物质的状态、颜色、温度变化、有无沉淀或气体生成等方面可寻找物质发生变化的证据,分析各种证据能加深对物质变化和变化规律的认识。
(1)将锌粒放入稀硫酸中,锌粒表面产生气泡,反应的化学方程式为 。
(2)经引燃的铁丝在氧气中可以燃烧。支持铁和氧气发生化学反应的最主要证据是 。
11.[2020·青岛] 近年来,我国高铁飞速发展,已成为世界上唯一高铁成网运行的国家。请回答下列问题。
(1)制造高铁列车使用了多种材料。下列高铁列车的部件中,其主要材料属于金属材料的是
(填字母)。
A.玻璃车窗 B.镁铝合金车体
C.塑料小桌板 D.涤纶座套
(2)高铁电路多用铜质导线,这是利用了铜的延展性和 性。
(3)高铁刹车片由合金锻钢制作,时速300 km以上的列车紧急制动时,轮毂盘面和刹车片的温度瞬间达到700 ℃以上,合金锻钢应该具备耐磨和 等特性。
(4)建造高铁需要消耗大量的铝、铁等金属。工业炼铁的原理是氧化铁(Fe2O3)和一氧化碳在高温条件下反应,其化学方程式为 。
(5)车身表面烤漆不仅美观,还能起到防锈的作用。其防锈的原理是 。
(6)目前世界上已有50%以上的铁得到了回收利用。回收利用废旧金属的社会意义是
(写出一条即可)。
12.如所示,在已调平的托盘天平两边各放一只等质量的烧杯,再向烧杯中各倒入质量相等、质量分数也相等的稀硫酸,然后在左盘的烧杯中放入锌粉,同时在右盘的烧杯中放入等质量的铁粉。两只烧杯中都可以观察到的现象是 。完全反应后,观察到天平左、右两只烧杯中的金属粉末均无剩余,最终天平指针的指向是 (填“偏左”“中央”或“偏右”)。
附|加|题
13.将等质量的镁和铁分别放入等质量、相同浓度的稀盐酸中,产生氢气的质量和反应时间的关系如所示,下列说法错误的是 ( )
A. O~t1时段,产生氢气的质量镁比铁大
B.O~t2时段,参加反应的镁的质量与铁相等
C.反应结束后镁一定有剩余
D.反应消耗盐酸的总质量一定相等
14.已知:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O;二氧化硫具有与二氧化碳相似的化学性质,能与水反应生成酸;氢氧化钠溶液能吸收二氧化硫。为探究铜和浓硫酸的反应,某同学设计如所示实验(如如图中脱脂棉团蘸有紫色石蕊试液,石蕊遇酸变红)。关于该实验的说法错误的是 ( )
A. 与鼓气球相连接的导管需插入浓硫酸中
B.该装置便于控制铜和浓硫酸反应的发生和停止
C.铜丝绕成螺旋状是为了增大铜和浓硫酸的接触面积
D.实验中可观察到脱脂棉团变红
答案
1.C 由金属的物理性质可知,熔点最高的金属是钨。
2.A 黄铜是铜与锌的合金,铜、锌在加热条件下均能与空气中的氧气反应;铜不与稀盐酸反应,黄铜不能完全溶解在稀盐酸中。
3.B 铁能与硫酸铜溶液反应生成硫酸亚铁溶液和铜,溶液由蓝色变为浅绿色,铁钉表面析出红色物质;根据化学方程式,每56份质量的铁可置换出64份质量的铜,固体质量增加,溶液质量减少。
4.C 着火点是物质的固有属性,一般不能改变;纳米铁粉燃烧放出大量的热,锥形瓶内的气体受热膨胀,压强增大,气球膨胀,由于氧气被消耗,装置冷却后,压强变小,气球变瘪。
5.B 铜与盐酸不反应;金属与酸的反应属于放热反应;铁与盐酸反应生成氯化亚铁,溶液呈浅绿色;铜与盐酸不反应,铁和镁与盐酸反应的剧烈程度不同,通过这些现象可判断三种金属的活动性顺序。
6.D 从铝的氧化以及铝与硝酸汞的反应可知铝片上生成的“白毛”是氧化铝,汞的化学性质不活泼,“白毛”不可能是氧化汞。
7.B 铁与硫酸铜溶液反应生成硫酸亚铁溶液和铜,由硫酸铜溶液与过量铁粉反应前后溶液中主要离子变化示意如如图可知,铁与硫酸铜溶液发生反应中变化的微观粒子是铁原子和铜离子,硫酸根离子没有变。
8.A ①中甲、乙、丙三处比较,生锈最明显的地方是乙,乙处铁钉最易与氧气、水充分接触;一段时间后,①中的铁钉生锈,②和③中的铁钉没有生锈,对比①②可知道铁生锈需要空气,对比①③可知铁生锈需要水;氯化钙具有吸水性,③中附着在棉花上的氯化钙的作用是作干燥剂;④中铁钉接触到的是纯氧气,四个实验中,生锈最快的是④中的铁钉。
9.C 铜与硫酸不反应,随着稀硫酸的加入,铜片的质量不变;锌和稀硫酸反应生成硫酸锌和氢气,随着稀硫酸的加入,锌粒不断减少到完全反应;锌和稀硫酸反应生成硫酸锌和氢气,随着稀硫酸的不断加入,氢气的质量与硫酸锌的质量不断增加,当锌完全消耗后,氢气的质量不再改变,硫酸锌的质量不再改变。
10.(1)Zn+H2SO4ZnSO4+H2↑
(2)有黑色固体生成
11.(1)B (2)导电
(3)熔点高
(4)Fe2O3+3CO2Fe+3CO2
(5)隔绝氧气和水
(6)减少环境污染(合理即可)
(3)为防止制动时产生高温损坏刹车片,合金锻钢需要具备耐磨和熔点高等特性。(4)氧化铁和一氧化碳在高温条件下发生反应生成铁和二氧化碳,反应的化学方程式为Fe2O3+3CO2Fe+3CO2。(5)汽车车身表面的烤漆能隔绝氧气和水,从而使铁不易生锈。(6)回收利用废旧金属能减少环境污染,保护金属资源。
12.有气泡产生 偏左
锌和铁都会与稀硫酸反应产生氢气,故都会观察到有气泡产生。金属的质量相等,酸足量,则最终金属全部参加反应,锌产生的氢气的质量小于铁产生的氢气的质量,故最终加锌粉的这边质量大,天平指针偏向左边。
13.B O~t1时段,由如如图像可以看出产生氢气的质量镁比铁大;根据镁、铁和盐酸反应的化学方程式和镁、铁的相对原子质量可知,产生等质量的氢气,消耗铁的质量比镁大,在O~t2时段,产生氢气的质量相等,因此参加反应的镁的质量小于铁,又因为加入金属的质量相等,所以反应结束后镁一定有剩余;根据质量守恒定律,产生氢气的质量等于氯化氢中氢元素的质量,由于两种金属生成氢气的质量相等且盐酸浓度相同,因此反应消耗盐酸的总质量一定相等。
14.A 鼓气是为了使反应生成的二氧化硫全部导出,与鼓气球相连接的导管不能插入浓硫酸中;通过上下移动粗铜丝能使铜和浓硫酸随时接触或分离,从而控制反应随时发生或停止;铜丝绕成螺旋状是为了增大反应物的接触面积,从而加快铜和浓硫酸的反应;二氧化硫能和紫色石蕊试液中的水反应生成酸,使蘸有石蕊试液的脱脂棉团变红。
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
