【最新教师用书】2013-2014学年高中化学必修一:第三章 金属及其化合物 阶段复习课(30张ppt,知识整合+知识扫描)
文档属性
| 名称 | 【最新教师用书】2013-2014学年高中化学必修一:第三章 金属及其化合物 阶段复习课(30张ppt,知识整合+知识扫描) |  | |
| 格式 | zip | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-08-28 09:14:25 | ||
图片预览







文档简介
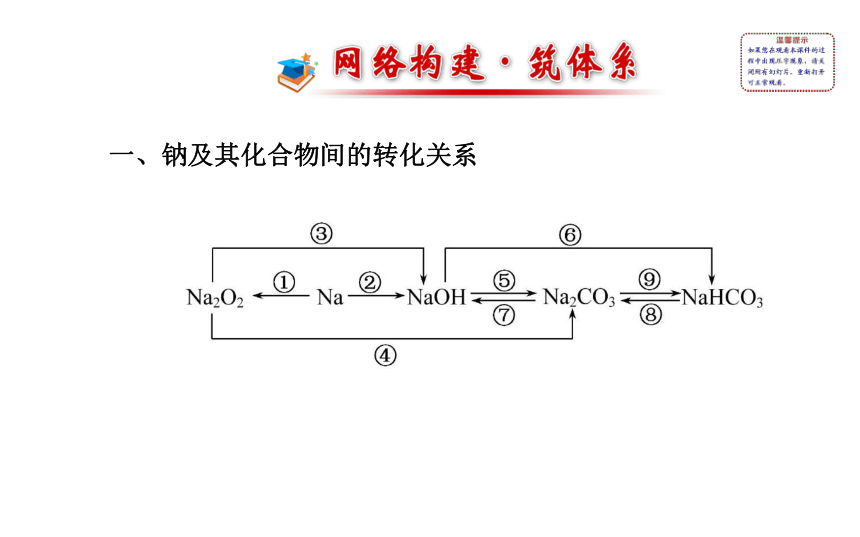
课件30张PPT。第三章 阶段复习课一、钠及其化合物间的转化关系2Na+O2 Na2O2写出图中标号所代表的化学方程式或离子方程式:
①化学方程式:________________;
②离子方程式:__________________________;
③化学方程式:________________________;
④化学方程式:________________________;
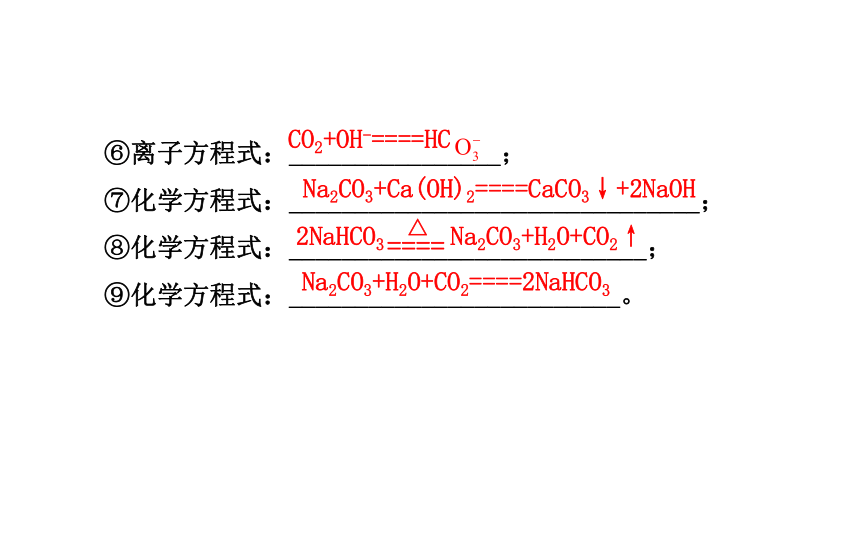
⑤离子方程式:_____________________;2Na+2H2O====2Na++2OH-+H2↑2Na2O2+2H2O====4NaOH+O2↑2Na2O2+2CO2====2Na2CO3+O2CO2+2OH-====C +H2O2NaHCO3 Na2CO3+H2O+CO2↑⑥离子方程式:________________;
⑦化学方程式:_______________________________;
⑧化学方程式:___________________________;
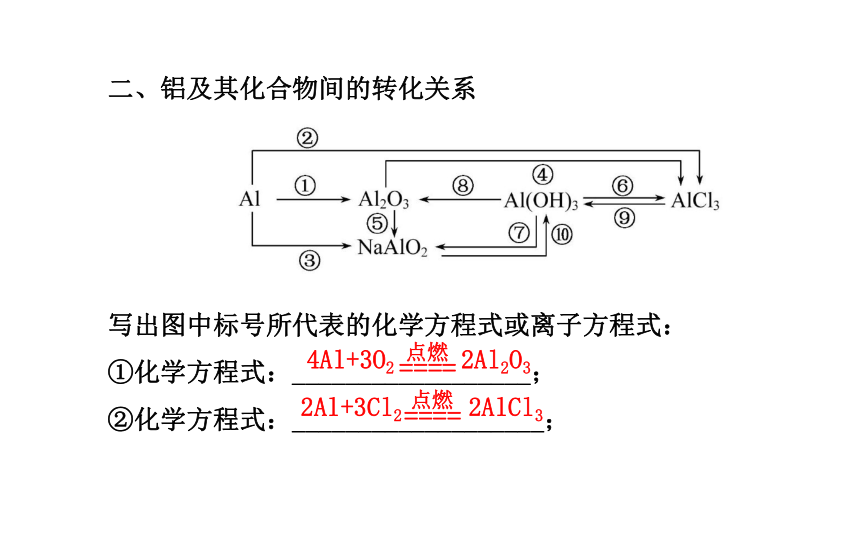
⑨化学方程式:_________________________。CO2+OH-====HCNa2CO3+Ca(OH)2====CaCO3↓+2NaOHNa2CO3+H2O+CO2====2NaHCO32Al+3Cl2 2AlCl34Al+3O2 2Al2O3二、铝及其化合物间的转化关系
写出图中标号所代表的化学方程式或离子方程式:
①化学方程式:__________________;
②化学方程式:___________________;③离子方程式:_____________________________;
④离子方程式:______________________;
⑤离子方程式:_______________________;
⑥离子方程式:_______________________;
⑦离子方程式:_________________________;
⑧化学方程式:________________________;
⑨离子方程式:______________________;
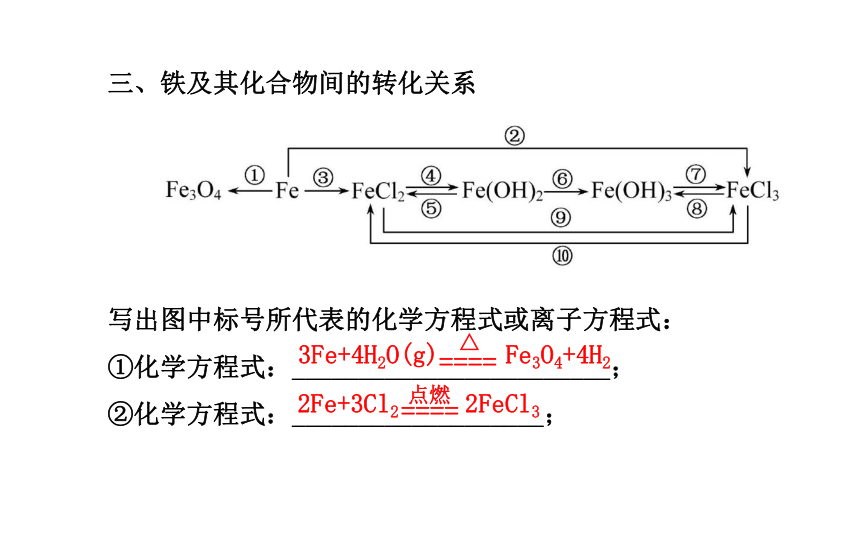
⑩离子方程式:__________________________。2Al+2OH-+2H2O====2Al +3H2↑Al2O3+6H+====2Al3++3H2OAl2O3+2OH-====2Al +H2OAl(OH)3+3H+====Al3++3H2OAl(OH)3+OH-====Al +2H2O2Al(OH)3 Al2O3+3H2OAl3++3OH-====Al(OH)3Al +H++H2O====Al(OH)3↓↓2Fe+3Cl2 2FeCl33Fe+4H2O(g) Fe3O4+4H2三、铁及其化合物间的转化关系
写出图中标号所代表的化学方程式或离子方程式:
①化学方程式:________________________;
②化学方程式:___________________;③离子方程式:__________________;
④离子方程式:_____________________;
⑤离子方程式:_______________________;
⑥化学方程式:____________________________;
⑦离子方程式:_______________________;
⑧离子方程式:_____________________;
⑨离子方程式:______________________;
⑩离子方程式:_________________。 Fe+2H+====Fe2++H2↑Fe2++2OH-====Fe(OH)2↓Fe(OH)2+2H+====Fe2++2H2O4Fe(OH)2+O2+2H2O====4Fe(OH)3Fe(OH)3+3H+====Fe3++3H2OFe3++3OH-====Fe(OH)3↓2Fe2++Cl2====2Fe3++2Cl-Fe+2Fe3+====3Fe2+四、焰色反应
1.操作
(1)用_______清洗_____,
(2)灼烧铂丝,
(3)蘸取试剂,
(4)灼烧、观察,
(5)清洗铂丝。
2.常见金属的焰色反应
钠:_____;钾:_____(透过_____________观察)。 稀盐酸铂丝黄色紫色蓝色的钴玻璃考点 一 金属及其化合物的相互转化
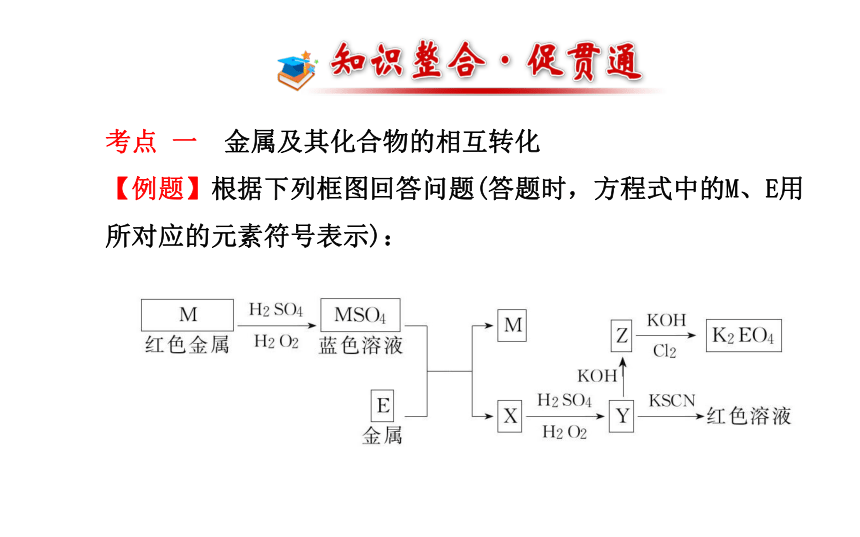
【例题】根据下列框图回答问题(答题时,方程式中的M、E用
所对应的元素符号表示): (1)写出M溶于稀硫酸和H2O2混合液的化学方程式:
_________________________________________________。
(2)某同学取Y的溶液,加入KI-淀粉溶液,变为蓝色。写出与
上述变化过程相关的离子方程式:
_________________________________________________。
(3)写出Cl2将Z氧化为K2EO4的化学方程式:
_________________________________________________。(4)将M、E、ECl3溶液、ECl2溶液和MCl2溶液混合于某容器中充
分反应(容器不参与反应),试判断下列情况下容器中存在的金
属离子和金属单质。
①若E有剩余,则容器中不可能有______。
②若MCl2有剩余,则容器中还可能有______,一定有______。【解析】(1)由MSO4为蓝色溶液知M为Cu;由Y与KSCN溶液产生红色溶液知Y含有Fe3+,即Y为Fe2(SO4)3,逆推X为FeSO4,E为Fe,Z为Fe(OH)3,K2EO4为K2FeO4。
(2)Fe2(SO4)3溶液加入KI-淀粉溶液变蓝色,说明有I2生成,其变化过程为2Fe3++2I-====2Fe2++I2。
(4)该问涉及的反应有:
Fe+2FeCl3====3FeCl2 Fe+CuCl2====FeCl2+Cu
2FeCl3+Cu====2FeCl2+CuCl2。若铁粉有剩余,则容器中不可能有Fe3+、Cu2+,若CuCl2有剩余,则容器中不可能有Fe,可能有Fe3+或Cu,一定有Fe2+。答案:(1)Cu+H2O2+H2SO4====CuSO4+2H2O
(2)2Fe3++2I-====2Fe2++I2
(3)10KOH+3Cl2+2Fe(OH)3====2K2FeO4+6KCl+8H2O
(4)①Fe3+、Cu2+ ②Fe3+或Cu Fe2+ 【知识扫描】解答框图推断题的常见突破口
1.常见物质的颜色2.特殊反应现象
(1)焰色反应:Na+(黄色)、K+(紫色)。
(2)白色沉淀[Fe(OH)2] 红褐色[Fe(OH)3](由白色→
灰绿色→红褐色)。
(3)单质与碱反应产生气体。
2Al+2NaOH+2H2O====2NaAlO2+3H2↑ 3.特殊的转化关系
(1)特征转化:
(2)三角转化:考点 二 试剂滴加顺序不同,化学反应不同
【例题】下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是( )
A.NaHSO4和Ba(OH)2 B.AlCl3和NaOH
C.NaAlO2和H2SO4 D.Na2CO3和H2SO4 【解析】选A。A中将NaHSO4滴入Ba(OH)2发生反应:NaHSO4+Ba(OH)2====BaSO4↓+NaOH+H2O,将Ba(OH)2滴入NaHSO4时,反应为2NaHSO4+Ba(OH)2====BaSO4↓+Na2SO4+2H2O,尽管反应原理不同,但实验现象是相同的。将AlCl3滴入NaOH或将NaAlO2滴入H2SO4,开始无沉淀,后来有沉淀生成,而将NaOH滴入AlCl3或将H2SO4滴入NaAlO2时,开始有沉淀,后来沉淀溶解,现象不同,B、C不符合题意;D中将Na2CO3滴入H2SO4,立即有气体生成,而将H2SO4滴入Na2CO3,开始无气体生成,后来才有气体生成,故现象不同,D不符合题意。 【知识扫描】物质的检验方法——互滴法
1.Na2CO3与盐酸2.铝盐和碱3.偏铝酸盐与酸 考点 三 “铝三角”转化关系中的图像问题
【例1】将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( ) 【解析】选C。A项,由Ca(OH)2+CO2====CaCO3↓+H2O,CaCO3+CO2+H2O====Ca(HCO3)2可知,其图像应为图(1);B项,由HCl+NaAlO2+H2O====Al(OH)3↓+NaCl,Al(OH)3+3HCl====AlCl3+3H2O可知其图像应为图(2);D项,由AlCl3+4NaOH====NaAlO2+3NaCl+2H2O,3NaAlO2+AlCl3+6H2O====4Al(OH)3↓+3NaCl可知,其图像应为图(3)。 【例2】将一定质量的Mg和Al混合物投入500 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法正确的是( )A.Mg和Al的总质量为8 g
B.硫酸的物质的量浓度为5 mol·L-1
C.生成的H2在标准状况下的体积为11.2 L
D.NaOH溶液的物质的量浓度为5 mol·L-1【解析】选D。由图像可知,镁的物质的量为0.15 mol,铝的物质的量为0.2 mol,二者质量和为27 g·mol-1×0.2 mol+
24 g·mol-1×0.15 mol=9.0 g,A项错误。生成气体的体积为(0.2×1.5+0.15) mol×22.4 L·mol-1<11.2 L,因此C项错误。镁离子和铝离子完全沉淀需氢氧化钠的物质的量为
0.15 mol×2+0.2 mol×3=0.9 mol,则氢氧化钠的浓度为
0.9 mol÷0.18 L=5 mol·L-1,D项正确。当沉淀达最大量时,溶液中溶质为硫酸钠,根据硫酸根守恒得硫酸的浓度为0.2 L×5 mol·L-1÷2÷0.5 L=1 mol·L-1,因此B项错误。【知识扫描】图像问题的解题技巧
(1)首先做到——五看(看坐标、看比例、看起点、看折点、看特征)。
(2)找出图与化学反应的量的关系。
(3)注意在“过量”“少量”影响下的化学方程式的书写及对折点的分析。
①化学方程式:________________;
②离子方程式:__________________________;
③化学方程式:________________________;
④化学方程式:________________________;
⑤离子方程式:_____________________;2Na+2H2O====2Na++2OH-+H2↑2Na2O2+2H2O====4NaOH+O2↑2Na2O2+2CO2====2Na2CO3+O2CO2+2OH-====C +H2O2NaHCO3 Na2CO3+H2O+CO2↑⑥离子方程式:________________;
⑦化学方程式:_______________________________;
⑧化学方程式:___________________________;
⑨化学方程式:_________________________。CO2+OH-====HCNa2CO3+Ca(OH)2====CaCO3↓+2NaOHNa2CO3+H2O+CO2====2NaHCO32Al+3Cl2 2AlCl34Al+3O2 2Al2O3二、铝及其化合物间的转化关系
写出图中标号所代表的化学方程式或离子方程式:
①化学方程式:__________________;
②化学方程式:___________________;③离子方程式:_____________________________;
④离子方程式:______________________;
⑤离子方程式:_______________________;
⑥离子方程式:_______________________;
⑦离子方程式:_________________________;
⑧化学方程式:________________________;
⑨离子方程式:______________________;
⑩离子方程式:__________________________。2Al+2OH-+2H2O====2Al +3H2↑Al2O3+6H+====2Al3++3H2OAl2O3+2OH-====2Al +H2OAl(OH)3+3H+====Al3++3H2OAl(OH)3+OH-====Al +2H2O2Al(OH)3 Al2O3+3H2OAl3++3OH-====Al(OH)3Al +H++H2O====Al(OH)3↓↓2Fe+3Cl2 2FeCl33Fe+4H2O(g) Fe3O4+4H2三、铁及其化合物间的转化关系
写出图中标号所代表的化学方程式或离子方程式:
①化学方程式:________________________;
②化学方程式:___________________;③离子方程式:__________________;
④离子方程式:_____________________;
⑤离子方程式:_______________________;
⑥化学方程式:____________________________;
⑦离子方程式:_______________________;
⑧离子方程式:_____________________;
⑨离子方程式:______________________;
⑩离子方程式:_________________。 Fe+2H+====Fe2++H2↑Fe2++2OH-====Fe(OH)2↓Fe(OH)2+2H+====Fe2++2H2O4Fe(OH)2+O2+2H2O====4Fe(OH)3Fe(OH)3+3H+====Fe3++3H2OFe3++3OH-====Fe(OH)3↓2Fe2++Cl2====2Fe3++2Cl-Fe+2Fe3+====3Fe2+四、焰色反应
1.操作
(1)用_______清洗_____,
(2)灼烧铂丝,
(3)蘸取试剂,
(4)灼烧、观察,
(5)清洗铂丝。
2.常见金属的焰色反应
钠:_____;钾:_____(透过_____________观察)。 稀盐酸铂丝黄色紫色蓝色的钴玻璃考点 一 金属及其化合物的相互转化
【例题】根据下列框图回答问题(答题时,方程式中的M、E用
所对应的元素符号表示): (1)写出M溶于稀硫酸和H2O2混合液的化学方程式:
_________________________________________________。
(2)某同学取Y的溶液,加入KI-淀粉溶液,变为蓝色。写出与
上述变化过程相关的离子方程式:
_________________________________________________。
(3)写出Cl2将Z氧化为K2EO4的化学方程式:
_________________________________________________。(4)将M、E、ECl3溶液、ECl2溶液和MCl2溶液混合于某容器中充
分反应(容器不参与反应),试判断下列情况下容器中存在的金
属离子和金属单质。
①若E有剩余,则容器中不可能有______。
②若MCl2有剩余,则容器中还可能有______,一定有______。【解析】(1)由MSO4为蓝色溶液知M为Cu;由Y与KSCN溶液产生红色溶液知Y含有Fe3+,即Y为Fe2(SO4)3,逆推X为FeSO4,E为Fe,Z为Fe(OH)3,K2EO4为K2FeO4。
(2)Fe2(SO4)3溶液加入KI-淀粉溶液变蓝色,说明有I2生成,其变化过程为2Fe3++2I-====2Fe2++I2。
(4)该问涉及的反应有:
Fe+2FeCl3====3FeCl2 Fe+CuCl2====FeCl2+Cu
2FeCl3+Cu====2FeCl2+CuCl2。若铁粉有剩余,则容器中不可能有Fe3+、Cu2+,若CuCl2有剩余,则容器中不可能有Fe,可能有Fe3+或Cu,一定有Fe2+。答案:(1)Cu+H2O2+H2SO4====CuSO4+2H2O
(2)2Fe3++2I-====2Fe2++I2
(3)10KOH+3Cl2+2Fe(OH)3====2K2FeO4+6KCl+8H2O
(4)①Fe3+、Cu2+ ②Fe3+或Cu Fe2+ 【知识扫描】解答框图推断题的常见突破口
1.常见物质的颜色2.特殊反应现象
(1)焰色反应:Na+(黄色)、K+(紫色)。
(2)白色沉淀[Fe(OH)2] 红褐色[Fe(OH)3](由白色→
灰绿色→红褐色)。
(3)单质与碱反应产生气体。
2Al+2NaOH+2H2O====2NaAlO2+3H2↑ 3.特殊的转化关系
(1)特征转化:
(2)三角转化:考点 二 试剂滴加顺序不同,化学反应不同
【例题】下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是( )
A.NaHSO4和Ba(OH)2 B.AlCl3和NaOH
C.NaAlO2和H2SO4 D.Na2CO3和H2SO4 【解析】选A。A中将NaHSO4滴入Ba(OH)2发生反应:NaHSO4+Ba(OH)2====BaSO4↓+NaOH+H2O,将Ba(OH)2滴入NaHSO4时,反应为2NaHSO4+Ba(OH)2====BaSO4↓+Na2SO4+2H2O,尽管反应原理不同,但实验现象是相同的。将AlCl3滴入NaOH或将NaAlO2滴入H2SO4,开始无沉淀,后来有沉淀生成,而将NaOH滴入AlCl3或将H2SO4滴入NaAlO2时,开始有沉淀,后来沉淀溶解,现象不同,B、C不符合题意;D中将Na2CO3滴入H2SO4,立即有气体生成,而将H2SO4滴入Na2CO3,开始无气体生成,后来才有气体生成,故现象不同,D不符合题意。 【知识扫描】物质的检验方法——互滴法
1.Na2CO3与盐酸2.铝盐和碱3.偏铝酸盐与酸 考点 三 “铝三角”转化关系中的图像问题
【例1】将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( ) 【解析】选C。A项,由Ca(OH)2+CO2====CaCO3↓+H2O,CaCO3+CO2+H2O====Ca(HCO3)2可知,其图像应为图(1);B项,由HCl+NaAlO2+H2O====Al(OH)3↓+NaCl,Al(OH)3+3HCl====AlCl3+3H2O可知其图像应为图(2);D项,由AlCl3+4NaOH====NaAlO2+3NaCl+2H2O,3NaAlO2+AlCl3+6H2O====4Al(OH)3↓+3NaCl可知,其图像应为图(3)。 【例2】将一定质量的Mg和Al混合物投入500 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法正确的是( )A.Mg和Al的总质量为8 g
B.硫酸的物质的量浓度为5 mol·L-1
C.生成的H2在标准状况下的体积为11.2 L
D.NaOH溶液的物质的量浓度为5 mol·L-1【解析】选D。由图像可知,镁的物质的量为0.15 mol,铝的物质的量为0.2 mol,二者质量和为27 g·mol-1×0.2 mol+
24 g·mol-1×0.15 mol=9.0 g,A项错误。生成气体的体积为(0.2×1.5+0.15) mol×22.4 L·mol-1<11.2 L,因此C项错误。镁离子和铝离子完全沉淀需氢氧化钠的物质的量为
0.15 mol×2+0.2 mol×3=0.9 mol,则氢氧化钠的浓度为
0.9 mol÷0.18 L=5 mol·L-1,D项正确。当沉淀达最大量时,溶液中溶质为硫酸钠,根据硫酸根守恒得硫酸的浓度为0.2 L×5 mol·L-1÷2÷0.5 L=1 mol·L-1,因此B项错误。【知识扫描】图像问题的解题技巧
(1)首先做到——五看(看坐标、看比例、看起点、看折点、看特征)。
(2)找出图与化学反应的量的关系。
(3)注意在“过量”“少量”影响下的化学方程式的书写及对折点的分析。
