【最新教师用书】2013-2014学年高中化学必修一:第二章 化学物质及其变化 阶段复习课件(27张ppt,含2013试题)
文档属性
| 名称 | 【最新教师用书】2013-2014学年高中化学必修一:第二章 化学物质及其变化 阶段复习课件(27张ppt,含2013试题) |  | |
| 格式 | zip | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-08-28 09:14:36 | ||
图片预览





文档简介
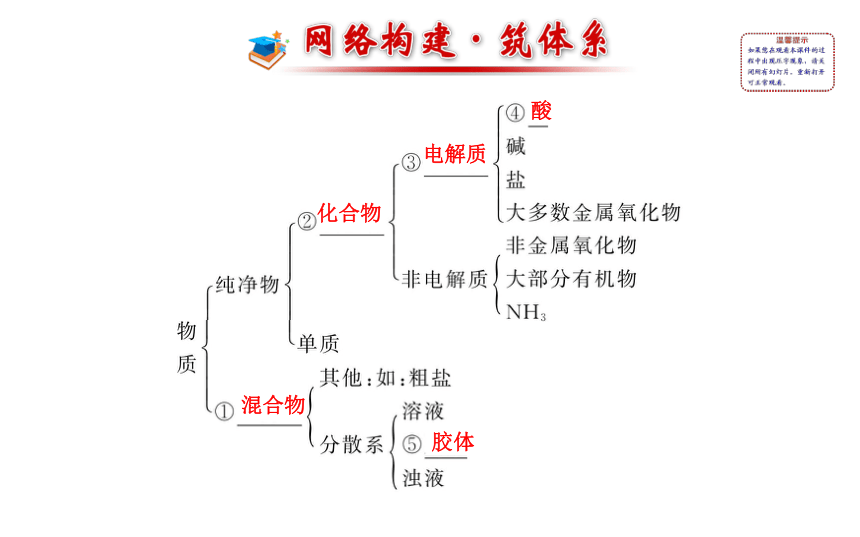
课件27张PPT。第二章 阶段复习课混合物化合物电解质酸胶体二、化学反应的分类
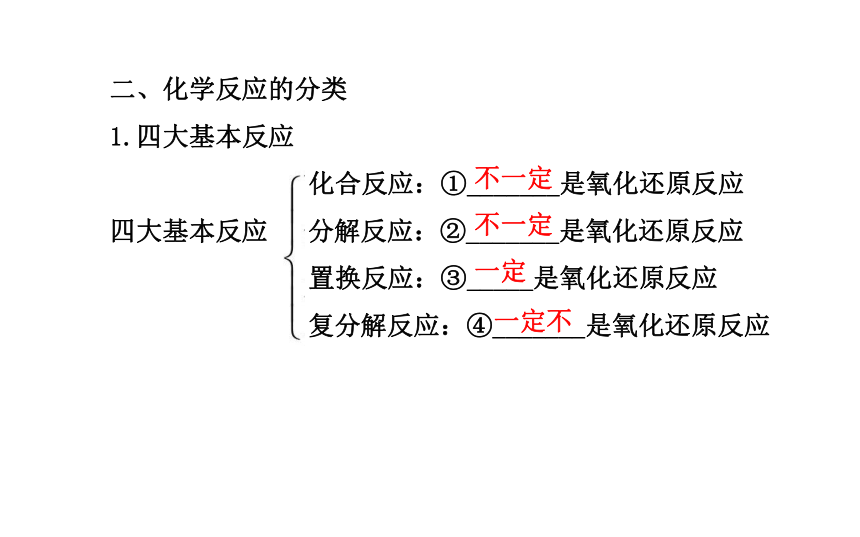
1.四大基本反应
化合反应:①_______是氧化还原反应
四大基本反应 分解反应:②_______是氧化还原反应
置换反应:③_____是氧化还原反应
复分解反应:④_______是氧化还原反应
不一定不一定一定一定不2.离子反应3.氧化还原反应有化合价升降有电子转移考点 一 物质的分类、胶体的性质
【例题】下列有关物质的分类正确的是( )
A.混合物:空气、矿泉水、水银
B.碱:Ba(OH)2、Cu2(OH)2CO3、NH3·H2O
C.盐:硫酸钠、氯化铵、纯碱
D.氧化物:H2O、CO、CH3COOH【解析】选C。A项,水银是Hg,属于单质,错误;B项,Cu2(OH)2CO3属于盐,错误;C项,三种物质化学式分别为Na2SO4、NH4Cl、Na2CO3,均属于盐,正确;D项,CH3COOH属于酸,错误。 【知识扫描】
1.物质的分类
(1)物质的分类依据多种多样,分类依据不同,物质所属的类别也就不同。
如NaNO3属于纯净物、化合物、电解质,按照金属阳离子分类属于钠盐,按阴离子分类属于硝酸盐。
(2)交叉分类法和树状分类法:
①树状分类法中所涉及类别之间既有并列关系,也有从属(包含)关系。②交叉分类法所涉及的不同类别之间是并列与交叉关系,它们之间不能相互包含。
(3)有关物质分类的试题,可以记忆几个特殊的物质,用特例证明法快速解题。2.胶体的性质
(3)电泳:胶粒在电场作用下作定向移动。考点 二 离子反应
【例1】(2013·合肥高一检测)下列反应的离子方程式中正确的是( )
A.氨气通入盐酸中H++Cl-+NH3====NH4Cl
B.盐酸滴到铜片上Cu+2H+====Cu2++H2↑
C.碳酸钡溶于醋酸
BaCO3+2H+====Ba2++H2O+CO2↑
D.澄清的石灰水跟盐酸反应H++OH-====H2O【解析】选D。NH4Cl易溶于水,应拆成离子,A错误;盐酸与铜不发生反应,B错误;醋酸是弱酸,不能拆成离子,C错误;氢氧化钙是强碱,且澄清溶液应拆成离子,盐酸是强酸,生成的氯化钙易溶于水,D正确。【例2】在无色透明酸性溶液中能大量共存的离子组是( )
A.Al3+、Ag+、 、Cl-
B.Mg2+、 、 、Cl-
C.Na+、K+、 、Cl-
D.Cu2+、Na+、 、
【解析】选B。A中Ag+和Cl-不能共存;B中不含有颜色的离
子,各离子之间相互不发生反应,而且也都不和H+反应,符合
题意;C中 和H+反应生成CO2和H2O;D中Cu2+显蓝色。【知识扫描】
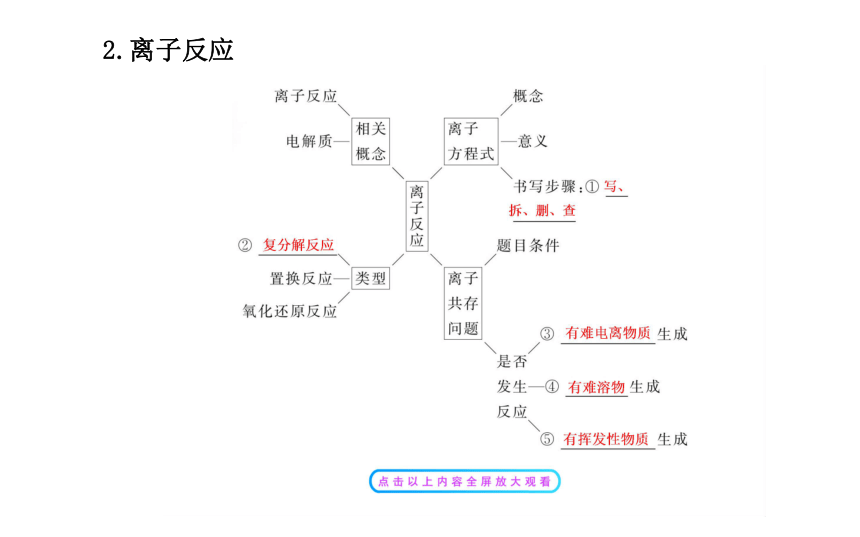
离子方程式及离子共存
1.离子方程式正误判断的关键
(1)牢固掌握“必拆”和“不拆”:
“必拆”:易溶且易电离的物质必须拆成离子符号表示。
“不拆”:单质、气体、氧化物、难溶、难电离的物质。
(2)不要忘记检查:
①检查方程式两边各元素原子个数和电荷数是否相等。
②检查是否漏掉离子反应。
③检查化学计量数是否最简单。2.离子能否大量共存的判断
(1)离子反应的四种情况:
①生成难溶的物质,如生成BaSO4沉淀;
②生成挥发性物质,如生成CO2气体;
③生成难电离的物质,如生成H2O;
④发生氧化还原反应,如Fe3+与I-。
(2)注意隐含条件:
①注意有色离子:无色溶液中不能含有色离子:②注意溶液酸碱性的不同说法:考点 三 氧化还原反应
【例1】(2013·佛山高一检测)要严格控制饮用矿泉水中“溴
酸盐( )”的含量。有关专家解释,矿泉水在开采过程中会
含有少量溴化物(Br-),在后续的生产过程中经臭氧(O3)处理
逐渐转化成溴酸盐。下列有关该转化过程的认识正确的是
( )
A.该过程中溴化物(Br-)得到电子
B.该过程中臭氧(O3)是氧化剂,溴酸盐( )是还原剂
C.该过程中溴元素被还原
D.该过程中溴元素发生氧化反应【解析】选D。据条件可知,反应中Br-失去电子生成溴酸盐( ),故溴化物(Br-)是还原剂,溴元素被氧化,发生氧化反应,臭氧(O3)是氧化剂,溴酸盐( )是氧化产物,故选D。【例2】(2013·海南高一检测)已知常温下在溶液中可发生如下两个离子反应:
①Ce4++Fe2+====Fe3++Ce3+
②Sn2++2Fe3+====2Fe2++Sn4+
下列说法正确的是( )
A.反应②中被还原与被氧化的离子的个数之比是 1∶2
B.反应②中每2 mol Fe3+参加反应转移1 mol电子
C.氧化性:Sn4+>Ce4+>Fe3+
D.氧化性:Ce4+>Fe3+>Sn4+【解析】选D。氧化剂的氧化性大于氧化产物,反应①中氧化剂是Ce4+>Fe3+,反应②中氧化性是Fe3+>Sn4+,故D正确,C错误;反应②中被还原的离子(Fe3+)与被氧化的离子(Sn2+)的个数之比是 2∶1,且每1 mol Fe3+参加反应转移1 mol电子,A、B错误。【知识扫描】
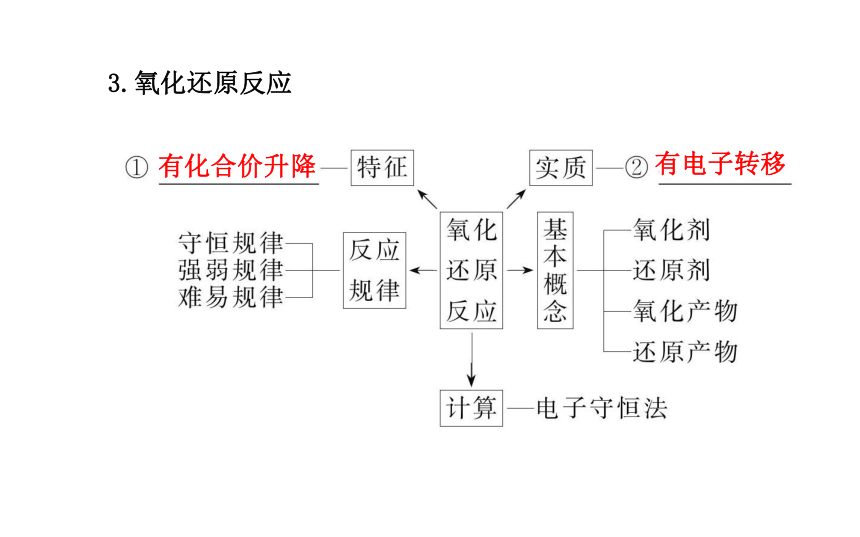
1.氧化还原反应中各概念之间的相互关系2.表示方法
(1)单线桥法:
(2)双线桥法:3.氧化还原反应的基本规律
(1)守恒规律:还原剂失去电子总数=氧化剂得到电子总数
(2)强弱规律:
氧化性:氧化剂>氧化产物;
还原性:还原剂>还原产物。
(3)价态规律:(4)先后规律:
①一种氧化剂同时遇到几种还原剂时,还原性强的先被氧化,即还原性最强的还原剂优先被氧化。
②一种还原剂同时与多种氧化剂相遇时,氧化性强的优先被还原。4.电子守恒在氧化还原反应中具有重要的作用
(1)含义:在氧化还原反应中有物质失电子必有物质得电子,且得电子总数等于失电子总数。或者说氧化还原反应中,有物质元素化合价升高必有物质元素化合价降低,且化合价降低总值必等于升高总值。
(2)有关电子守恒的规律有如下应用:
①求某一反应中被氧化与被还原的原子数之比, 或氧化剂与还原剂分子数之比及氧化产物分子数与还原产物分子数之比。
②进行氧化还原反应的有关计算。
1.四大基本反应
化合反应:①_______是氧化还原反应
四大基本反应 分解反应:②_______是氧化还原反应
置换反应:③_____是氧化还原反应
复分解反应:④_______是氧化还原反应
不一定不一定一定一定不2.离子反应3.氧化还原反应有化合价升降有电子转移考点 一 物质的分类、胶体的性质
【例题】下列有关物质的分类正确的是( )
A.混合物:空气、矿泉水、水银
B.碱:Ba(OH)2、Cu2(OH)2CO3、NH3·H2O
C.盐:硫酸钠、氯化铵、纯碱
D.氧化物:H2O、CO、CH3COOH【解析】选C。A项,水银是Hg,属于单质,错误;B项,Cu2(OH)2CO3属于盐,错误;C项,三种物质化学式分别为Na2SO4、NH4Cl、Na2CO3,均属于盐,正确;D项,CH3COOH属于酸,错误。 【知识扫描】
1.物质的分类
(1)物质的分类依据多种多样,分类依据不同,物质所属的类别也就不同。
如NaNO3属于纯净物、化合物、电解质,按照金属阳离子分类属于钠盐,按阴离子分类属于硝酸盐。
(2)交叉分类法和树状分类法:
①树状分类法中所涉及类别之间既有并列关系,也有从属(包含)关系。②交叉分类法所涉及的不同类别之间是并列与交叉关系,它们之间不能相互包含。
(3)有关物质分类的试题,可以记忆几个特殊的物质,用特例证明法快速解题。2.胶体的性质
(3)电泳:胶粒在电场作用下作定向移动。考点 二 离子反应
【例1】(2013·合肥高一检测)下列反应的离子方程式中正确的是( )
A.氨气通入盐酸中H++Cl-+NH3====NH4Cl
B.盐酸滴到铜片上Cu+2H+====Cu2++H2↑
C.碳酸钡溶于醋酸
BaCO3+2H+====Ba2++H2O+CO2↑
D.澄清的石灰水跟盐酸反应H++OH-====H2O【解析】选D。NH4Cl易溶于水,应拆成离子,A错误;盐酸与铜不发生反应,B错误;醋酸是弱酸,不能拆成离子,C错误;氢氧化钙是强碱,且澄清溶液应拆成离子,盐酸是强酸,生成的氯化钙易溶于水,D正确。【例2】在无色透明酸性溶液中能大量共存的离子组是( )
A.Al3+、Ag+、 、Cl-
B.Mg2+、 、 、Cl-
C.Na+、K+、 、Cl-
D.Cu2+、Na+、 、
【解析】选B。A中Ag+和Cl-不能共存;B中不含有颜色的离
子,各离子之间相互不发生反应,而且也都不和H+反应,符合
题意;C中 和H+反应生成CO2和H2O;D中Cu2+显蓝色。【知识扫描】
离子方程式及离子共存
1.离子方程式正误判断的关键
(1)牢固掌握“必拆”和“不拆”:
“必拆”:易溶且易电离的物质必须拆成离子符号表示。
“不拆”:单质、气体、氧化物、难溶、难电离的物质。
(2)不要忘记检查:
①检查方程式两边各元素原子个数和电荷数是否相等。
②检查是否漏掉离子反应。
③检查化学计量数是否最简单。2.离子能否大量共存的判断
(1)离子反应的四种情况:
①生成难溶的物质,如生成BaSO4沉淀;
②生成挥发性物质,如生成CO2气体;
③生成难电离的物质,如生成H2O;
④发生氧化还原反应,如Fe3+与I-。
(2)注意隐含条件:
①注意有色离子:无色溶液中不能含有色离子:②注意溶液酸碱性的不同说法:考点 三 氧化还原反应
【例1】(2013·佛山高一检测)要严格控制饮用矿泉水中“溴
酸盐( )”的含量。有关专家解释,矿泉水在开采过程中会
含有少量溴化物(Br-),在后续的生产过程中经臭氧(O3)处理
逐渐转化成溴酸盐。下列有关该转化过程的认识正确的是
( )
A.该过程中溴化物(Br-)得到电子
B.该过程中臭氧(O3)是氧化剂,溴酸盐( )是还原剂
C.该过程中溴元素被还原
D.该过程中溴元素发生氧化反应【解析】选D。据条件可知,反应中Br-失去电子生成溴酸盐( ),故溴化物(Br-)是还原剂,溴元素被氧化,发生氧化反应,臭氧(O3)是氧化剂,溴酸盐( )是氧化产物,故选D。【例2】(2013·海南高一检测)已知常温下在溶液中可发生如下两个离子反应:
①Ce4++Fe2+====Fe3++Ce3+
②Sn2++2Fe3+====2Fe2++Sn4+
下列说法正确的是( )
A.反应②中被还原与被氧化的离子的个数之比是 1∶2
B.反应②中每2 mol Fe3+参加反应转移1 mol电子
C.氧化性:Sn4+>Ce4+>Fe3+
D.氧化性:Ce4+>Fe3+>Sn4+【解析】选D。氧化剂的氧化性大于氧化产物,反应①中氧化剂是Ce4+>Fe3+,反应②中氧化性是Fe3+>Sn4+,故D正确,C错误;反应②中被还原的离子(Fe3+)与被氧化的离子(Sn2+)的个数之比是 2∶1,且每1 mol Fe3+参加反应转移1 mol电子,A、B错误。【知识扫描】
1.氧化还原反应中各概念之间的相互关系2.表示方法
(1)单线桥法:
(2)双线桥法:3.氧化还原反应的基本规律
(1)守恒规律:还原剂失去电子总数=氧化剂得到电子总数
(2)强弱规律:
氧化性:氧化剂>氧化产物;
还原性:还原剂>还原产物。
(3)价态规律:(4)先后规律:
①一种氧化剂同时遇到几种还原剂时,还原性强的先被氧化,即还原性最强的还原剂优先被氧化。
②一种还原剂同时与多种氧化剂相遇时,氧化性强的优先被还原。4.电子守恒在氧化还原反应中具有重要的作用
(1)含义:在氧化还原反应中有物质失电子必有物质得电子,且得电子总数等于失电子总数。或者说氧化还原反应中,有物质元素化合价升高必有物质元素化合价降低,且化合价降低总值必等于升高总值。
(2)有关电子守恒的规律有如下应用:
①求某一反应中被氧化与被还原的原子数之比, 或氧化剂与还原剂分子数之比及氧化产物分子数与还原产物分子数之比。
②进行氧化还原反应的有关计算。
