(沪教版)2.2.2 二氧化碳的制取同步课件(18页)
文档属性
| 名称 | (沪教版)2.2.2 二氧化碳的制取同步课件(18页) |

|
|
| 格式 | pptx | ||
| 文件大小 | 696.4KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-30 10:02:40 | ||
图片预览






文档简介
(共18张PPT)
实验室制取二氧化碳
固固加热型
固液不加热型
实验室是如何制氧气的?
知识回顾:
【复习】实验室制取氧气
药品 高锰酸钾 双氧水和二氧化锰
反应原理
反应物状态
反应条件
发生装置
收集装置
备选仪器
验证方法
验满方法
固态
固态和液态
加热
常温
A
B
C或D
把带火星的木条伸入集气瓶中,复燃则是氧气
把带火星的木条放在集气瓶口,复燃则满
实验室如何制取氧气?
药品?
反应原理?
↓
确定装置
↓
检验?
验满?
反应条件(是否需要加热)
(考虑因素)
反应物的状态
排空气法
排水法
向上排空气法
向下排空气法
(密度比空气的大)
(密度比空气的小)
发生装置
收集装置
【不易(或难)溶于水,不与水反应】
实验室里制取气体的一般思路和方法:
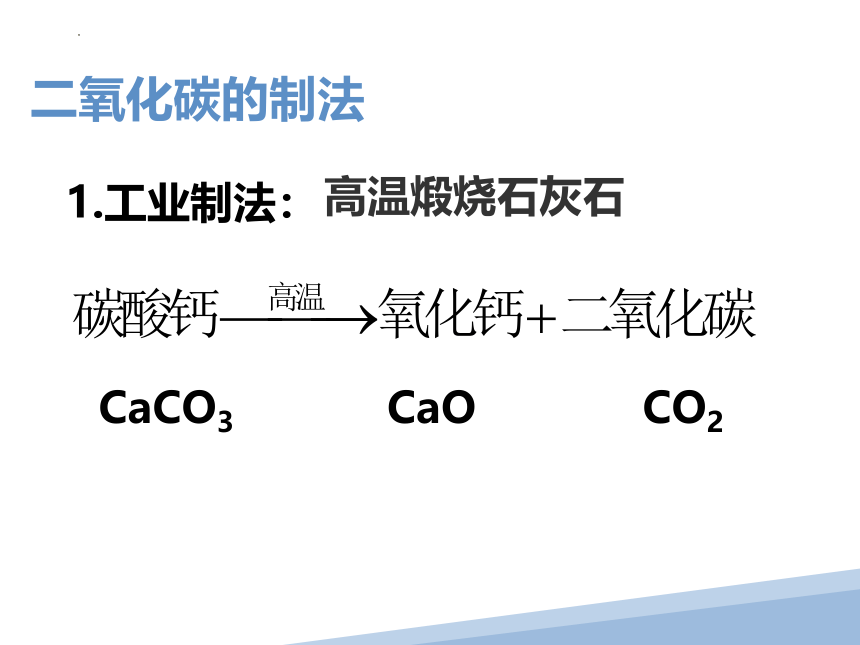
1.工业制法:
高温煅烧石灰石
CaCO3 CaO CO2
二氧化碳的制法
实验原理、药品探究— 对比实验
实验药品
实验现象
1.稀盐酸和碳酸钠粉末
2.稀盐酸和块状石灰石
3.稀硫酸和块状石灰石
产生大量气泡,速率较快
产生大量气泡,速率适中
刚开始有气泡产生,很快气泡就停止产生
选择药品(原理可行、来源丰富、价格适宜)
2.实验室制法:
1.为什么不用碳酸钠粉末和稀盐酸反应制取CO2
反应速率太快,难以控制,不便于操作。
2.为什么不用稀硫酸和大理石反应制取 CO2
硫酸与大理石反应生成的硫酸钙微溶于水,会覆盖在大理石的表面,使反应逐渐停止。
3.为什么不用浓盐酸和大理石反应制取CO2
4.实验室用什么样的装置制取CO2
浓盐酸易挥发,会使制得的二氧化碳中混有氯化氢气体而不纯。
一、药品:
石灰石或大理石(主要成份CaCO3)
二、反应原理:
CaCO3 + HCl → CaCl2 + H2O + CO2
制取二氧化碳的药品和原理:
和稀盐酸(主要成分为HCl)
均为混合物
密度比空气大能溶于水
不需加热
液体
固体
碳酸钙 + 盐酸 → 氯化钙 + 水 + 二氧化碳
实验室制取二氧化碳可用的简易装置是:
2、如果想在制气的过程中补充酸液,或控制酸液的加入量,可设计什么样的装置
1、如果要制取较多量的二氧化碳气体,可以把试管换成哪些仪器?
想一想:
如果还想随时控制反应的发生和停止,还可怎样设计装置呢?
想一想
固液不加热型
向上排空气法
长颈漏斗末端要伸到液面下液封,防止生成的二氧化碳从长颈漏斗逸出。
(3)装置:
多孔隔板
控制反应的开始和停止
可以随时添加药品
控制反应速率
下述四种装置有何优点?
简单易操作
连接仪器
检查气密性
(4)操作步骤:
加稀盐酸
收集气体
加石灰石
将产生的气体通入澄清石灰水中,石灰水变浑浊则是二氧化碳。
(5)检验方法:
澄清石灰
水变浑浊
检验方法
验满方法
(6)CO2验满方法:
将燃着的木条放在瓶口,熄灭则满。
2.反应原理
3.装置
4.收集方法
6.验满方法
小结
:
二
氧
化
碳
实
验
室
制
法
向上排空气法
将气体通入澄清石灰水,若石
灰水变浑浊,则为二氧化碳。
将燃着木条放在集气瓶口,
若木条熄灭,则满。
1.药品
大理石(或石灰石)和稀盐酸
5.检验方法
7.实验步骤
碳酸钙 + 盐酸 氯化钙 + 水 +二氧化碳
07
布置作业——学生课后探究性实验
家庭创新小实验:利用家庭常见器皿和物品制取二氧化碳(带至学校检验)
Thank you!
实验室制取二氧化碳
固固加热型
固液不加热型
实验室是如何制氧气的?
知识回顾:
【复习】实验室制取氧气
药品 高锰酸钾 双氧水和二氧化锰
反应原理
反应物状态
反应条件
发生装置
收集装置
备选仪器
验证方法
验满方法
固态
固态和液态
加热
常温
A
B
C或D
把带火星的木条伸入集气瓶中,复燃则是氧气
把带火星的木条放在集气瓶口,复燃则满
实验室如何制取氧气?
药品?
反应原理?
↓
确定装置
↓
检验?
验满?
反应条件(是否需要加热)
(考虑因素)
反应物的状态
排空气法
排水法
向上排空气法
向下排空气法
(密度比空气的大)
(密度比空气的小)
发生装置
收集装置
【不易(或难)溶于水,不与水反应】
实验室里制取气体的一般思路和方法:
1.工业制法:
高温煅烧石灰石
CaCO3 CaO CO2
二氧化碳的制法
实验原理、药品探究— 对比实验
实验药品
实验现象
1.稀盐酸和碳酸钠粉末
2.稀盐酸和块状石灰石
3.稀硫酸和块状石灰石
产生大量气泡,速率较快
产生大量气泡,速率适中
刚开始有气泡产生,很快气泡就停止产生
选择药品(原理可行、来源丰富、价格适宜)
2.实验室制法:
1.为什么不用碳酸钠粉末和稀盐酸反应制取CO2
反应速率太快,难以控制,不便于操作。
2.为什么不用稀硫酸和大理石反应制取 CO2
硫酸与大理石反应生成的硫酸钙微溶于水,会覆盖在大理石的表面,使反应逐渐停止。
3.为什么不用浓盐酸和大理石反应制取CO2
4.实验室用什么样的装置制取CO2
浓盐酸易挥发,会使制得的二氧化碳中混有氯化氢气体而不纯。
一、药品:
石灰石或大理石(主要成份CaCO3)
二、反应原理:
CaCO3 + HCl → CaCl2 + H2O + CO2
制取二氧化碳的药品和原理:
和稀盐酸(主要成分为HCl)
均为混合物
密度比空气大能溶于水
不需加热
液体
固体
碳酸钙 + 盐酸 → 氯化钙 + 水 + 二氧化碳
实验室制取二氧化碳可用的简易装置是:
2、如果想在制气的过程中补充酸液,或控制酸液的加入量,可设计什么样的装置
1、如果要制取较多量的二氧化碳气体,可以把试管换成哪些仪器?
想一想:
如果还想随时控制反应的发生和停止,还可怎样设计装置呢?
想一想
固液不加热型
向上排空气法
长颈漏斗末端要伸到液面下液封,防止生成的二氧化碳从长颈漏斗逸出。
(3)装置:
多孔隔板
控制反应的开始和停止
可以随时添加药品
控制反应速率
下述四种装置有何优点?
简单易操作
连接仪器
检查气密性
(4)操作步骤:
加稀盐酸
收集气体
加石灰石
将产生的气体通入澄清石灰水中,石灰水变浑浊则是二氧化碳。
(5)检验方法:
澄清石灰
水变浑浊
检验方法
验满方法
(6)CO2验满方法:
将燃着的木条放在瓶口,熄灭则满。
2.反应原理
3.装置
4.收集方法
6.验满方法
小结
:
二
氧
化
碳
实
验
室
制
法
向上排空气法
将气体通入澄清石灰水,若石
灰水变浑浊,则为二氧化碳。
将燃着木条放在集气瓶口,
若木条熄灭,则满。
1.药品
大理石(或石灰石)和稀盐酸
5.检验方法
7.实验步骤
碳酸钙 + 盐酸 氯化钙 + 水 +二氧化碳
07
布置作业——学生课后探究性实验
家庭创新小实验:利用家庭常见器皿和物品制取二氧化碳(带至学校检验)
Thank you!
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
