高中化学苏教版2019必修一 5.1.1 元素周期律 课件(29张PPT)
文档属性
| 名称 | 高中化学苏教版2019必修一 5.1.1 元素周期律 课件(29张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 914.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-28 19:33:53 | ||
图片预览







文档简介
(共29张PPT)
第1课时 元素周期律
专题5 微观结构与物质的多样性
第一单元 元素周期律和元素周期表
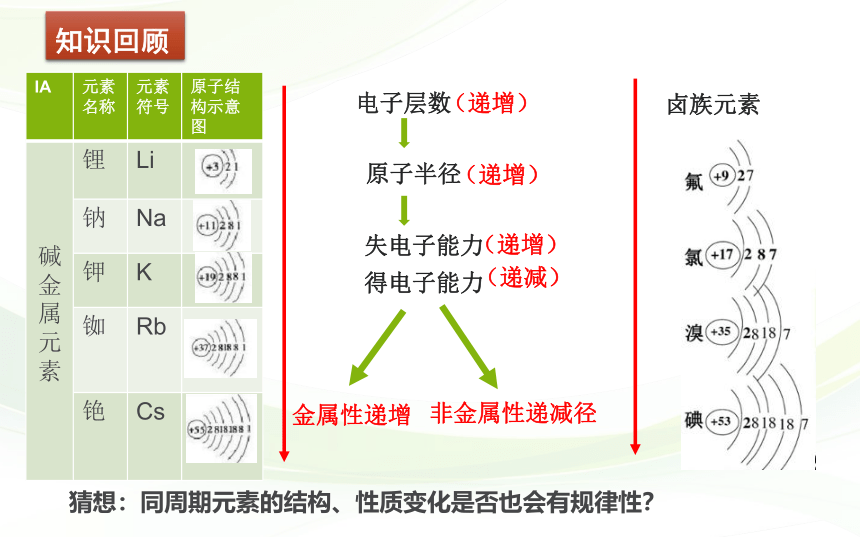
IA 元素名称 元素符号 原子结构示意图
碱金属元素 锂 Li
钠 Na
钾 K
铷 Rb
铯 Cs
电子层数
原子半径
失电子能力
得电子能力
金属性递增
非金属性递减径
卤族元素
(递增)
(递增)
(递增)
(递减)
猜想:同周期元素的结构、性质变化是否也会有规律性?
知识回顾
元素周期律(核外电子排布、原子半径、元素主要化合价、元素的金属性和非金属性的周期性变化)
考试标准
1.原子序数
(1)概念:按 由小到大的顺序给元素编号,这种编号叫原子序数。
(2)数量关系:原子序数= =核外电子数= 。
2.元素周期律
(1)定义
元素的性质随 的递增而呈 变化的规律。
(2)原子结构的周期性变化
①随着原子序数的递增,元素原子的最外层电子排布呈现 变化,除H、He元素外,最外电子层上的电子数重复出现从 递增到 的变化。
②随着原子序数的递增,元素原子半径(稀有气体除外)呈现 变化。3~9号元素、11~17号元素原子半径随着核电荷数的递增都逐渐 。
核电荷数
质子数
核电荷数
元素核电荷数
周期性
周期性
1
8
周期性
减小
知识梳理
(3)元素性质的周期性变化
①元素的化合价
a.最低和最高化合价
随着原子序数的递增,元素的最高正化合价由 递增到 (O、F除外),元素的最低负化合价按硅、磷、硫、氯的顺序,由 递增到 。
b.元素的最高化合价=原子核外 (O、F除外);元素的最低化合价=
;最高化合价+|最低化合价|= 。
②金属性和非金属性
a.Na、Mg、Al单质活动性强弱的顺序是 。
b.硅、磷、硫、氯元素的气态氢化物的形成条件和氢化物的稳定性:按硅、磷、硫、氯的顺序,随着元素核电荷数的递增,与氢气化合越来越 ,气态氢化物越来越 ,非金属性越来越 。
c.最高价氧化物对应水化物的酸碱性的强弱:从钠元素到氯元素,随着核电荷数的 ,最高价氧化物对应水化物的碱性逐渐 ,酸性逐渐 ,金属性逐渐 ,非金属性逐渐 。
+1
+7
-4
-1
最外层电子数
原子核外最外层电子数-8
8
Na>Mg>Al
容易
稳定
强
递增
减弱
增强
减弱
增强
【学有所思】 元素的性质是由什么决定的
答案:元素的性质是由原子结构决定的,可简单表示如下:
3.元素周期律实质
元素性质的周期性变化是 周期性变化的必然结果。
元素原子核外电子排布
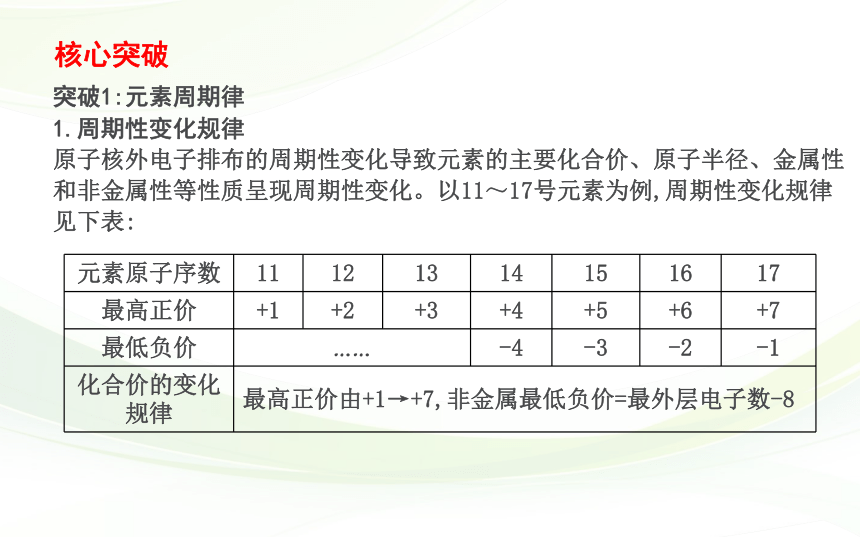
突破1:元素周期律
1.周期性变化规律
原子核外电子排布的周期性变化导致元素的主要化合价、原子半径、金属性和非金属性等性质呈现周期性变化。以11~17号元素为例,周期性变化规律见下表:
元素原子序数 11 12 13 14 15 16 17
最高正价 +1 +2 +3 +4 +5 +6 +7
最低负价 …… -4 -3 -2 -1
化合价的变化规律 最高正价由+1→+7,非金属最低负价=最外层电子数-8 核心突破
2.对元素化合价的理解
(1)原子的最外层电子数一般等于元素的最高化合价,但氧、氟除外。
(2)一般情况下,元素的最高化合价存在于最高价氧化物及其对应酸碱中,最低化合价存在于气态氢化物中。金属无负价。
(3)氟元素只有-1价与0价,没有正化合价,氧除了能与氟形成正化合价外,没有其他形式的正化合价。
(4)非金属元素都有负化合价,其最高化合价和最低化合价的关系:|最低化合价|+最高化合价=8(氢、氧、氟除外),最高化合价一般等于其原子的最外层电子数(氧、氟除外)。
原子半径的变化规律 逐渐减小
得失电子能力 失电子能力逐渐减弱,得电子能力逐渐增强
金属性和非金属性的变化规律 金属性逐渐减弱,非金属性逐渐增强
最高价氧化物对应水化物的酸碱性 碱性逐渐减弱,酸性逐渐增强
【典例1】 下列各组顺序的排列不正确的是( )
A.原子半径:F>Na>Mg>Al
B.热稳定性:HCl>H2S>PH3
C.酸性强弱:H2CO3D.碱性强弱:KOH>NaOH>Mg(OH)2
解析:电子层数越多,原子半径越大,电子层数相同时,核电荷数越大,原子半径越小,原子半径: Na>Mg>Al>F,A不正确;非金属性:Cl>S>P,非金属性越强,气态氢化物的稳定性越强,所以热稳定性:HCl>H2S>PH3,B正确;非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性: S>P>C,酸性强弱:H2CO3Na>Mg,碱性强弱:KOH>NaOH>Mg(OH)2,D正确。
A
【对点训练1】 下列说法正确的是( )
A.在元素周期表中金属与非金属分界线左边的元素均为金属元素
B.Na、Mg、Al的还原性依次减弱
C.F、Cl、Br的非金属性依次增强
D.NaOH、KOH、Mg(OH)2的碱性依次减弱
解析:在元素周期表中金属在分界线左边,但分界线左边的并不都是金属元素,如氢元素,A错;Na、Mg、Al位于同一周期,根据元素周期律,其还原性依次减弱,B正确;F、Cl、Br位于同一主族,根据元素周期律,其非金属性依次减弱,C错;K的金属性强于Na,KOH碱性强于NaOH,D错。
B
【归纳总结】 元素的化合价的判断
(1)最外层电子数=最高正化合价(O、F除外)
(2)最外层电子数-8=最低负化合价
突破2:元素金属性、非金属性强弱的判断
1.钠、镁、铝金属性强弱的比较实验
由上述实验可知
①钠、镁、铝置换出水(或酸)中的氢时,由易到难的顺序为Na>Mg>Al;
②钠、镁、铝的最高价氧化物对应的水化物的碱性由强到弱的顺序为NaOH>Mg(OH)2>Al(OH)3;
③钠、镁、铝的金属性由强到弱的顺序为Na>Mg>Al
2.硅、磷、硫、氯非金属性强弱比较
元素 Si P S Cl
最高价氧化物的化学式 SiO2 P2O5 SO3 Cl2O7
最高价氧化物对应水化物的化学式及酸性 H2SiO3 弱酸 H3PO4 中强酸 H2SO4 强酸 HClO4
酸性比
H2SO4强
单质与H2反应的条件 高温 磷蒸气与 H2能反应 加热 光照或点燃时发生爆炸而化合
氢化物的稳定性 不稳定 受热分解 受热分解 稳定
①硅、磷、硫、氯单质与氢气化合时条件由易到难的顺序为Cl>S>P>Si;
②硅、磷、硫、氯最高价氧化物对应水化物的酸性由强到弱的顺序为HClO4>H2SO4>H3PO4>H2SiO3;
③硅、磷、硫、氯元素非金属性由强到弱的顺序为Cl>S>P>Si。
3.结论:核外电子层数相同,随着原子序数(核电荷数)的递增,原子核对核外电子的引力逐渐增强,原子半径逐渐减小,元素原子的得电子能力逐渐增强,失电子能力逐渐减弱,最终导致元素的非金属性逐渐增强,金属性逐渐减弱。
【归纳总结】
1.元素金属性强弱的判断
(1)比较元素的金属性强弱,其实质是看元素原子失去电子的难易程度,越容易失去电子,金属性越强。
(2)金属单质和水或非氧化性酸反应置换出氢越容易,金属性越强;最高价氧化物对应水化物的碱性越强,金属性越强。
2.元素非金属性强弱的判断
(1)比较元素的非金属性强弱,其实质是看元素原子得到电子的难易程度,越容易得到电子,非金属性越强。
(2)单质越容易与氢气化合,生成的氢化物越稳定,非金属性越强;最高价氧化物对应水化物的酸性越强,说明其非金属性越强。
【典例2】 下列叙述中正确的是( )
A.进行H2O和H2S的热分解实验,可确定S、O两种元素的非金属性强弱
B.根据非金属性强弱F>Cl,可以推测沸点HF>HCl
C.已知2C+SiO2 Si+2CO↑,说明C的非金属性比Si强
D.H2SO3的酸性比H2CO3的酸性强,说明S的非金属性比C强
解析:非金属性越强,氢化物的稳定性越强,则进行H2O和H2S的热分解实验,可确定S、O两种元素的非金属性强弱,A正确;非金属性强弱与氢化物的沸点没有关系,B错误;已知2C+SiO2 Si+2CO↑,不能说明C的非金属性比Si强,因为该反应是难挥发性物质制备易挥发性物质,C错误;
H2SO3的酸性比H2CO3的酸性强,但亚硫酸不是最高价含氧酸,则不能说明S的非金属性比C强,D错误。
A
【对点训练2】 已知同周期X、Y、Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是HZO4>H2YO4>H3XO4,下列判断正确的是( )
A.原子半径按X、Y、Z的顺序逐渐减小
B.单质的氧化性按X、Y、Z的顺序减弱
C.三种元素阴离子的还原性按X、Y、Z的顺序增强
D.气态氢化物的稳定性按X、Y、Z的顺序减弱
解析:同周期X、Y、Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是HZO4>H2YO4>H3XO4,知X、Y、Z的原子序数为XA
【易错警示】 判断元素非金属性强弱的4个误区
(1)比较元素金属性、非金属性强弱不能根据最外层电子数的多少或电子层数的多少,而应根据得失电子的难易程度。
(2)不能通过物质的物理性质,如熔沸点、溶解性等方面比较元素金属性或非金属性强弱。
(3)氢化物的稳定性越强或还原性越弱,则元素的非金属性越强,不能认为氢化物的酸性越强,元素的非金属性越强。
(4)最高价氧化物的水化物酸性越强,元素非金属性越强,不能认为某元素氧化物的水化物酸性越强,元素非金属性越强。
突破3:微粒半径大小的比较
1.原子半径
(1)电子层数相同时,随原子序数的递增,原子半径逐渐减小。例如:Na>Mg>
Al>Si>P>S>Cl。
(2)最外层电子数相同时,随电子层递增原子半径逐渐增大。例如:Li2.离子半径
(1)同种元素的不同粒子半径:阴离子大于原子,原子大于阳离子。例如:S2->S,Na>Na+。
(2)电子层结构相同的离子,核电荷数越大,半径越小。例如:S2->Cl->K+。
(3)带相同电荷的离子,电子层数越多,半径越大。例如: K+>Na+。
(4)所带电荷、电子层数均不同的离子可选一种离子参照比较。例如:K+与Mg2+半径,可选Na+为参照,得出:K+>Na+>Mg2+。
【典例3】 下列微粒半径大小比较正确的是( )
A.Na+B.Al3+C.NaD.Cs解析:具有相同电子层结构的离子,原子序数越大,离子半径越小,则有Al3+B
【对点训练3】 下列各组微粒半径的比较错误的是( )
A.Cl-Mg2+>Na+
C.Rb>K>Na D.P>S>O
解析:核外电子排布相同的离子,核电荷数越大,半径越小,Al3+Na+,B错误。
B
【归纳总结】 微粒半径大小比较的依据
(1)“电子层数相同时”,原子序数递增,原子半径递减;“最外层电子数相同时”,电子层数递增,原子半径递增;“核外电子排布相同时”,原子序数递增,粒子半径递减。元素种类相同时,核外电子数越多,微粒半径越大。
(2)稀有气体除外的所有元素中,原子半径最小的是H,其次是F。
(3)11~18号元素中,原子半径最小的是Cl,离子半径最小的是Al3+。
1.下列叙述不正确的是( )
A.金属性:Na>Mg>Al
B.原子半径:Na>Si>Cl
C.酸性:H3PO4D.稳定性:SiH4C
解析:酸性:H3PO4考点精练
2.已知1~18号元素的离子aAm+、bBn+、cCm-、dDn-(m>n)都具有相同的电子层结构,则下列叙述正确的是( )
A.原子半径:A>B>C>D
B.原子序数:d>c>b>a
C.离子半径:Cm->Dn->Bn+>Am+
D.单质的还原性:A>B>D>C
解析:由电子层结构相同知A、B原子比C、D原子多一个电子层,而m>n说明原子序数a>b>d>c,B项错误;原子半径:B>A>C>D,A项错误;电子层数相同时,核电荷数越大,离子半径越小,C项正确;A、B是金属,且A、B电子层数相同,原子序数越大,则金属单质还原性越弱,所以还原性是B>A,D项错误。
C
3.下列事实不能说明X元素比Y元素的非金属性强的是( )
A.与H2化合时X单质比Y单质容易
B.X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物酸性强
C.X原子的最外层电子数比Y原子的最外层电子数多
D.X单质可以把Y从其氢化物中置换出来
解析:比较元素非金属性强弱判断依据有:元素与H2化合越容易,元素非金属性越强;最高价氧化物对应水化物酸性越强,元素非金属性越强;X能从Y的氢化物中置换出Y单质,说明X非金属性强于Y,所以A、B、D能说明X非金属性强于Y;而最外层电子数的多少,不能用来判断元素的非金属性强弱。
C
4.为说明氯比硫的非金属性强,下列事实可作为依据的是( )
A.HCl的溶解性强于H2S
B.氯的最高价为+7价
C.H2S中的S2-能被Cl2氧化
D.HClO的氧化性强于H2SO4
解析:比较元素非金属性的强弱,可以通过该元素与氢气化合的难易程度,生成的氢化物的稳定性的强弱,或最高价氧化物对应的水化物的酸性强弱,或置换反应的发生情况。一般情况下,活动性强的非金属能把活动性弱的非金属从其化合物中置换出来,而与氢化物的溶解性、最高化合价等无关。根据以上分析可知说明氯比硫的非金属性强的依据是H2S+Cl2 2HCl+S↓。
C
5.原子序数为11~17的元素中:
(1)原子半径最小的元素是 (填元素符号)。
(2)金属性最强的元素是 (填元素符号)。
(3)最高价氧化物对应水化物酸性最强的酸是 (用化学式回答,下同)。
(4)最不稳定的气态氢化物是 。
(5)最高价氧化物对应水化物碱性最强的是 。
解析:电子层数相同,核电荷数越大,原子半径越小,非金属性越强,核电荷数越小,金属性越强。(1)原子半径最小的是Cl。(2)金属性最强的应为Na。(3)非金属性最强的元素,其最高价氧化物对应水化物的酸性最强,氯的非金属性最强,其最高价氧化物对应的酸是HClO4。(4)非金属性最弱的Si的气态氢化物最不稳定。(5)金属性最强的Na对应的NaOH的碱性最强。
答案:(1)Cl (2)Na (3)HClO4 (4)SiH4 (5)NaOH
本节内容结束
第1课时 元素周期律
专题5 微观结构与物质的多样性
第一单元 元素周期律和元素周期表
IA 元素名称 元素符号 原子结构示意图
碱金属元素 锂 Li
钠 Na
钾 K
铷 Rb
铯 Cs
电子层数
原子半径
失电子能力
得电子能力
金属性递增
非金属性递减径
卤族元素
(递增)
(递增)
(递增)
(递减)
猜想:同周期元素的结构、性质变化是否也会有规律性?
知识回顾
元素周期律(核外电子排布、原子半径、元素主要化合价、元素的金属性和非金属性的周期性变化)
考试标准
1.原子序数
(1)概念:按 由小到大的顺序给元素编号,这种编号叫原子序数。
(2)数量关系:原子序数= =核外电子数= 。
2.元素周期律
(1)定义
元素的性质随 的递增而呈 变化的规律。
(2)原子结构的周期性变化
①随着原子序数的递增,元素原子的最外层电子排布呈现 变化,除H、He元素外,最外电子层上的电子数重复出现从 递增到 的变化。
②随着原子序数的递增,元素原子半径(稀有气体除外)呈现 变化。3~9号元素、11~17号元素原子半径随着核电荷数的递增都逐渐 。
核电荷数
质子数
核电荷数
元素核电荷数
周期性
周期性
1
8
周期性
减小
知识梳理
(3)元素性质的周期性变化
①元素的化合价
a.最低和最高化合价
随着原子序数的递增,元素的最高正化合价由 递增到 (O、F除外),元素的最低负化合价按硅、磷、硫、氯的顺序,由 递增到 。
b.元素的最高化合价=原子核外 (O、F除外);元素的最低化合价=
;最高化合价+|最低化合价|= 。
②金属性和非金属性
a.Na、Mg、Al单质活动性强弱的顺序是 。
b.硅、磷、硫、氯元素的气态氢化物的形成条件和氢化物的稳定性:按硅、磷、硫、氯的顺序,随着元素核电荷数的递增,与氢气化合越来越 ,气态氢化物越来越 ,非金属性越来越 。
c.最高价氧化物对应水化物的酸碱性的强弱:从钠元素到氯元素,随着核电荷数的 ,最高价氧化物对应水化物的碱性逐渐 ,酸性逐渐 ,金属性逐渐 ,非金属性逐渐 。
+1
+7
-4
-1
最外层电子数
原子核外最外层电子数-8
8
Na>Mg>Al
容易
稳定
强
递增
减弱
增强
减弱
增强
【学有所思】 元素的性质是由什么决定的
答案:元素的性质是由原子结构决定的,可简单表示如下:
3.元素周期律实质
元素性质的周期性变化是 周期性变化的必然结果。
元素原子核外电子排布
突破1:元素周期律
1.周期性变化规律
原子核外电子排布的周期性变化导致元素的主要化合价、原子半径、金属性和非金属性等性质呈现周期性变化。以11~17号元素为例,周期性变化规律见下表:
元素原子序数 11 12 13 14 15 16 17
最高正价 +1 +2 +3 +4 +5 +6 +7
最低负价 …… -4 -3 -2 -1
化合价的变化规律 最高正价由+1→+7,非金属最低负价=最外层电子数-8 核心突破
2.对元素化合价的理解
(1)原子的最外层电子数一般等于元素的最高化合价,但氧、氟除外。
(2)一般情况下,元素的最高化合价存在于最高价氧化物及其对应酸碱中,最低化合价存在于气态氢化物中。金属无负价。
(3)氟元素只有-1价与0价,没有正化合价,氧除了能与氟形成正化合价外,没有其他形式的正化合价。
(4)非金属元素都有负化合价,其最高化合价和最低化合价的关系:|最低化合价|+最高化合价=8(氢、氧、氟除外),最高化合价一般等于其原子的最外层电子数(氧、氟除外)。
原子半径的变化规律 逐渐减小
得失电子能力 失电子能力逐渐减弱,得电子能力逐渐增强
金属性和非金属性的变化规律 金属性逐渐减弱,非金属性逐渐增强
最高价氧化物对应水化物的酸碱性 碱性逐渐减弱,酸性逐渐增强
【典例1】 下列各组顺序的排列不正确的是( )
A.原子半径:F>Na>Mg>Al
B.热稳定性:HCl>H2S>PH3
C.酸性强弱:H2CO3
解析:电子层数越多,原子半径越大,电子层数相同时,核电荷数越大,原子半径越小,原子半径: Na>Mg>Al>F,A不正确;非金属性:Cl>S>P,非金属性越强,气态氢化物的稳定性越强,所以热稳定性:HCl>H2S>PH3,B正确;非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性: S>P>C,酸性强弱:H2CO3
A
【对点训练1】 下列说法正确的是( )
A.在元素周期表中金属与非金属分界线左边的元素均为金属元素
B.Na、Mg、Al的还原性依次减弱
C.F、Cl、Br的非金属性依次增强
D.NaOH、KOH、Mg(OH)2的碱性依次减弱
解析:在元素周期表中金属在分界线左边,但分界线左边的并不都是金属元素,如氢元素,A错;Na、Mg、Al位于同一周期,根据元素周期律,其还原性依次减弱,B正确;F、Cl、Br位于同一主族,根据元素周期律,其非金属性依次减弱,C错;K的金属性强于Na,KOH碱性强于NaOH,D错。
B
【归纳总结】 元素的化合价的判断
(1)最外层电子数=最高正化合价(O、F除外)
(2)最外层电子数-8=最低负化合价
突破2:元素金属性、非金属性强弱的判断
1.钠、镁、铝金属性强弱的比较实验
由上述实验可知
①钠、镁、铝置换出水(或酸)中的氢时,由易到难的顺序为Na>Mg>Al;
②钠、镁、铝的最高价氧化物对应的水化物的碱性由强到弱的顺序为NaOH>Mg(OH)2>Al(OH)3;
③钠、镁、铝的金属性由强到弱的顺序为Na>Mg>Al
2.硅、磷、硫、氯非金属性强弱比较
元素 Si P S Cl
最高价氧化物的化学式 SiO2 P2O5 SO3 Cl2O7
最高价氧化物对应水化物的化学式及酸性 H2SiO3 弱酸 H3PO4 中强酸 H2SO4 强酸 HClO4
酸性比
H2SO4强
单质与H2反应的条件 高温 磷蒸气与 H2能反应 加热 光照或点燃时发生爆炸而化合
氢化物的稳定性 不稳定 受热分解 受热分解 稳定
①硅、磷、硫、氯单质与氢气化合时条件由易到难的顺序为Cl>S>P>Si;
②硅、磷、硫、氯最高价氧化物对应水化物的酸性由强到弱的顺序为HClO4>H2SO4>H3PO4>H2SiO3;
③硅、磷、硫、氯元素非金属性由强到弱的顺序为Cl>S>P>Si。
3.结论:核外电子层数相同,随着原子序数(核电荷数)的递增,原子核对核外电子的引力逐渐增强,原子半径逐渐减小,元素原子的得电子能力逐渐增强,失电子能力逐渐减弱,最终导致元素的非金属性逐渐增强,金属性逐渐减弱。
【归纳总结】
1.元素金属性强弱的判断
(1)比较元素的金属性强弱,其实质是看元素原子失去电子的难易程度,越容易失去电子,金属性越强。
(2)金属单质和水或非氧化性酸反应置换出氢越容易,金属性越强;最高价氧化物对应水化物的碱性越强,金属性越强。
2.元素非金属性强弱的判断
(1)比较元素的非金属性强弱,其实质是看元素原子得到电子的难易程度,越容易得到电子,非金属性越强。
(2)单质越容易与氢气化合,生成的氢化物越稳定,非金属性越强;最高价氧化物对应水化物的酸性越强,说明其非金属性越强。
【典例2】 下列叙述中正确的是( )
A.进行H2O和H2S的热分解实验,可确定S、O两种元素的非金属性强弱
B.根据非金属性强弱F>Cl,可以推测沸点HF>HCl
C.已知2C+SiO2 Si+2CO↑,说明C的非金属性比Si强
D.H2SO3的酸性比H2CO3的酸性强,说明S的非金属性比C强
解析:非金属性越强,氢化物的稳定性越强,则进行H2O和H2S的热分解实验,可确定S、O两种元素的非金属性强弱,A正确;非金属性强弱与氢化物的沸点没有关系,B错误;已知2C+SiO2 Si+2CO↑,不能说明C的非金属性比Si强,因为该反应是难挥发性物质制备易挥发性物质,C错误;
H2SO3的酸性比H2CO3的酸性强,但亚硫酸不是最高价含氧酸,则不能说明S的非金属性比C强,D错误。
A
【对点训练2】 已知同周期X、Y、Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是HZO4>H2YO4>H3XO4,下列判断正确的是( )
A.原子半径按X、Y、Z的顺序逐渐减小
B.单质的氧化性按X、Y、Z的顺序减弱
C.三种元素阴离子的还原性按X、Y、Z的顺序增强
D.气态氢化物的稳定性按X、Y、Z的顺序减弱
解析:同周期X、Y、Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是HZO4>H2YO4>H3XO4,知X、Y、Z的原子序数为X
【易错警示】 判断元素非金属性强弱的4个误区
(1)比较元素金属性、非金属性强弱不能根据最外层电子数的多少或电子层数的多少,而应根据得失电子的难易程度。
(2)不能通过物质的物理性质,如熔沸点、溶解性等方面比较元素金属性或非金属性强弱。
(3)氢化物的稳定性越强或还原性越弱,则元素的非金属性越强,不能认为氢化物的酸性越强,元素的非金属性越强。
(4)最高价氧化物的水化物酸性越强,元素非金属性越强,不能认为某元素氧化物的水化物酸性越强,元素非金属性越强。
突破3:微粒半径大小的比较
1.原子半径
(1)电子层数相同时,随原子序数的递增,原子半径逐渐减小。例如:Na>Mg>
Al>Si>P>S>Cl。
(2)最外层电子数相同时,随电子层递增原子半径逐渐增大。例如:Li
(1)同种元素的不同粒子半径:阴离子大于原子,原子大于阳离子。例如:S2->S,Na>Na+。
(2)电子层结构相同的离子,核电荷数越大,半径越小。例如:S2->Cl->K+。
(3)带相同电荷的离子,电子层数越多,半径越大。例如: K+>Na+。
(4)所带电荷、电子层数均不同的离子可选一种离子参照比较。例如:K+与Mg2+半径,可选Na+为参照,得出:K+>Na+>Mg2+。
【典例3】 下列微粒半径大小比较正确的是( )
A.Na+
【对点训练3】 下列各组微粒半径的比较错误的是( )
A.Cl-
C.Rb>K>Na D.P>S>O
解析:核外电子排布相同的离子,核电荷数越大,半径越小,Al3+
B
【归纳总结】 微粒半径大小比较的依据
(1)“电子层数相同时”,原子序数递增,原子半径递减;“最外层电子数相同时”,电子层数递增,原子半径递增;“核外电子排布相同时”,原子序数递增,粒子半径递减。元素种类相同时,核外电子数越多,微粒半径越大。
(2)稀有气体除外的所有元素中,原子半径最小的是H,其次是F。
(3)11~18号元素中,原子半径最小的是Cl,离子半径最小的是Al3+。
1.下列叙述不正确的是( )
A.金属性:Na>Mg>Al
B.原子半径:Na>Si>Cl
C.酸性:H3PO4
解析:酸性:H3PO4
2.已知1~18号元素的离子aAm+、bBn+、cCm-、dDn-(m>n)都具有相同的电子层结构,则下列叙述正确的是( )
A.原子半径:A>B>C>D
B.原子序数:d>c>b>a
C.离子半径:Cm->Dn->Bn+>Am+
D.单质的还原性:A>B>D>C
解析:由电子层结构相同知A、B原子比C、D原子多一个电子层,而m>n说明原子序数a>b>d>c,B项错误;原子半径:B>A>C>D,A项错误;电子层数相同时,核电荷数越大,离子半径越小,C项正确;A、B是金属,且A、B电子层数相同,原子序数越大,则金属单质还原性越弱,所以还原性是B>A,D项错误。
C
3.下列事实不能说明X元素比Y元素的非金属性强的是( )
A.与H2化合时X单质比Y单质容易
B.X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物酸性强
C.X原子的最外层电子数比Y原子的最外层电子数多
D.X单质可以把Y从其氢化物中置换出来
解析:比较元素非金属性强弱判断依据有:元素与H2化合越容易,元素非金属性越强;最高价氧化物对应水化物酸性越强,元素非金属性越强;X能从Y的氢化物中置换出Y单质,说明X非金属性强于Y,所以A、B、D能说明X非金属性强于Y;而最外层电子数的多少,不能用来判断元素的非金属性强弱。
C
4.为说明氯比硫的非金属性强,下列事实可作为依据的是( )
A.HCl的溶解性强于H2S
B.氯的最高价为+7价
C.H2S中的S2-能被Cl2氧化
D.HClO的氧化性强于H2SO4
解析:比较元素非金属性的强弱,可以通过该元素与氢气化合的难易程度,生成的氢化物的稳定性的强弱,或最高价氧化物对应的水化物的酸性强弱,或置换反应的发生情况。一般情况下,活动性强的非金属能把活动性弱的非金属从其化合物中置换出来,而与氢化物的溶解性、最高化合价等无关。根据以上分析可知说明氯比硫的非金属性强的依据是H2S+Cl2 2HCl+S↓。
C
5.原子序数为11~17的元素中:
(1)原子半径最小的元素是 (填元素符号)。
(2)金属性最强的元素是 (填元素符号)。
(3)最高价氧化物对应水化物酸性最强的酸是 (用化学式回答,下同)。
(4)最不稳定的气态氢化物是 。
(5)最高价氧化物对应水化物碱性最强的是 。
解析:电子层数相同,核电荷数越大,原子半径越小,非金属性越强,核电荷数越小,金属性越强。(1)原子半径最小的是Cl。(2)金属性最强的应为Na。(3)非金属性最强的元素,其最高价氧化物对应水化物的酸性最强,氯的非金属性最强,其最高价氧化物对应的酸是HClO4。(4)非金属性最弱的Si的气态氢化物最不稳定。(5)金属性最强的Na对应的NaOH的碱性最强。
答案:(1)Cl (2)Na (3)HClO4 (4)SiH4 (5)NaOH
本节内容结束
