高中化学苏教版2019必修一 5.1.3 同主族元素的性质 课件(39张PPT)
文档属性
| 名称 | 高中化学苏教版2019必修一 5.1.3 同主族元素的性质 课件(39张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 935.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-28 19:35:35 | ||
图片预览











文档简介
(共39张PPT)
第3课时 同主族元素的性质
专题5 微观结构与物质的多样性
第一单元 元素周期律和元素周期表
学习目标
通过碱金属、卤族元素原子的结构特点,解释碱金属、卤素性质的相似性和递变性。
一、碱金属元素
1.碱金属:在元素周期表中,第ⅠA族除氢外的元素,都是金属元素,且它们对应
的碱都是强碱,所以称为碱金属。
2.原子结构
(1)碱金属元素的原子最外层电子数都是__。
(2)碱金属元素的原子随核电荷数逐渐增大,电子层数逐渐_____,原子半径逐渐
_____。
3.与水反应
碱金属元素随核电荷数的增加,_______逐渐增强。
1
增多
增大
金属性
知识梳理
【自主探索】
社会生产、科学研究和国防建设等部门,对时间的要求就高得多。它们要求时间要准到千分之一秒,甚至百万分之一秒。为了适应这些高精度的要求,人们制造出了一系列精密的计时器具,铯钟就是其中的一种。铯钟又叫“铯原子钟”。
铯属于第6周期的碱金属元素,推测金属铯与水反应的现象,写出反应的方程式并判断CsOH的碱性强弱。
提示:金属铯与水能剧烈反应,甚至发生剧烈的爆炸,反应的方程式为2Cs+2H2O
====2CsOH+H2↑,CsOH属于强碱。
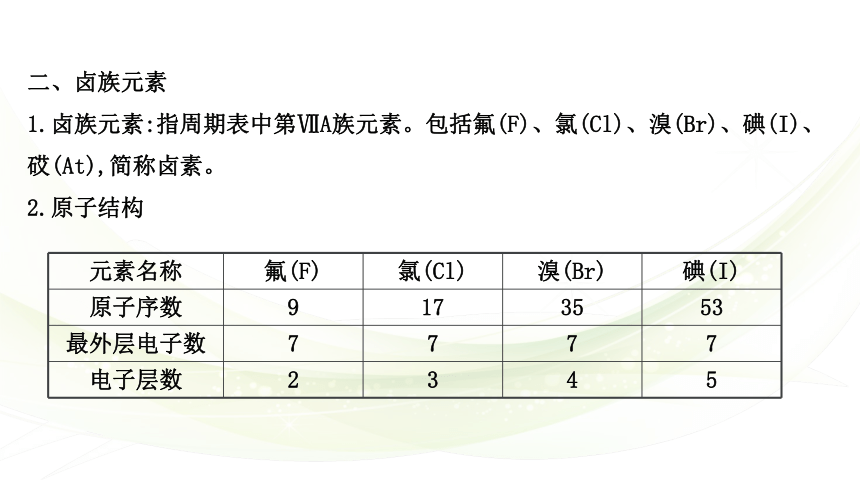
二、卤族元素
1.卤族元素:指周期表中第ⅦA族元素。包括氟(F)、氯(Cl)、溴(Br)、碘(I)、砹(At),简称卤素。
2.原子结构
元素名称 氟(F) 氯(Cl) 溴(Br) 碘(I)
原子序数 9 17 35 53
最外层电子数 7 7 7 7
电子层数 2 3 4 5
结论:卤族元素原子的最外层电子数为7,但电子层数不同,其变化规律是随着原子序数增大,电子层数逐渐增多,原子半径逐渐增大。
3.卤素单质间的置换反应
(1)Cl2、Br2、I2三种卤素单质的氧化性由_______,相应卤素离子的还原性___
_______。
(2)卤族元素随核电荷数的增加,_________逐渐减弱。
强到弱
由
弱到强
非金属性
【自主探索】
砹,原子序数85,是一种人工放射性元素,化学符号源于希腊文“astator”,原意是“改变”。1940年美国科学家科森得到了砹。砹是原子序数最大的卤族元素,根据卤素性质的递变规律,回答下列问题:
(1)推测砹在元素周期表中的位置____________。
(2)与H2化合能力:At2________I2
(3)预测砹单质的氧化性比碘单质的氧化性______(填“弱”或“强”)。
(4)砹原子的最外电子层上有________个电子。
提示:(1)第七周期ⅦA族 (2)< (3)弱 (4)7
知识点一 碱金属元素
1.物理性质:随着原子序数的递增,碱金属单质的密度逐渐增大(钾反常),熔、沸点逐渐降低。
2.化学性质
(1)相似性:碱金属原子都容易失去最外层的一个电子,化学性质活泼,它们的单质都具有较强的还原性,它们都能与氧气等非金属单质及水反应。碱金属与水反应的通式为2R+2H2O====2ROH+H2↑(R表示碱金属元素)。
(2)递变性:随着原子序数的递增,原子半径逐渐增大,原子核对最外层电子的引力逐渐减小,碱金属元素的原子失电子能力逐渐增强,金属性逐渐增强。
难点突破
②与O2的反应越来越剧烈,产物更加复杂,如Li与O2反应只能生成Li2O,Na与O2反应还可以生成 Na2O2,而K与O2反应能够生成KO2等。
③与H2O的反应越来越剧烈,如K与H2O反应可能会发生轻微爆炸,Rb与Cs遇水发生剧烈爆炸。
④最高价氧化物对应水化物的碱性逐渐增强。
即碱性:LiOH【合作探究】
1.(思维升华)碱金属钫(Fr)具有放射性,它是碱金属元素中重要的元素。试推测Fr的原子半径比铯大还是小 FrOH是强碱还是弱碱 钫能否与水反应
提示:Fr的原子半径比铯大;FrOH是强碱;钫能跟水反应生成相应的碱和氢气,由于反应剧烈而发生爆炸。
2.(情境应用)烟花的颜色是由于不同金属灼烧,发生焰色反应颜色不同造成的。 碱金属灼烧时火焰呈现特殊颜色。
(1)Li在空气中加热时的产物是什么
提示:Li2O。
(2)碳酸铯受热能分解吗
提示:碱金属的碳酸盐很稳定,受热难分解。
(3)根据钠、钾单质及其化合物的性质推测氯化铯和碳酸铯能溶于水吗
提示:能。碱金属单质及其化合物的性质具有相似性,依据NaCl(KCl)、Na2CO3(K2CO3)易溶于水推测CsCl、Cs2CO3也是易溶于水的。
【典例示范】
【典例】下列各组比较不正确的是 ( )
A.锂与水反应不如钠与水反应剧烈
B.还原性:K>Na>Li,故Na可以从LiCl溶液中置换出金属锂
C.熔、沸点:Li>Na>K
D.碱性:LiOH【解题指南】解答本题需注意以下两点:
(1)Na、K都是很活泼的金属,易与H2O反应。
(2)碱金属单质性质的相似性和递变性。
【解析】选B。锂的活泼性比钠弱,与水反应不如钠剧烈,A正确;Na不能置换出LiCl溶液中的Li,而是先与H2O反应,B错误;碱金属元素从Li到Cs,熔、沸点逐渐降低,C正确;碱性:LiOH【母题追问】
(1)锂、钠、钾、铷、铯各1 g分别与足量的水反应,其中反应最剧烈的金属是______。
提示:铯。碱金属元素从Li到Cs金属性依次增强,故反应最剧烈的金属是Cs。
(2)锂、钠、钾、铷、铯各1 g分别与足量的水反应,相同条件下,放出氢气的体积最大的是______。
提示:锂。等质量的碱金属与足量的水反应,摩尔质量越小与水反应放出H2越多,锂放出H2最多。
【方法导引】
碱金属元素性质的递变规律
(1)从原子结构角度认识
(2)对碱金属元素Li、Na、K、Rb
①熔点由高到低的顺序为Li>Na>K>Rb。
②金属性由强到弱的顺序为Rb>K>Na>Li。
③单质的还原性由强到弱的顺序为Rb>K>Na>Li。
④对应阳离子的氧化性由强到弱的顺序为Li+>Na+>K+>Rb+。
⑤最高价氧化物对应水化物的碱性由弱到强的顺序为LiOH⑥与酸或水反应的剧烈程度为Rb>K>Na>Li。
【素养训练】
钾与水剧烈反应,甚至在冰上也能着火,生成氢氧化钾和氢气,反应时放出的热量能使金属钾熔化,并引起钾和氢气燃烧。
(1)钾失火,应采取什么方法灭火
提示:用沙土、石棉等覆盖。
(2)钾燃烧时为什么看到的是黄色火焰而不是紫色火焰
提示:生产生活中常见物质中大多数含有钠元素,其焰色反应为黄色,黄色能掩盖紫色。
知识点二 卤族元素
1.物理性质:卤族元素的单质都是双原子分子,它们的物理性质随核电荷数的增
大,卤素单质的颜色变深,熔点、沸点、密度依次递增。
2.化学性质:
(1)相似性(X表示卤族元素)
卤素原子都容易得到一个电子使其最外层达到8个电子的稳定结构,它们的单质
都是活泼的非金属单质,都具有较强的氧化性,氟单质的氧化性最强。
①与H2反应:X2+H2 2HX。
②与活泼金属(如Na)反应:2Na+X2 2NaX。
③与H2O反应
a.X2+H2O====HX+HXO(X=Cl、Br、I);
b.2F2+2H2O====4HF+O2。
④与NaOH溶液反应:X2+2NaOH====NaX+NaXO+H2O(X=Cl、Br、I)。
点燃
====
(2)递变性(X表示卤族元素)
随着原子序数的递增,原子半径逐渐增大,原子核对最外层电子的引力逐渐减小,卤素原子得电子的能力逐渐减弱,非金属性逐渐减弱。
②与H2反应越来越难,对应氢化物的稳定性逐渐减弱,还原性逐渐增强,即:稳定性:HF>HCl>HBr>HI;还原性:HF③卤素单质与变价金属(如Fe)反应时,F2、Cl2、Br2生成高价卤化物(如FeX3),而I2只能生成低价卤化物(如FeI2)。
④最高价氧化物的水化物的酸性逐渐减弱,即酸性:HClO4>HBrO4>HIO4,HClO4是已知含氧酸中酸性最强的酸。
【合作探究】
1.(思维升华)试比较F、Cl、Br、I对应氢化物的稳定性,据此,能否判断F、Cl、Br、I非金属性的强弱 (证据推理与模型认知)
提示:能。稳定性HF>HCl>HBr>HI;氢化物的稳定性越强,则对应元素的非金属性越强,即非金属性强弱顺序为F>Cl>Br>I。
2.(教材二次开发)氯气能从NaBr溶液中置换出Br2,F2比Cl2活泼,F2能否从NaBr溶液中置换出Br2 (证据推理与模型认知)
提示:不能;F2能与NaBr溶液中的水反应生成HF和O2,不能从NaBr溶液中置换出Br2。
3.(情境应用)1826年,法国的一位青年波拉德把海藻烧成灰,用热水浸取,再往里通氯气,这时,就得到紫黑色的固体——碘晶体。他发现在提取后的母液底部,总沉着一层深褐色的液体,这液体具有刺鼻的臭味。详细地进行研究后证明,这深褐色的液体,是一种人们还未发现的新元素。
(1)写出波拉德获得溴、碘单质的离子方程式。(宏观辨识与微观探析)
提示:Cl2+2Br-====Br2+2Cl-,Cl2+2I-====I2+2Cl-。
(2)比较Cl-、Br-、I-的还原性强弱,并从原子结构角度解释原因。(宏观辨识与微观探析)
提示:Cl-、Br-、I-的还原性:Cl-【典例示范】
【典例】下列对卤素的说法不符合递变规律的是 ( )
A.F2、Cl2、Br2、I2的氧化性逐渐减弱
B.HF、HCl、HBr、HI的热稳定性逐渐减弱
C.F-、Cl-、Br-、I-的还原性逐渐增强
D.卤素单质按F2、Cl2、Br2、I2的顺序颜色变浅,密度增大
【解题指南】解答本题需注意以下两点:
(1)卤族元素性质上的相似性和递变性。
(2)卤族元素在性质上的特殊性。
【解析】选D。从F→I,原子半径依次增大,单质氧化性逐渐减弱,阴离子的还原性逐渐增强,氢化物的稳定性逐渐减弱,卤素单质按F2、Cl2、Br2、I2的顺序颜色变深,密度也增大。
【母题追问】(1)按HF、HCl、HBr、HI的酸性如何变化
提示:按HF、HCl、HBr、HI的酸性逐渐增强。
(2)碘单质有什么特殊性质
提示:淀粉遇碘变蓝。
【方法导引】
卤族元素性质的递变规律
(1)从原子结构角度认识
(2)对卤族元素F、Cl、Br、I
①单质熔点由高到低的顺序为I2>Br2>Cl2>F2。
②非金属性由强到弱的顺序为F>Cl>Br>I。
③单质的氧化性由强到弱的顺序为F2>Cl2>Br2>I2。
④对应简单阴离子还原性由强到弱的顺序为I->Br->Cl->F-。
⑤氢化物的稳定性由强到弱的顺序为HF>HCl>HBr>HI。
⑥与H2反应的剧烈程度为F2>Cl2>Br2>I2。
⑦最高价氧化物对应水化物的酸性由强到弱的顺序为HClO4>HBrO4>HIO4。
【素养训练】
氟是一种反应性能极高的元素,被称为“化学界顽童”。但氟一旦与其他元素结合,就会成为耐热、难以被药品和溶剂侵蚀的具有“高度安全性能”的化合物。
(1)卤素单质中氧化性最强的是哪种单质
提示:F2。
(2)F在化合物中有无正价
提示:F在化合物中只显示-1价,无正价。
【课堂小结】
课堂检测·素养达标
1.(双选)可能存在的第119号未知元素,属于第ⅠA族元素,有人称为“类钫”。根据周期表中同族元素的相似性,下列有关“类钫”的预测中错误的是
( )
A.“类钫”原子半径大于铯
B.“类钫”与O2加热反应只能生成一种氧化物
C.“类钫”在化合物中是+1价
D.“类钫”与水反应比Na与水反应缓慢
课堂达标
【解析】选B、D。碱金属元素从上到下原子半径逐渐增大,A正确;与O2反应的产物比钠反应的产物更加复杂,B错误;“类钫”位于第ⅠA 族,在化合物中的化合价为+1价,C正确;同主族元素随着核电荷数的增加,金属性逐渐增强,和水反应的激烈程度增加,D错误。
2.下列有关卤族元素的说法中,正确的是 ( )
A.酸性:HFO4>HClO4
B.最外层电子数:Br>I
C.密度:Cl2>Br2
D.热稳定性:HBr>HI
【解析】选D。氟元素无正价,无最高价含氧酸,A错误;卤族元素的最外层电子数都是7,B错误;随着原子序数的增大,卤族元素单质的密度逐渐增大,氢化物的稳定性逐渐减弱,C错误,D正确。
3.如图表示碱金属的某些性质与核电荷数的变化
关系,则下列各性质中不符合图示关系的是( )
A.还原性
B.与水反应的剧烈程度
C.熔点
D.原子半径
【解析】选C。由图可知,随着核电荷数的增大,碱金属的性质呈增大趋势,而碱
金属单质的熔、沸点随核电荷数的增大而降低。
本节内容结束
第3课时 同主族元素的性质
专题5 微观结构与物质的多样性
第一单元 元素周期律和元素周期表
学习目标
通过碱金属、卤族元素原子的结构特点,解释碱金属、卤素性质的相似性和递变性。
一、碱金属元素
1.碱金属:在元素周期表中,第ⅠA族除氢外的元素,都是金属元素,且它们对应
的碱都是强碱,所以称为碱金属。
2.原子结构
(1)碱金属元素的原子最外层电子数都是__。
(2)碱金属元素的原子随核电荷数逐渐增大,电子层数逐渐_____,原子半径逐渐
_____。
3.与水反应
碱金属元素随核电荷数的增加,_______逐渐增强。
1
增多
增大
金属性
知识梳理
【自主探索】
社会生产、科学研究和国防建设等部门,对时间的要求就高得多。它们要求时间要准到千分之一秒,甚至百万分之一秒。为了适应这些高精度的要求,人们制造出了一系列精密的计时器具,铯钟就是其中的一种。铯钟又叫“铯原子钟”。
铯属于第6周期的碱金属元素,推测金属铯与水反应的现象,写出反应的方程式并判断CsOH的碱性强弱。
提示:金属铯与水能剧烈反应,甚至发生剧烈的爆炸,反应的方程式为2Cs+2H2O
====2CsOH+H2↑,CsOH属于强碱。
二、卤族元素
1.卤族元素:指周期表中第ⅦA族元素。包括氟(F)、氯(Cl)、溴(Br)、碘(I)、砹(At),简称卤素。
2.原子结构
元素名称 氟(F) 氯(Cl) 溴(Br) 碘(I)
原子序数 9 17 35 53
最外层电子数 7 7 7 7
电子层数 2 3 4 5
结论:卤族元素原子的最外层电子数为7,但电子层数不同,其变化规律是随着原子序数增大,电子层数逐渐增多,原子半径逐渐增大。
3.卤素单质间的置换反应
(1)Cl2、Br2、I2三种卤素单质的氧化性由_______,相应卤素离子的还原性___
_______。
(2)卤族元素随核电荷数的增加,_________逐渐减弱。
强到弱
由
弱到强
非金属性
【自主探索】
砹,原子序数85,是一种人工放射性元素,化学符号源于希腊文“astator”,原意是“改变”。1940年美国科学家科森得到了砹。砹是原子序数最大的卤族元素,根据卤素性质的递变规律,回答下列问题:
(1)推测砹在元素周期表中的位置____________。
(2)与H2化合能力:At2________I2
(3)预测砹单质的氧化性比碘单质的氧化性______(填“弱”或“强”)。
(4)砹原子的最外电子层上有________个电子。
提示:(1)第七周期ⅦA族 (2)< (3)弱 (4)7
知识点一 碱金属元素
1.物理性质:随着原子序数的递增,碱金属单质的密度逐渐增大(钾反常),熔、沸点逐渐降低。
2.化学性质
(1)相似性:碱金属原子都容易失去最外层的一个电子,化学性质活泼,它们的单质都具有较强的还原性,它们都能与氧气等非金属单质及水反应。碱金属与水反应的通式为2R+2H2O====2ROH+H2↑(R表示碱金属元素)。
(2)递变性:随着原子序数的递增,原子半径逐渐增大,原子核对最外层电子的引力逐渐减小,碱金属元素的原子失电子能力逐渐增强,金属性逐渐增强。
难点突破
②与O2的反应越来越剧烈,产物更加复杂,如Li与O2反应只能生成Li2O,Na与O2反应还可以生成 Na2O2,而K与O2反应能够生成KO2等。
③与H2O的反应越来越剧烈,如K与H2O反应可能会发生轻微爆炸,Rb与Cs遇水发生剧烈爆炸。
④最高价氧化物对应水化物的碱性逐渐增强。
即碱性:LiOH
1.(思维升华)碱金属钫(Fr)具有放射性,它是碱金属元素中重要的元素。试推测Fr的原子半径比铯大还是小 FrOH是强碱还是弱碱 钫能否与水反应
提示:Fr的原子半径比铯大;FrOH是强碱;钫能跟水反应生成相应的碱和氢气,由于反应剧烈而发生爆炸。
2.(情境应用)烟花的颜色是由于不同金属灼烧,发生焰色反应颜色不同造成的。 碱金属灼烧时火焰呈现特殊颜色。
(1)Li在空气中加热时的产物是什么
提示:Li2O。
(2)碳酸铯受热能分解吗
提示:碱金属的碳酸盐很稳定,受热难分解。
(3)根据钠、钾单质及其化合物的性质推测氯化铯和碳酸铯能溶于水吗
提示:能。碱金属单质及其化合物的性质具有相似性,依据NaCl(KCl)、Na2CO3(K2CO3)易溶于水推测CsCl、Cs2CO3也是易溶于水的。
【典例示范】
【典例】下列各组比较不正确的是 ( )
A.锂与水反应不如钠与水反应剧烈
B.还原性:K>Na>Li,故Na可以从LiCl溶液中置换出金属锂
C.熔、沸点:Li>Na>K
D.碱性:LiOH
(1)Na、K都是很活泼的金属,易与H2O反应。
(2)碱金属单质性质的相似性和递变性。
【解析】选B。锂的活泼性比钠弱,与水反应不如钠剧烈,A正确;Na不能置换出LiCl溶液中的Li,而是先与H2O反应,B错误;碱金属元素从Li到Cs,熔、沸点逐渐降低,C正确;碱性:LiOH
(1)锂、钠、钾、铷、铯各1 g分别与足量的水反应,其中反应最剧烈的金属是______。
提示:铯。碱金属元素从Li到Cs金属性依次增强,故反应最剧烈的金属是Cs。
(2)锂、钠、钾、铷、铯各1 g分别与足量的水反应,相同条件下,放出氢气的体积最大的是______。
提示:锂。等质量的碱金属与足量的水反应,摩尔质量越小与水反应放出H2越多,锂放出H2最多。
【方法导引】
碱金属元素性质的递变规律
(1)从原子结构角度认识
(2)对碱金属元素Li、Na、K、Rb
①熔点由高到低的顺序为Li>Na>K>Rb。
②金属性由强到弱的顺序为Rb>K>Na>Li。
③单质的还原性由强到弱的顺序为Rb>K>Na>Li。
④对应阳离子的氧化性由强到弱的顺序为Li+>Na+>K+>Rb+。
⑤最高价氧化物对应水化物的碱性由弱到强的顺序为LiOH
【素养训练】
钾与水剧烈反应,甚至在冰上也能着火,生成氢氧化钾和氢气,反应时放出的热量能使金属钾熔化,并引起钾和氢气燃烧。
(1)钾失火,应采取什么方法灭火
提示:用沙土、石棉等覆盖。
(2)钾燃烧时为什么看到的是黄色火焰而不是紫色火焰
提示:生产生活中常见物质中大多数含有钠元素,其焰色反应为黄色,黄色能掩盖紫色。
知识点二 卤族元素
1.物理性质:卤族元素的单质都是双原子分子,它们的物理性质随核电荷数的增
大,卤素单质的颜色变深,熔点、沸点、密度依次递增。
2.化学性质:
(1)相似性(X表示卤族元素)
卤素原子都容易得到一个电子使其最外层达到8个电子的稳定结构,它们的单质
都是活泼的非金属单质,都具有较强的氧化性,氟单质的氧化性最强。
①与H2反应:X2+H2 2HX。
②与活泼金属(如Na)反应:2Na+X2 2NaX。
③与H2O反应
a.X2+H2O====HX+HXO(X=Cl、Br、I);
b.2F2+2H2O====4HF+O2。
④与NaOH溶液反应:X2+2NaOH====NaX+NaXO+H2O(X=Cl、Br、I)。
点燃
====
(2)递变性(X表示卤族元素)
随着原子序数的递增,原子半径逐渐增大,原子核对最外层电子的引力逐渐减小,卤素原子得电子的能力逐渐减弱,非金属性逐渐减弱。
②与H2反应越来越难,对应氢化物的稳定性逐渐减弱,还原性逐渐增强,即:稳定性:HF>HCl>HBr>HI;还原性:HF
④最高价氧化物的水化物的酸性逐渐减弱,即酸性:HClO4>HBrO4>HIO4,HClO4是已知含氧酸中酸性最强的酸。
【合作探究】
1.(思维升华)试比较F、Cl、Br、I对应氢化物的稳定性,据此,能否判断F、Cl、Br、I非金属性的强弱 (证据推理与模型认知)
提示:能。稳定性HF>HCl>HBr>HI;氢化物的稳定性越强,则对应元素的非金属性越强,即非金属性强弱顺序为F>Cl>Br>I。
2.(教材二次开发)氯气能从NaBr溶液中置换出Br2,F2比Cl2活泼,F2能否从NaBr溶液中置换出Br2 (证据推理与模型认知)
提示:不能;F2能与NaBr溶液中的水反应生成HF和O2,不能从NaBr溶液中置换出Br2。
3.(情境应用)1826年,法国的一位青年波拉德把海藻烧成灰,用热水浸取,再往里通氯气,这时,就得到紫黑色的固体——碘晶体。他发现在提取后的母液底部,总沉着一层深褐色的液体,这液体具有刺鼻的臭味。详细地进行研究后证明,这深褐色的液体,是一种人们还未发现的新元素。
(1)写出波拉德获得溴、碘单质的离子方程式。(宏观辨识与微观探析)
提示:Cl2+2Br-====Br2+2Cl-,Cl2+2I-====I2+2Cl-。
(2)比较Cl-、Br-、I-的还原性强弱,并从原子结构角度解释原因。(宏观辨识与微观探析)
提示:Cl-、Br-、I-的还原性:Cl-
【典例】下列对卤素的说法不符合递变规律的是 ( )
A.F2、Cl2、Br2、I2的氧化性逐渐减弱
B.HF、HCl、HBr、HI的热稳定性逐渐减弱
C.F-、Cl-、Br-、I-的还原性逐渐增强
D.卤素单质按F2、Cl2、Br2、I2的顺序颜色变浅,密度增大
【解题指南】解答本题需注意以下两点:
(1)卤族元素性质上的相似性和递变性。
(2)卤族元素在性质上的特殊性。
【解析】选D。从F→I,原子半径依次增大,单质氧化性逐渐减弱,阴离子的还原性逐渐增强,氢化物的稳定性逐渐减弱,卤素单质按F2、Cl2、Br2、I2的顺序颜色变深,密度也增大。
【母题追问】(1)按HF、HCl、HBr、HI的酸性如何变化
提示:按HF、HCl、HBr、HI的酸性逐渐增强。
(2)碘单质有什么特殊性质
提示:淀粉遇碘变蓝。
【方法导引】
卤族元素性质的递变规律
(1)从原子结构角度认识
(2)对卤族元素F、Cl、Br、I
①单质熔点由高到低的顺序为I2>Br2>Cl2>F2。
②非金属性由强到弱的顺序为F>Cl>Br>I。
③单质的氧化性由强到弱的顺序为F2>Cl2>Br2>I2。
④对应简单阴离子还原性由强到弱的顺序为I->Br->Cl->F-。
⑤氢化物的稳定性由强到弱的顺序为HF>HCl>HBr>HI。
⑥与H2反应的剧烈程度为F2>Cl2>Br2>I2。
⑦最高价氧化物对应水化物的酸性由强到弱的顺序为HClO4>HBrO4>HIO4。
【素养训练】
氟是一种反应性能极高的元素,被称为“化学界顽童”。但氟一旦与其他元素结合,就会成为耐热、难以被药品和溶剂侵蚀的具有“高度安全性能”的化合物。
(1)卤素单质中氧化性最强的是哪种单质
提示:F2。
(2)F在化合物中有无正价
提示:F在化合物中只显示-1价,无正价。
【课堂小结】
课堂检测·素养达标
1.(双选)可能存在的第119号未知元素,属于第ⅠA族元素,有人称为“类钫”。根据周期表中同族元素的相似性,下列有关“类钫”的预测中错误的是
( )
A.“类钫”原子半径大于铯
B.“类钫”与O2加热反应只能生成一种氧化物
C.“类钫”在化合物中是+1价
D.“类钫”与水反应比Na与水反应缓慢
课堂达标
【解析】选B、D。碱金属元素从上到下原子半径逐渐增大,A正确;与O2反应的产物比钠反应的产物更加复杂,B错误;“类钫”位于第ⅠA 族,在化合物中的化合价为+1价,C正确;同主族元素随着核电荷数的增加,金属性逐渐增强,和水反应的激烈程度增加,D错误。
2.下列有关卤族元素的说法中,正确的是 ( )
A.酸性:HFO4>HClO4
B.最外层电子数:Br>I
C.密度:Cl2>Br2
D.热稳定性:HBr>HI
【解析】选D。氟元素无正价,无最高价含氧酸,A错误;卤族元素的最外层电子数都是7,B错误;随着原子序数的增大,卤族元素单质的密度逐渐增大,氢化物的稳定性逐渐减弱,C错误,D正确。
3.如图表示碱金属的某些性质与核电荷数的变化
关系,则下列各性质中不符合图示关系的是( )
A.还原性
B.与水反应的剧烈程度
C.熔点
D.原子半径
【解析】选C。由图可知,随着核电荷数的增大,碱金属的性质呈增大趋势,而碱
金属单质的熔、沸点随核电荷数的增大而降低。
本节内容结束
