高中化学苏教版2019必修一 5.2.1 离子键 课件(27张PPT)
文档属性
| 名称 | 高中化学苏教版2019必修一 5.2.1 离子键 课件(27张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-28 19:42:52 | ||
图片预览





文档简介
(共27张PPT)
第1课时 离子键
专题5 微观结构与物质的多样性
第二单元 微粒之间的相互作用力
你曾否想过
一百多种元素能形成了几千万种物质,构成这些物质的微粒有哪些?这些微粒是如何彼此结合而构成物质的呢?
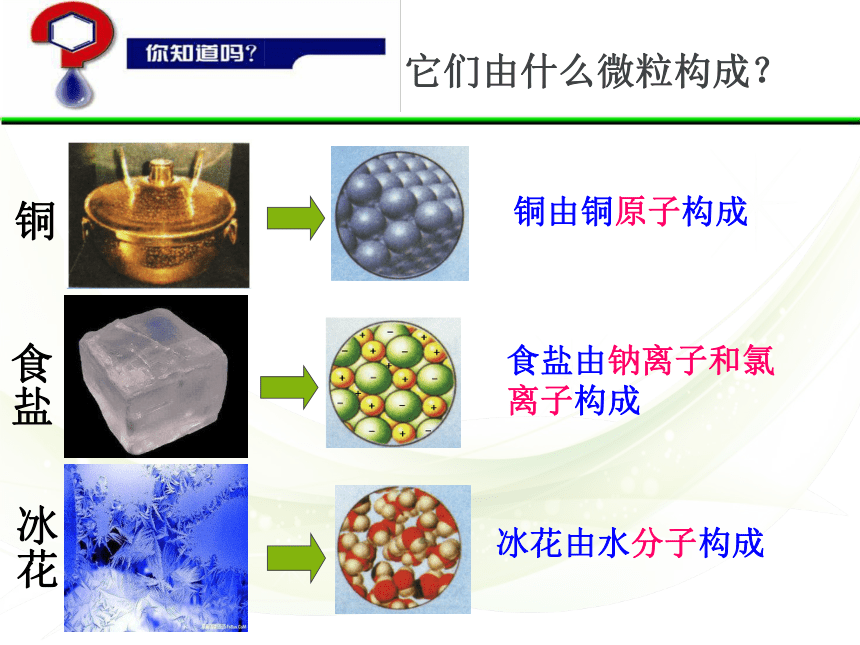
冰花由水分子构成
食盐由钠离子和氯离子构成
它们由什么微粒构成?
铜由铜原子构成
铜
冰花
食盐
1.通过NaCl的形成过程,理解离子键的形成过程与形成条件。
2.知道离子键、离子化合物的概念。?
3.能用电子式表示离子化合物的形成过程。
学习目标
活动一:感悟化学键
2、粉碎或熔化食盐晶体需要较高能量。
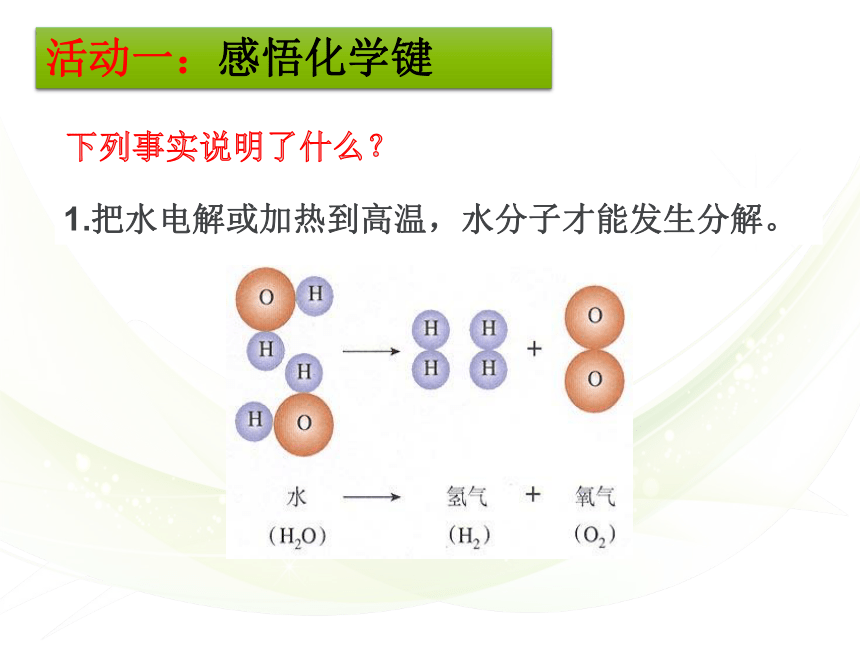
1.把水电解或加热到高温,水分子才能发生分解。
下列事实说明了什么?
2.粉碎或熔化食盐晶体需要较高能量。
食盐晶体
一、化学键
离子键和共价键是两种常见的化学键。
“键”现代汉语词典这样解释:插门的金属棍子,古称销钉。从中窥知: “键”的作用是连接物体 ,使之合而为一。
物质中直接相邻的原子或离子间强烈的相互作用。
点燃
2Na+Cl2 2NaCl
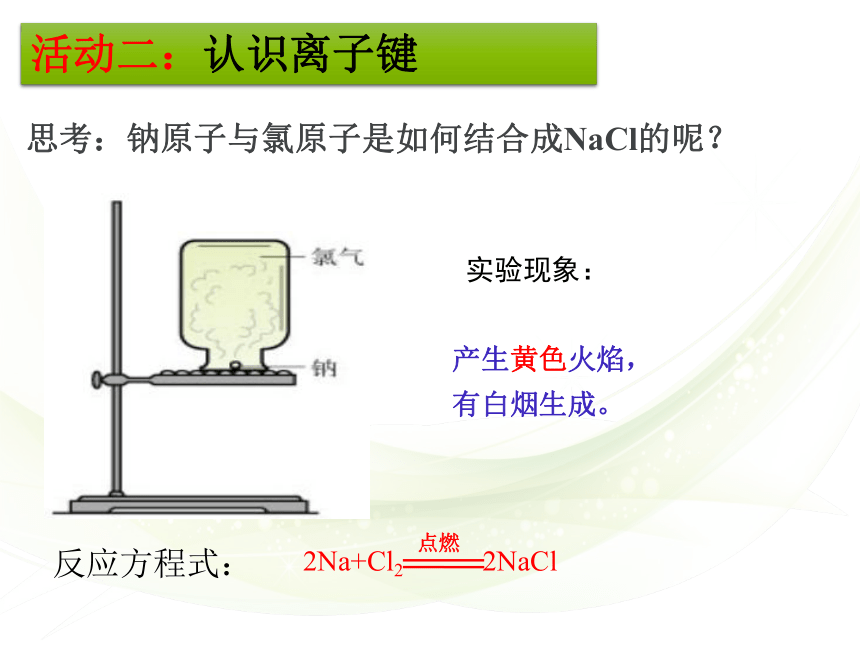
思考:钠原子与氯原子是如何结合成NaCl的呢?
活动二:认识离子键
实验现象:
产生黄色火焰,
有白烟生成。
反应方程式:
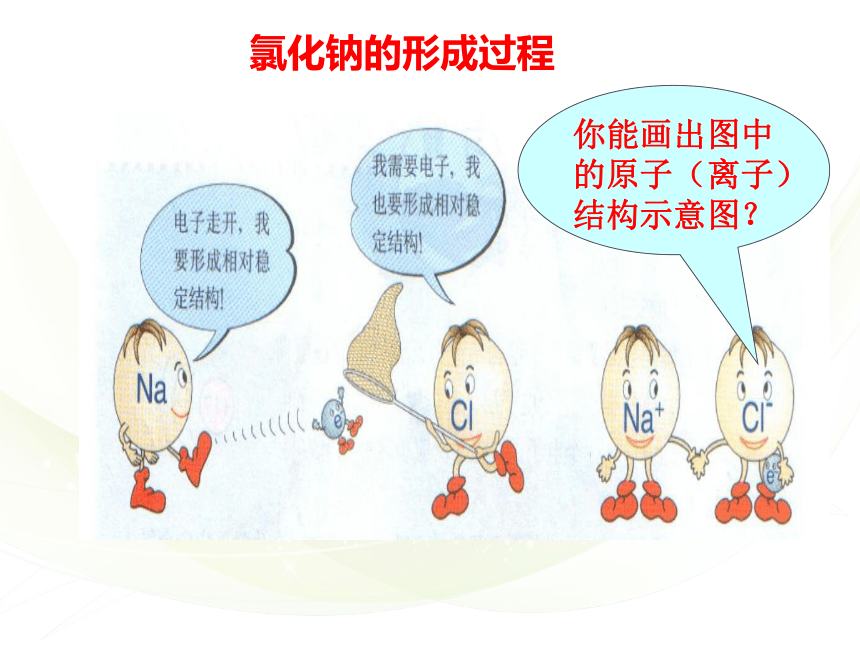
你能画出图中的原子(离子)结构示意图?
氯化钠的形成过程
问题1:在氯化钠晶体中,Na+和Cl- 之间存在哪些 作用力?
引力:Na+离子和Cl-离子间的静电相互吸引作用
斥力:电子与电子、原子核与原子核间的相互排斥作用
交流与讨论
Cl-
Na+
NaCl的晶体结构示意图
问题2:你能想象出氯化钠晶体中阴、阳离子的排列情况吗?
问题3:结合刚才的分析思考下列问题:
(1)什么是离子键?
(2)成键的微粒是什么?
(3)离子键形成的条件是什么?
(4)什么是离子化合物?
(5)常见的物质中哪些是离子化合物?
交流与讨论
使带相反电荷的阴、阳离子结合的相互作用
2.成键微粒:
3.形成条件:
二、离子键
含有离子键的化合物。
大多数的金属氧化物、盐和强碱
1.定义:
4.离子化合物:
5.常见离子化合物:
阳离子
阴离子
酸根离子、OH-
活泼的金属
活泼的非金属
铵根离子
离子化合物
SO2
NH4Cl
MgO
NaOH
NH3
CuSO4
HCl
下列物质中哪些含有离子键?哪些属于离子化合物?
H2O
学以致用
问题1:由钠原子变为钠离子、氯原子变为氯离子分析原子结构的哪部分发生变化?能否用更简便的方法表示?
Na+
Cl-
电子转移
活动三:学写电子式
问题2:请阅读课本并思考下列问题
(1)什么是电子式?
(2)如何书写原子电子式?
(3)如何书写离子电子式?
交流与讨论
三、电子式
或
Na×
1.原子电子式的写法:
··
Cl :
··
·
Na ·
在元素符号周围用小黑点(或×)标出原子最外层电子个数(均匀分散)。
在元素符号周围用小黑点(或×)来表示原子或离子的最外层电子,这种式子叫电子式。
1.试写出Mg、Al、N、S的电子式。
· Mg ·
Al ·
·
·
··
S ·
··
·
··
·
N ·
·
学以致用
2.试写出Li、C、P、Ar的电子式。
Li ·
··
Ar:
··
:
·
C ·
·
·
·
P ·
··
·
在元素符号周围标出最外层电子总数,再标 [ ] 和电荷数
Na+
Mg2+
Ca2+
简单阳离子:
简单阴离子:
阳离子的电子式就是其离子符号
[ ]
2.离子电子式的写法
试写出Na+、Al 3+、F-、S2-的电子式。
Na+、 Al 3+
[ F ]-
··
··
:
:
[ S ]2-
··
··
:
:
学以致用
3.离子化合物电子式的书写
NaCl
MgCl2
Na2S
注意:由于在离子化合物中阴阳离子是交替排列的。对于相同的离子不得合并。
Na+
Na+
Na+
2+
Mg
AB型
AB2型
A2B型
[ S ]2-
··
··
:
:
[ ]
[ ]
[ ]
课堂小结
离子键:使阴、阳离子结合成化合物的静电作用。
阴离子
阳离子
用电子式表示
离子
化合物
活泼金属原子
活泼非金属原子
失去电子
得到电子
静电作用
离子键
1.下列各数值表示有关元素的原子序数,其所表示的各 原子间能以离子键形成稳定化合物的是( )
A.10与12
B.6与16
C.14与8
D.11与17
D
Ne和Mg
C和S
Si和O
Na和Cl
当堂过关
2.下列微粒或化合物电子式错误的是( )
A.氯原子
B.氯化钙
C.硫离子
B
K+
D.氯化钾
··
Cl :
··
·
2+
Ca
2
[ Cl ]-
··
··
:
:
[ S ]2-
··
··
:
:
[ Cl ]-
··
··
:
:
3.下列说法中正确的是 ( )
A. 原子之间的相互作用叫做化学键
B.阴阳离子间的相互吸引形成离子键
C.只有金属元素和非金属元素化合时才能形成离子键
D.离子化合物一定含有离子键
D
本节内容结束
第1课时 离子键
专题5 微观结构与物质的多样性
第二单元 微粒之间的相互作用力
你曾否想过
一百多种元素能形成了几千万种物质,构成这些物质的微粒有哪些?这些微粒是如何彼此结合而构成物质的呢?
冰花由水分子构成
食盐由钠离子和氯离子构成
它们由什么微粒构成?
铜由铜原子构成
铜
冰花
食盐
1.通过NaCl的形成过程,理解离子键的形成过程与形成条件。
2.知道离子键、离子化合物的概念。?
3.能用电子式表示离子化合物的形成过程。
学习目标
活动一:感悟化学键
2、粉碎或熔化食盐晶体需要较高能量。
1.把水电解或加热到高温,水分子才能发生分解。
下列事实说明了什么?
2.粉碎或熔化食盐晶体需要较高能量。
食盐晶体
一、化学键
离子键和共价键是两种常见的化学键。
“键”现代汉语词典这样解释:插门的金属棍子,古称销钉。从中窥知: “键”的作用是连接物体 ,使之合而为一。
物质中直接相邻的原子或离子间强烈的相互作用。
点燃
2Na+Cl2 2NaCl
思考:钠原子与氯原子是如何结合成NaCl的呢?
活动二:认识离子键
实验现象:
产生黄色火焰,
有白烟生成。
反应方程式:
你能画出图中的原子(离子)结构示意图?
氯化钠的形成过程
问题1:在氯化钠晶体中,Na+和Cl- 之间存在哪些 作用力?
引力:Na+离子和Cl-离子间的静电相互吸引作用
斥力:电子与电子、原子核与原子核间的相互排斥作用
交流与讨论
Cl-
Na+
NaCl的晶体结构示意图
问题2:你能想象出氯化钠晶体中阴、阳离子的排列情况吗?
问题3:结合刚才的分析思考下列问题:
(1)什么是离子键?
(2)成键的微粒是什么?
(3)离子键形成的条件是什么?
(4)什么是离子化合物?
(5)常见的物质中哪些是离子化合物?
交流与讨论
使带相反电荷的阴、阳离子结合的相互作用
2.成键微粒:
3.形成条件:
二、离子键
含有离子键的化合物。
大多数的金属氧化物、盐和强碱
1.定义:
4.离子化合物:
5.常见离子化合物:
阳离子
阴离子
酸根离子、OH-
活泼的金属
活泼的非金属
铵根离子
离子化合物
SO2
NH4Cl
MgO
NaOH
NH3
CuSO4
HCl
下列物质中哪些含有离子键?哪些属于离子化合物?
H2O
学以致用
问题1:由钠原子变为钠离子、氯原子变为氯离子分析原子结构的哪部分发生变化?能否用更简便的方法表示?
Na+
Cl-
电子转移
活动三:学写电子式
问题2:请阅读课本并思考下列问题
(1)什么是电子式?
(2)如何书写原子电子式?
(3)如何书写离子电子式?
交流与讨论
三、电子式
或
Na×
1.原子电子式的写法:
··
Cl :
··
·
Na ·
在元素符号周围用小黑点(或×)标出原子最外层电子个数(均匀分散)。
在元素符号周围用小黑点(或×)来表示原子或离子的最外层电子,这种式子叫电子式。
1.试写出Mg、Al、N、S的电子式。
· Mg ·
Al ·
·
·
··
S ·
··
·
··
·
N ·
·
学以致用
2.试写出Li、C、P、Ar的电子式。
Li ·
··
Ar:
··
:
·
C ·
·
·
·
P ·
··
·
在元素符号周围标出最外层电子总数,再标 [ ] 和电荷数
Na+
Mg2+
Ca2+
简单阳离子:
简单阴离子:
阳离子的电子式就是其离子符号
[ ]
2.离子电子式的写法
试写出Na+、Al 3+、F-、S2-的电子式。
Na+、 Al 3+
[ F ]-
··
··
:
:
[ S ]2-
··
··
:
:
学以致用
3.离子化合物电子式的书写
NaCl
MgCl2
Na2S
注意:由于在离子化合物中阴阳离子是交替排列的。对于相同的离子不得合并。
Na+
Na+
Na+
2+
Mg
AB型
AB2型
A2B型
[ S ]2-
··
··
:
:
[ ]
[ ]
[ ]
课堂小结
离子键:使阴、阳离子结合成化合物的静电作用。
阴离子
阳离子
用电子式表示
离子
化合物
活泼金属原子
活泼非金属原子
失去电子
得到电子
静电作用
离子键
1.下列各数值表示有关元素的原子序数,其所表示的各 原子间能以离子键形成稳定化合物的是( )
A.10与12
B.6与16
C.14与8
D.11与17
D
Ne和Mg
C和S
Si和O
Na和Cl
当堂过关
2.下列微粒或化合物电子式错误的是( )
A.氯原子
B.氯化钙
C.硫离子
B
K+
D.氯化钾
··
Cl :
··
·
2+
Ca
2
[ Cl ]-
··
··
:
:
[ S ]2-
··
··
:
:
[ Cl ]-
··
··
:
:
3.下列说法中正确的是 ( )
A. 原子之间的相互作用叫做化学键
B.阴阳离子间的相互吸引形成离子键
C.只有金属元素和非金属元素化合时才能形成离子键
D.离子化合物一定含有离子键
D
本节内容结束
