鲁教版化学九年级下册课课练:第8单元 到实验室去:粗盐中难溶性杂质的去除(word版有答案)
文档属性
| 名称 | 鲁教版化学九年级下册课课练:第8单元 到实验室去:粗盐中难溶性杂质的去除(word版有答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 150.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-28 00:00:00 | ||
图片预览

文档简介
数学
化学
到实验室去
粗盐中难溶性杂质的去除
一、选择题
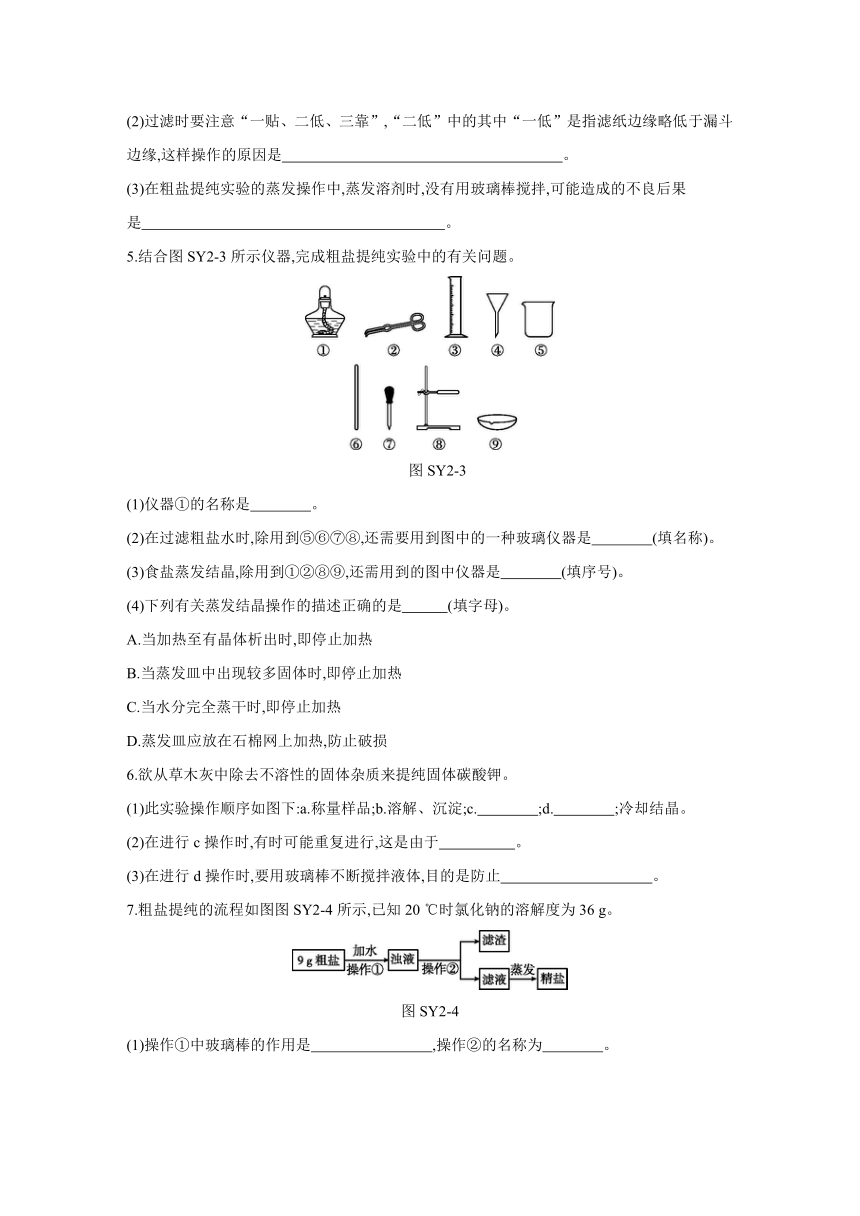
1.[2020·枣庄] “粗盐中难溶性杂质的去除”的实验中,下列操作正确的是 ( )
图SY2-1
2.[2020·宁夏改编] 下列有关“粗盐中难溶性杂质的去除”实验中的说法,不正确的是 ( )
A.多加水,让粗盐加速溶解
B.玻璃棒在过滤时的作用是引流
C.利用蒸发结晶的原因是氯化钠的溶解度受温度变化的影响小
D.当蒸发皿中出现较多固体时,停止加热,利用余热使滤液蒸干
3.下列各组物质进行分离提纯的步骤,与粗盐提纯(只除去不溶性杂质)的三个实验步骤相同的是 ( )
A.从空气中分离出氧气
B.从医用酒精中提纯酒精
C.从草木灰中提取碳酸钾(不考虑其他可溶性杂质)
D.从过氧化氢制取氧气的废液中回收二氧化锰
二、填空题
4.实验室有如图图SY2-2所示装置,回答相关问题。
图SY2-2
(1)可从食盐溶液中获得食盐固体的是 (填字母,下同),可以把粗盐浊液中的难溶物除去的是 。
(2)过滤时要注意“一贴、二低、三靠”,“二低”中的其中“一低”是指滤纸边缘略低于漏斗边缘,这样操作的原因是 。
(3)在粗盐提纯实验的蒸发操作中,蒸发溶剂时,没有用玻璃棒搅拌,可能造成的不良后果是 。
5.结合图SY2-3所示仪器,完成粗盐提纯实验中的有关问题。
图SY2-3
(1)仪器①的名称是 。
(2)在过滤粗盐水时,除用到⑤⑥⑦⑧,还需要用到图中的一种玻璃仪器是 (填名称)。
(3)食盐蒸发结晶,除用到①②⑧⑨,还需用到的图中仪器是 (填序号)。
(4)下列有关蒸发结晶操作的描述正确的是 (填字母)。
A.当加热至有晶体析出时,即停止加热
B.当蒸发皿中出现较多固体时,即停止加热
C.当水分完全蒸干时,即停止加热
D.蒸发皿应放在石棉网上加热,防止破损
6.欲从草木灰中除去不溶性的固体杂质来提纯固体碳酸钾。
(1)此实验操作顺序如图下:a.称量样品;b.溶解、沉淀;c. ;d. ;冷却结晶。
(2)在进行c操作时,有时可能重复进行,这是由于 。
(3)在进行d操作时,要用玻璃棒不断搅拌液体,目的是防止 。
7.粗盐提纯的流程如图图SY2-4所示,已知20 ℃时氯化钠的溶解度为36 g。
图SY2-4
(1)操作①中玻璃棒的作用是 ,操作②的名称为 。
(2)20 ℃时提纯9 g粗盐,若已知粗盐中氯化钠含量约为80%,现有“10 mL”“25 mL”和“100 mL”规格的量筒,溶解时应选择 mL的量筒,理由是
。
(3)提纯后的精盐属于 (填“纯净物”或“混合物”)。
8.[2020·沈阳] 为除去粗盐中混有的泥沙,某学习小组按以下步骤进行实验:(实验环境温度为20 ℃)
Ⅰ.称量与溶解;Ⅱ.过滤; Ⅲ. 。
请回答下列问题。
(1)将步骤Ⅲ补充完整。
(2)如图图SY2-5甲为氯化钠的溶解度曲线,图乙为步骤Ⅰ中的部分操作。
图SY2-5
①由图甲给出的信息可知:20 ℃时,NaCl的溶解度是 g。
②从节约能源和提高产率的角度分析,图乙中所需水的最佳体积是 mL。(提示:水的密度为1 g·mL-1;产率=×100%)
③用玻璃棒搅拌的目的是 。
(3)过滤时,若漏斗中的液面高于滤纸的边缘,造成的后果是 (填字母)。
a.过滤速度慢
b.滤纸破损
c.部分杂质未经过滤进入滤液
9.实验课上,老师指导某兴趣小组进行粗盐提纯的实验,邀请你帮助他们完成下面的实验报告。
[实验名称] 粗盐的提纯
[查阅资料]
①粗盐中含有泥沙及少量可溶性MgCl2、CaCl2、Na2SO4等杂质;
②Ba(OH)2是一种易溶于水的强碱。
[主要玻璃仪器] 量筒、烧杯、漏斗、玻璃棒、胶头滴管、酒精灯。
[主要试剂] 粗盐样品、稀盐酸、BaCl2溶液、NaOH溶液、Na2CO3溶液、蒸馏水。
[实验过程]
步骤及目的 过程及说明
(一)去除 粗盐中 的泥沙 ①称取粗盐样品10.0 g,用蒸馏水充分溶解。 ②过滤去除泥沙得溶液Ⅰ。 以上两步操作中均需要使用玻璃棒,玻璃棒的作用分别是:溶解时, ;过滤时,
(二)去除 可溶性 杂质 将溶液Ⅰ按如图图所示流程进行处理: ①加入“过量NaOH溶液”时,发生反应的化学方程式是 。 ②过滤后,所得的滤渣成分有 种。 ③判断“稀盐酸适量”的方法是
(三)获得 产品 将溶液Ⅱ倒入 (填仪器名称)中,蒸发结晶,观察到 ,停止加热,利用余热蒸干。装置完全冷却后,获得干燥的产品9.4 g
(四)数据 处理 该粗盐样品中氯化钠的质量分数是94%
[结果与反思]
①实验操作、试剂和装置均不存在问题,老师却指出该样品中氯化钠的质量分数不是94%,原因是 。
②小明提出,如图果步骤(二)中只调换“过量的NaOH溶液”与“过量的BaCl2溶液”的加入顺序,对除杂结果不会产生影响,你 (填“同意”或“不同意”)小明的观点。
答案
到实验室去
1.B 2.A 3.C
4.(1)b a (2)防止滤液从漏斗外流出
(3)液体局部温度过高,造成液滴飞溅
5.(1)酒精灯 (2)漏斗 (3)⑥ (4)B
(4)蒸发时,待蒸发皿中出现较多固体时,即停止加热,利用余热将剩余液体蒸干;蒸发皿可以直接加热。
6.(1)过滤 蒸发
(2)一次过滤不能将不溶性杂质除尽(合理即可)
(3)液体局部温度过高,造成液滴飞溅
7.(1)搅拌,加速溶解 过滤
(2)25 9 g粗盐中氯化钠的质量约为7.2 g,此温度下氯化钠全部溶解需要水约20 mL
(3)混合物
(1)据图可以看出,操作①是溶解,其中玻璃棒的作用是搅拌,加速溶解。操作②后固体和液体分离,则操作②是过滤。(2)9 g粗盐中氯化钠的质量约为9 g×80%=7.2 g,20 ℃时氯化钠的溶解度为36 g,故完全溶解7.2 g氯化钠需要水的质量约为20 g,即需水的体积约为20 mL,因此25 mL的量筒合适。(3)提纯后的精盐只是除去了不溶性固体杂质,还含有可溶性杂质,因此属于混合物。
8.(1)蒸发 (2)①36.0 ②5 ③加速固体溶解
(3)c
9.[实验过程] 搅拌,加速溶解 引流
2NaOH+MgCl2Mg(OH)2↓+2NaCl
四(或4) 盐酸逐滴加入至刚好不再产生气泡
蒸发皿 出现较多固体时
[结果与反思] ①提纯过程中反应生成了氯化钠 ②同意
[结果与反思] ②如图果步骤二中只调换“过量的NaOH溶液”与“过量的BaCl2溶液”的加入顺序,对除杂结果不会产生影响,这是因为只要碳酸钠溶液的加入顺序在氯化钡溶液之后就不会影响实验结果。
化学
到实验室去
粗盐中难溶性杂质的去除
一、选择题
1.[2020·枣庄] “粗盐中难溶性杂质的去除”的实验中,下列操作正确的是 ( )
图SY2-1
2.[2020·宁夏改编] 下列有关“粗盐中难溶性杂质的去除”实验中的说法,不正确的是 ( )
A.多加水,让粗盐加速溶解
B.玻璃棒在过滤时的作用是引流
C.利用蒸发结晶的原因是氯化钠的溶解度受温度变化的影响小
D.当蒸发皿中出现较多固体时,停止加热,利用余热使滤液蒸干
3.下列各组物质进行分离提纯的步骤,与粗盐提纯(只除去不溶性杂质)的三个实验步骤相同的是 ( )
A.从空气中分离出氧气
B.从医用酒精中提纯酒精
C.从草木灰中提取碳酸钾(不考虑其他可溶性杂质)
D.从过氧化氢制取氧气的废液中回收二氧化锰
二、填空题
4.实验室有如图图SY2-2所示装置,回答相关问题。
图SY2-2
(1)可从食盐溶液中获得食盐固体的是 (填字母,下同),可以把粗盐浊液中的难溶物除去的是 。
(2)过滤时要注意“一贴、二低、三靠”,“二低”中的其中“一低”是指滤纸边缘略低于漏斗边缘,这样操作的原因是 。
(3)在粗盐提纯实验的蒸发操作中,蒸发溶剂时,没有用玻璃棒搅拌,可能造成的不良后果是 。
5.结合图SY2-3所示仪器,完成粗盐提纯实验中的有关问题。
图SY2-3
(1)仪器①的名称是 。
(2)在过滤粗盐水时,除用到⑤⑥⑦⑧,还需要用到图中的一种玻璃仪器是 (填名称)。
(3)食盐蒸发结晶,除用到①②⑧⑨,还需用到的图中仪器是 (填序号)。
(4)下列有关蒸发结晶操作的描述正确的是 (填字母)。
A.当加热至有晶体析出时,即停止加热
B.当蒸发皿中出现较多固体时,即停止加热
C.当水分完全蒸干时,即停止加热
D.蒸发皿应放在石棉网上加热,防止破损
6.欲从草木灰中除去不溶性的固体杂质来提纯固体碳酸钾。
(1)此实验操作顺序如图下:a.称量样品;b.溶解、沉淀;c. ;d. ;冷却结晶。
(2)在进行c操作时,有时可能重复进行,这是由于 。
(3)在进行d操作时,要用玻璃棒不断搅拌液体,目的是防止 。
7.粗盐提纯的流程如图图SY2-4所示,已知20 ℃时氯化钠的溶解度为36 g。
图SY2-4
(1)操作①中玻璃棒的作用是 ,操作②的名称为 。
(2)20 ℃时提纯9 g粗盐,若已知粗盐中氯化钠含量约为80%,现有“10 mL”“25 mL”和“100 mL”规格的量筒,溶解时应选择 mL的量筒,理由是
。
(3)提纯后的精盐属于 (填“纯净物”或“混合物”)。
8.[2020·沈阳] 为除去粗盐中混有的泥沙,某学习小组按以下步骤进行实验:(实验环境温度为20 ℃)
Ⅰ.称量与溶解;Ⅱ.过滤; Ⅲ. 。
请回答下列问题。
(1)将步骤Ⅲ补充完整。
(2)如图图SY2-5甲为氯化钠的溶解度曲线,图乙为步骤Ⅰ中的部分操作。
图SY2-5
①由图甲给出的信息可知:20 ℃时,NaCl的溶解度是 g。
②从节约能源和提高产率的角度分析,图乙中所需水的最佳体积是 mL。(提示:水的密度为1 g·mL-1;产率=×100%)
③用玻璃棒搅拌的目的是 。
(3)过滤时,若漏斗中的液面高于滤纸的边缘,造成的后果是 (填字母)。
a.过滤速度慢
b.滤纸破损
c.部分杂质未经过滤进入滤液
9.实验课上,老师指导某兴趣小组进行粗盐提纯的实验,邀请你帮助他们完成下面的实验报告。
[实验名称] 粗盐的提纯
[查阅资料]
①粗盐中含有泥沙及少量可溶性MgCl2、CaCl2、Na2SO4等杂质;
②Ba(OH)2是一种易溶于水的强碱。
[主要玻璃仪器] 量筒、烧杯、漏斗、玻璃棒、胶头滴管、酒精灯。
[主要试剂] 粗盐样品、稀盐酸、BaCl2溶液、NaOH溶液、Na2CO3溶液、蒸馏水。
[实验过程]
步骤及目的 过程及说明
(一)去除 粗盐中 的泥沙 ①称取粗盐样品10.0 g,用蒸馏水充分溶解。 ②过滤去除泥沙得溶液Ⅰ。 以上两步操作中均需要使用玻璃棒,玻璃棒的作用分别是:溶解时, ;过滤时,
(二)去除 可溶性 杂质 将溶液Ⅰ按如图图所示流程进行处理: ①加入“过量NaOH溶液”时,发生反应的化学方程式是 。 ②过滤后,所得的滤渣成分有 种。 ③判断“稀盐酸适量”的方法是
(三)获得 产品 将溶液Ⅱ倒入 (填仪器名称)中,蒸发结晶,观察到 ,停止加热,利用余热蒸干。装置完全冷却后,获得干燥的产品9.4 g
(四)数据 处理 该粗盐样品中氯化钠的质量分数是94%
[结果与反思]
①实验操作、试剂和装置均不存在问题,老师却指出该样品中氯化钠的质量分数不是94%,原因是 。
②小明提出,如图果步骤(二)中只调换“过量的NaOH溶液”与“过量的BaCl2溶液”的加入顺序,对除杂结果不会产生影响,你 (填“同意”或“不同意”)小明的观点。
答案
到实验室去
1.B 2.A 3.C
4.(1)b a (2)防止滤液从漏斗外流出
(3)液体局部温度过高,造成液滴飞溅
5.(1)酒精灯 (2)漏斗 (3)⑥ (4)B
(4)蒸发时,待蒸发皿中出现较多固体时,即停止加热,利用余热将剩余液体蒸干;蒸发皿可以直接加热。
6.(1)过滤 蒸发
(2)一次过滤不能将不溶性杂质除尽(合理即可)
(3)液体局部温度过高,造成液滴飞溅
7.(1)搅拌,加速溶解 过滤
(2)25 9 g粗盐中氯化钠的质量约为7.2 g,此温度下氯化钠全部溶解需要水约20 mL
(3)混合物
(1)据图可以看出,操作①是溶解,其中玻璃棒的作用是搅拌,加速溶解。操作②后固体和液体分离,则操作②是过滤。(2)9 g粗盐中氯化钠的质量约为9 g×80%=7.2 g,20 ℃时氯化钠的溶解度为36 g,故完全溶解7.2 g氯化钠需要水的质量约为20 g,即需水的体积约为20 mL,因此25 mL的量筒合适。(3)提纯后的精盐只是除去了不溶性固体杂质,还含有可溶性杂质,因此属于混合物。
8.(1)蒸发 (2)①36.0 ②5 ③加速固体溶解
(3)c
9.[实验过程] 搅拌,加速溶解 引流
2NaOH+MgCl2Mg(OH)2↓+2NaCl
四(或4) 盐酸逐滴加入至刚好不再产生气泡
蒸发皿 出现较多固体时
[结果与反思] ①提纯过程中反应生成了氯化钠 ②同意
[结果与反思] ②如图果步骤二中只调换“过量的NaOH溶液”与“过量的BaCl2溶液”的加入顺序,对除杂结果不会产生影响,这是因为只要碳酸钠溶液的加入顺序在氯化钡溶液之后就不会影响实验结果。
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
