鲁教版化学九年级下册课课练:第7单元 常见的酸和碱 自我综合评价(word版 有答案)
文档属性
| 名称 | 鲁教版化学九年级下册课课练:第7单元 常见的酸和碱 自我综合评价(word版 有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 183.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-28 22:08:26 | ||
图片预览



文档简介
数学
化学
自我综合评价
第七单元
可能用到的相对原子质量:H-1 O-16 S-32 Cl-35.5 Fe-56 Ba-137
一、选择题(本大题共15个小题,每小题2分,共30分)
1.[2020·自贡] 下列物质属于酸的是 ( )
A.P2O5 B.NaHCO3 C.NH3·H2O D.CH3COOH
2.[2020·金昌] 下列物质露置在空气中,质量会减少的是 ( )
A.生石灰 B.苛性钠 C.浓硫酸 D.浓盐酸
3.[2020·黄石] 下列常见物质显碱性的是 ( )
A.食醋 B.食盐水
C.肥皂水 D.柠檬水
4.下列是一些生活物品的近似pH,其中酸性最强的是 ( )
A.酱油 pH=4.5 B.牛奶 pH=6.5
C.鸡蛋清 pH=7.8 D.厨房的清洁剂 pH=12.5
5.下列关于氢氧化钠的描述中不正确的是 ( )
A.露置在空气中易潮解 B.能与酸发生中和反应
C.其水溶液能使石蕊试液变红 D.对皮肤有强烈的腐蚀作用
6.下列关于氢氧化钙的描述中错误的是 ( )
A.微溶于水,能导电
B.对皮肤、衣服等有腐蚀作用
C.水溶液能使紫色石蕊试液变红
D.将氢氧化钙与黏土、沙子等混合,用作建筑材料
7.[2020·扬州] 硫酸是一种重要的工业原料,下列说法不正确的是 ( )
A.浓硫酸可用于干燥O2 B.浓硫酸可使纸张碳化
C.稀释浓硫酸时可将水直接倒入 D.稀硫酸可用于金属表面除锈
8.化学课上,老师在滤纸上用酚酞试液画漫画(如图所示),然后再喷洒某种液体X,滤纸上立即显示出红色图像,则X可能是 ( )
A.稀盐酸 B.蒸馏水
C.石灰水 D.食盐水
9.下列反应属于中和反应的是 ( )
A.Zn+2HClZnCl2+H2↑ B.CuO+2HClCuCl2+H2O
C.Cu(OH)2+H2SO4CuSO4+2H2O D.SO2+2NaOHNa2SO3+H2O
10.某同学用洁净干燥的玻璃棒蘸取盐酸滴在湿润的pH试纸上,测得pH=3,他判断这是一种酸性溶液,对他的操作方法、测量结果及结论的评价,正确的是 ( )
A.方法正确,测量结果正确,结论正确 B.方法错误,测量结果偏小,结论正确
C.方法错误,测量结果偏大,结论错误 D.方法错误,测量结果偏大,结论正确
11.蚂蚁等昆虫叮咬人时,会向人体注入一种物质R,使皮肤红肿。实验测定物质R呈酸性,由此推断,要消除红肿,可涂抹下列物质中的 ( )
A.食醋 B.肥皂水
C.氢氧化钠溶液 D.稀盐酸
12.[2020·泸州] 下列物质不能与NaOH溶液反应的是 ( )
A.二氧化碳 B.硝酸 C.硫酸铜 D.氢氧化铁
13.氢氧化钠溶液和稀盐酸恰好完全反应,有关说法正确的是 ( )
A.反应后溶液中的粒子只有Na+、Cl-和H2O
B.反应前后溶剂质量不变
C.该反应的实质是钠离子和氯离子的反应
D.反应前后阴、阳离子总数不变
14.某“问题藕”切开有一股难闻的酸味,估计含有硫酸或盐酸中的一种。管理人员榨取其液汁进行实验。有关说法正确的是 ( )
A.加入紫色石蕊试液,变成蓝色
B.用pH试纸测试,pH在9~10之间
C.选择碳酸钠溶液进行鉴别,若产生气泡,则证明含有硫酸
D.选择氯化钡溶液进行鉴别,若无明显现象,则证明含有盐酸
15.向盛有50 mL稀硫酸的烧杯中,缓慢滴加一定溶质质量分数的氢氧化钡溶液至过量。随着氢氧化钡溶液的滴加,某些量的变化趋势正确的是 ( )
二、填空题 (共34分)
16.(3分)现有三瓶失去标签的无色溶液,分别为盐酸、氯化钠溶液和澄清石灰水中的一种。
(1)向三种无色溶液中加入某种指示剂即可区分它们,该指示剂可选用 。
(2)装澄清石灰水的试剂瓶瓶口常出现白膜,白膜的主要成分的化学式为 。
(3)上述溶液中属于盐溶液的是 。
17. (5分)结合氢氧化钠和氢氧化钙的相关知识,回答下列问题。
(1)在牙膏中,常用轻质碳酸钙粉末作摩擦剂。人们通常用下列方法制轻质碳酸钙:①将石灰石煅烧;②加水制成石灰乳;③净化后与二氧化碳作用得到碳酸钙。试用化学方程式表示上述反应①③的原理: ; 。
(2)可用来改良酸性土壤的固体是 。
(3)从微观角度看,它们的溶液具有相似化学性质的原因是 。
(4)除去NaOH溶液中混有的少量Ca(OH)2,可选用的试剂是 。
18.(4分)某兴趣小组同学分别向下列试剂中滴加自制紫甘蓝汁,现象记录如图下表。
试剂 稀盐酸 氢氧化钠溶液 蒸馏水 白醋 草木灰(K2CO3)溶液
滴加2滴紫甘蓝汁后的颜色 红色 绿色 紫色 红色 绿色
(1)紫甘蓝汁 (填“能”或“不能”)作酸碱指示剂。
(2)草木灰溶液呈 (填“酸性”“中性”或“碱性”),溶液显碱性的 (填“一定”或“不一定”)是碱溶液。
(3)向蒸馏水中滴加紫甘蓝汁的目的是 。
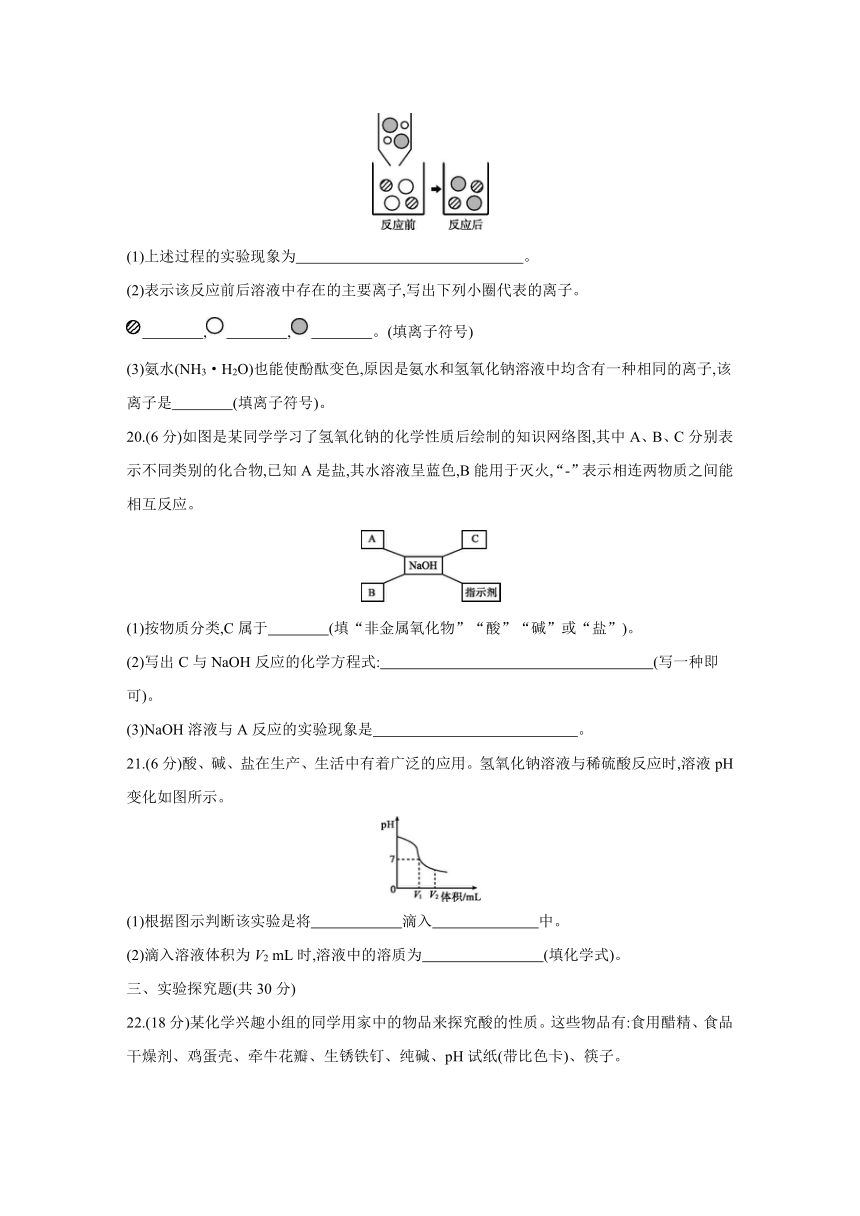
19. (10分)向滴有几滴酚酞试液的氢氧化钠溶液中滴加稀盐酸至恰好完全反应。
(1)上述过程的实验现象为 。
(2)表示该反应前后溶液中存在的主要离子,写出下列小圈代表的离子。
, , 。(填离子符号)
(3)氨水(NH3·H2O)也能使酚酞变色,原因是氨水和氢氧化钠溶液中均含有一种相同的离子,该离子是 (填离子符号)。
20.(6分)如图是某同学学习了氢氧化钠的化学性质后绘制的知识网络图,其中A、B、C分别表示不同类别的化合物,已知A是盐,其水溶液呈蓝色,B能用于灭火,“-”表示相连两物质之间能相互反应。
(1)按物质分类,C属于 (填“非金属氧化物”“酸”“碱”或“盐”)。
(2)写出C与NaOH反应的化学方程式: (写一种即可)。
(3)NaOH溶液与A反应的实验现象是 。
21.(6分)酸、碱、盐在生产、生活中有着广泛的应用。氢氧化钠溶液与稀硫酸反应时,溶液pH变化如图所示。
(1)根据图示判断该实验是将 滴入 中。
(2)滴入溶液体积为V2 mL时,溶液中的溶质为 (填化学式)。
三、实验探究题(共30分)
22.(18分)某化学兴趣小组的同学用家中的物品来探究酸的性质。这些物品有:食用醋精、食品干燥剂、鸡蛋壳、牵牛花瓣、生锈铁钉、纯碱、pH试纸(带比色卡)、筷子。
[查阅资料] (1)食用醋精中含有10%~15%的醋酸(CH3COOH),呈无色;食品干燥剂的主要成分是氧化钙;鸡蛋壳的主要成分是碳酸钙。
(2)牵牛花汁液在酸性溶液中显红色,在中性溶液中显紫色,在碱性溶液中显蓝色。
[实验探究]
实验步骤 实验现象 实验结论
①将牵牛花汁液滴入醋精中 酸能与指示剂作用
②将生锈铁钉放入醋精中 铁锈逐渐消失,溶液变为 色 酸能与某些金属氧化物反应
一段时间后有气泡冒出 酸能与某些 反应
③将碎鸡蛋壳放入醋精中 有 冒出 酸能与某些盐反应
④将纯碱(Na2CO3)放入醋精中 有气泡冒出 酸能与碱反应
[反思与评价] 小明认为步骤④不能得到“酸能与碱反应”的结论,理由是 。
[实验验证] 小明重新设计以下方案验证“酸能与碱反应”。
实验步骤 实验现象 化学方程式
①向食品干燥剂中加入适量的水,充分反应后,静置,取上层清液 热量
②向上层清液中加入牵牛花汁液,再逐滴滴入醋精至过量
23.(12分)在实验课上,同学们将CO2通入Ca(OH)2溶液中,观察到有白色沉淀生成;而将CO2通入NaOH溶液中,无明显现象。
[提出问题] CO2与NaOH溶液是否发生了化学反应
[作出猜想] CO2与NaOH溶液发生了化学反应。
[实验探究] 小明设计了如图所示四种实验,其共同原理是CO2和NaOH溶液反应,使容器内压强减小。
(1)实验现象:A中试管内液面上升,B中 ,C中 ,D中水槽中的水部分进入烧瓶中。
(2)小宁对小明的方案提出了疑问,他认为小明的实验不严谨,其理由是 。要得到科学严谨的结论,若利用方案A,应补做的对比实验是 。
(3)小丽的改进方案是利用反应后的溶液来验证猜想,请完成实验报告。
实验操作 实验现象 实验结论
向实验后的溶液中加入足量稀盐酸 猜想正确
[得出结论] CO2与NaOH溶液发生了化学反应,请写出CO2与NaOH溶液反应的化学方程式: 。
四、计算题(共6分)
24. [2020·泰安改编] 请你仔细分析所示的实验过程和提供的数据,并进行计算。
(1)反应后烧杯中溶液质量。
(2)反应后所得溶液的溶质质量分数(写出计算过程,精确到0.1%)。
答案
自我综合评价(一)
1.D P2O5属于氧化物,NaHCO3属于盐,NH3·H2O属于碱,CH3COOH属于酸。
2.D 3.C
4.A 当溶液的pH小于7时,呈酸性,随着pH的减小,酸性增强,酱油、牛奶的pH都小于7,呈酸性,但是酱油的pH更小,所以酸性更强。
5.C 6.C 7.C
8.C 石灰水显碱性,能使酚酞试液变红。
9.C
10.D 当溶液的pH小于7时,呈酸性,且pH越小,酸性越强。用洁净干燥的玻璃棒蘸取盐酸滴在湿润的pH试纸上,相当于稀释了待测溶液,使溶液的酸性减弱,测定结果偏大,但结论正确。
11.B 12.D 13.A
14.D 液汁含有酸,显酸性,加入紫色石蕊试液,会变成红色,pH应小于7;碳酸钠溶液与硫酸和盐酸反应都会生成二氧化碳气体,所以无法证明含有哪种酸;加入氯化钡溶液后如图果有白色沉淀生成,说明生成了硫酸钡,则该酸为硫酸,如图果无明显现象,则证明含有盐酸。
15.D 将氢氧化钡溶液加入稀硫酸中,发生反应的化学方程式为H2SO4 +Ba(OH)2 BaSO4↓+2H2O。随着氢氧化钡的加入,生成的沉淀越来越多,烧杯中溶液的溶质会越来越少,恰好反应时溶质质量为零,氢氧化钡过量后,随着氢氧化钡的加入,溶质会越来越多;稀硫酸显酸性,pH小于7,随着氢氧化钡溶液的加入,烧杯中溶液的pH会越来越大,恰好完全反应时,pH等于7,氢氧化钡过量时pH大于7,但不会一直增大,最后接近原氢氧化钡溶液的pH;反应没有气体放出,随着氢氧化钡溶液的加入,烧杯中物质的总质量越来越大;反应生成硫酸钡沉淀,沉淀的质量从零开始增加,至反应结束后不再改变。
16.(1)紫色石蕊试液 (2)CaCO3
(3)氯化钠溶液
(1)紫色石蕊试液在酸、碱、盐中可以显示不同的颜色。取样品,滴入石蕊试液,溶液显红色的是盐酸,显紫色的是氯化钠溶液,显蓝色的是澄清石灰水。(2)氢氧化钙和空气中的二氧化碳反应会生成白色的碳酸钙沉淀,所以装澄清石灰水的试剂瓶瓶口常出现白膜,白膜的主要成分的化学式为CaCO3。(3)盐是由金属阳离子和酸根阴离子构成的化合物,所以属于盐的是氯化钠溶液。
17.(1)CaCO3CaO+CO2↑
CO2+Ca(OH)2CaCO3↓+H2O
(2)Ca(OH)2
(3)解离出的阴离子都是OH-
(4)Na2CO3 溶液
18.(1)能 (2)碱性 不一定 (3)作对照实验
(1)稀盐酸显酸性,能使紫甘蓝汁由紫色变成红色;氢氧化钠溶液显碱性,能使紫甘蓝汁由紫色变成绿色,所以紫甘蓝汁可以作酸碱指示剂。(2)草木灰溶液能使紫甘蓝汁由紫色变成绿色,所以草木灰溶液显碱性;草木灰的主要成分是碳酸钾,碳酸钾属于盐,故显碱性的溶液不一定是碱溶液。(3)向蒸馏水中滴加紫甘蓝汁的目的是验证水不能使紫甘蓝汁变色,起到了空白对照的作用。
19.(1)溶液由红色变为无色
(2)Na+ OH- Cl- (3)OH-
20.(1)酸
(2)HCl+NaOHNaCl+H2O(合理即可)
(3)有蓝色沉淀生成
21.(1)稀硫酸 氢氧化钠溶液 (2)H2SO4、Na2SO4
(1)由图像可知,pH开始时大于7,随滴入溶液体积的增加而逐渐减小,最后小于7,可知原溶液显碱性,不断加入酸性溶液,使pH减小,说明是把稀硫酸滴加到氢氧化钠溶液中。(2)滴入溶液体积为V2 mL时,溶液的pH小于7,溶液显酸性,说明稀硫酸过量,所得溶液中的溶质为H2SO4、Na2SO4。
22.[实验探究] ①牵牛花汁变成红色 ②黄 金属 ③气泡
[反思与评价] 纯碱(Na2CO3)不是碱,而是盐
[实验验证] ①放出 CaO+H2OCa(OH)2
②溶液先由无色变为蓝色,随着醋精的加入,溶液变为紫色,最后变为红色
Ca(OH)2+2CH3COOH(CH3COO)2Ca+2H2O
23.[实验探究] (1)软塑料瓶变瘪 气球胀大
(2)CO2能溶于水且能与水反应生成碳酸,也会导致容器内压强减小 取等体积的试管充满CO2,倒扣在与氢氧化钠溶液等体积的水中
(3)有气泡产生
[得出结论] CO2+2NaOHNa2CO3+H2O
24.解:(1)设反应生成氯化亚铁的质量为x,生成氢气的质量为y。
Fe+2HClFeCl2+H2↑
56 127 2
11.2 g x y
= x=25.4 g
= y=0.4 g
反应后烧杯中溶液质量为11.2 g+189.2 g-0.4 g=200 g 。
(2)反应后所得溶液的溶质质量分数为×100%=12.7%。
答:(1)反应后烧杯中溶液质量为200 g;(2)反应后所得溶液的溶质质量分数是12.7%。
化学
自我综合评价
第七单元
可能用到的相对原子质量:H-1 O-16 S-32 Cl-35.5 Fe-56 Ba-137
一、选择题(本大题共15个小题,每小题2分,共30分)
1.[2020·自贡] 下列物质属于酸的是 ( )
A.P2O5 B.NaHCO3 C.NH3·H2O D.CH3COOH
2.[2020·金昌] 下列物质露置在空气中,质量会减少的是 ( )
A.生石灰 B.苛性钠 C.浓硫酸 D.浓盐酸
3.[2020·黄石] 下列常见物质显碱性的是 ( )
A.食醋 B.食盐水
C.肥皂水 D.柠檬水
4.下列是一些生活物品的近似pH,其中酸性最强的是 ( )
A.酱油 pH=4.5 B.牛奶 pH=6.5
C.鸡蛋清 pH=7.8 D.厨房的清洁剂 pH=12.5
5.下列关于氢氧化钠的描述中不正确的是 ( )
A.露置在空气中易潮解 B.能与酸发生中和反应
C.其水溶液能使石蕊试液变红 D.对皮肤有强烈的腐蚀作用
6.下列关于氢氧化钙的描述中错误的是 ( )
A.微溶于水,能导电
B.对皮肤、衣服等有腐蚀作用
C.水溶液能使紫色石蕊试液变红
D.将氢氧化钙与黏土、沙子等混合,用作建筑材料
7.[2020·扬州] 硫酸是一种重要的工业原料,下列说法不正确的是 ( )
A.浓硫酸可用于干燥O2 B.浓硫酸可使纸张碳化
C.稀释浓硫酸时可将水直接倒入 D.稀硫酸可用于金属表面除锈
8.化学课上,老师在滤纸上用酚酞试液画漫画(如图所示),然后再喷洒某种液体X,滤纸上立即显示出红色图像,则X可能是 ( )
A.稀盐酸 B.蒸馏水
C.石灰水 D.食盐水
9.下列反应属于中和反应的是 ( )
A.Zn+2HClZnCl2+H2↑ B.CuO+2HClCuCl2+H2O
C.Cu(OH)2+H2SO4CuSO4+2H2O D.SO2+2NaOHNa2SO3+H2O
10.某同学用洁净干燥的玻璃棒蘸取盐酸滴在湿润的pH试纸上,测得pH=3,他判断这是一种酸性溶液,对他的操作方法、测量结果及结论的评价,正确的是 ( )
A.方法正确,测量结果正确,结论正确 B.方法错误,测量结果偏小,结论正确
C.方法错误,测量结果偏大,结论错误 D.方法错误,测量结果偏大,结论正确
11.蚂蚁等昆虫叮咬人时,会向人体注入一种物质R,使皮肤红肿。实验测定物质R呈酸性,由此推断,要消除红肿,可涂抹下列物质中的 ( )
A.食醋 B.肥皂水
C.氢氧化钠溶液 D.稀盐酸
12.[2020·泸州] 下列物质不能与NaOH溶液反应的是 ( )
A.二氧化碳 B.硝酸 C.硫酸铜 D.氢氧化铁
13.氢氧化钠溶液和稀盐酸恰好完全反应,有关说法正确的是 ( )
A.反应后溶液中的粒子只有Na+、Cl-和H2O
B.反应前后溶剂质量不变
C.该反应的实质是钠离子和氯离子的反应
D.反应前后阴、阳离子总数不变
14.某“问题藕”切开有一股难闻的酸味,估计含有硫酸或盐酸中的一种。管理人员榨取其液汁进行实验。有关说法正确的是 ( )
A.加入紫色石蕊试液,变成蓝色
B.用pH试纸测试,pH在9~10之间
C.选择碳酸钠溶液进行鉴别,若产生气泡,则证明含有硫酸
D.选择氯化钡溶液进行鉴别,若无明显现象,则证明含有盐酸
15.向盛有50 mL稀硫酸的烧杯中,缓慢滴加一定溶质质量分数的氢氧化钡溶液至过量。随着氢氧化钡溶液的滴加,某些量的变化趋势正确的是 ( )
二、填空题 (共34分)
16.(3分)现有三瓶失去标签的无色溶液,分别为盐酸、氯化钠溶液和澄清石灰水中的一种。
(1)向三种无色溶液中加入某种指示剂即可区分它们,该指示剂可选用 。
(2)装澄清石灰水的试剂瓶瓶口常出现白膜,白膜的主要成分的化学式为 。
(3)上述溶液中属于盐溶液的是 。
17. (5分)结合氢氧化钠和氢氧化钙的相关知识,回答下列问题。
(1)在牙膏中,常用轻质碳酸钙粉末作摩擦剂。人们通常用下列方法制轻质碳酸钙:①将石灰石煅烧;②加水制成石灰乳;③净化后与二氧化碳作用得到碳酸钙。试用化学方程式表示上述反应①③的原理: ; 。
(2)可用来改良酸性土壤的固体是 。
(3)从微观角度看,它们的溶液具有相似化学性质的原因是 。
(4)除去NaOH溶液中混有的少量Ca(OH)2,可选用的试剂是 。
18.(4分)某兴趣小组同学分别向下列试剂中滴加自制紫甘蓝汁,现象记录如图下表。
试剂 稀盐酸 氢氧化钠溶液 蒸馏水 白醋 草木灰(K2CO3)溶液
滴加2滴紫甘蓝汁后的颜色 红色 绿色 紫色 红色 绿色
(1)紫甘蓝汁 (填“能”或“不能”)作酸碱指示剂。
(2)草木灰溶液呈 (填“酸性”“中性”或“碱性”),溶液显碱性的 (填“一定”或“不一定”)是碱溶液。
(3)向蒸馏水中滴加紫甘蓝汁的目的是 。
19. (10分)向滴有几滴酚酞试液的氢氧化钠溶液中滴加稀盐酸至恰好完全反应。
(1)上述过程的实验现象为 。
(2)表示该反应前后溶液中存在的主要离子,写出下列小圈代表的离子。
, , 。(填离子符号)
(3)氨水(NH3·H2O)也能使酚酞变色,原因是氨水和氢氧化钠溶液中均含有一种相同的离子,该离子是 (填离子符号)。
20.(6分)如图是某同学学习了氢氧化钠的化学性质后绘制的知识网络图,其中A、B、C分别表示不同类别的化合物,已知A是盐,其水溶液呈蓝色,B能用于灭火,“-”表示相连两物质之间能相互反应。
(1)按物质分类,C属于 (填“非金属氧化物”“酸”“碱”或“盐”)。
(2)写出C与NaOH反应的化学方程式: (写一种即可)。
(3)NaOH溶液与A反应的实验现象是 。
21.(6分)酸、碱、盐在生产、生活中有着广泛的应用。氢氧化钠溶液与稀硫酸反应时,溶液pH变化如图所示。
(1)根据图示判断该实验是将 滴入 中。
(2)滴入溶液体积为V2 mL时,溶液中的溶质为 (填化学式)。
三、实验探究题(共30分)
22.(18分)某化学兴趣小组的同学用家中的物品来探究酸的性质。这些物品有:食用醋精、食品干燥剂、鸡蛋壳、牵牛花瓣、生锈铁钉、纯碱、pH试纸(带比色卡)、筷子。
[查阅资料] (1)食用醋精中含有10%~15%的醋酸(CH3COOH),呈无色;食品干燥剂的主要成分是氧化钙;鸡蛋壳的主要成分是碳酸钙。
(2)牵牛花汁液在酸性溶液中显红色,在中性溶液中显紫色,在碱性溶液中显蓝色。
[实验探究]
实验步骤 实验现象 实验结论
①将牵牛花汁液滴入醋精中 酸能与指示剂作用
②将生锈铁钉放入醋精中 铁锈逐渐消失,溶液变为 色 酸能与某些金属氧化物反应
一段时间后有气泡冒出 酸能与某些 反应
③将碎鸡蛋壳放入醋精中 有 冒出 酸能与某些盐反应
④将纯碱(Na2CO3)放入醋精中 有气泡冒出 酸能与碱反应
[反思与评价] 小明认为步骤④不能得到“酸能与碱反应”的结论,理由是 。
[实验验证] 小明重新设计以下方案验证“酸能与碱反应”。
实验步骤 实验现象 化学方程式
①向食品干燥剂中加入适量的水,充分反应后,静置,取上层清液 热量
②向上层清液中加入牵牛花汁液,再逐滴滴入醋精至过量
23.(12分)在实验课上,同学们将CO2通入Ca(OH)2溶液中,观察到有白色沉淀生成;而将CO2通入NaOH溶液中,无明显现象。
[提出问题] CO2与NaOH溶液是否发生了化学反应
[作出猜想] CO2与NaOH溶液发生了化学反应。
[实验探究] 小明设计了如图所示四种实验,其共同原理是CO2和NaOH溶液反应,使容器内压强减小。
(1)实验现象:A中试管内液面上升,B中 ,C中 ,D中水槽中的水部分进入烧瓶中。
(2)小宁对小明的方案提出了疑问,他认为小明的实验不严谨,其理由是 。要得到科学严谨的结论,若利用方案A,应补做的对比实验是 。
(3)小丽的改进方案是利用反应后的溶液来验证猜想,请完成实验报告。
实验操作 实验现象 实验结论
向实验后的溶液中加入足量稀盐酸 猜想正确
[得出结论] CO2与NaOH溶液发生了化学反应,请写出CO2与NaOH溶液反应的化学方程式: 。
四、计算题(共6分)
24. [2020·泰安改编] 请你仔细分析所示的实验过程和提供的数据,并进行计算。
(1)反应后烧杯中溶液质量。
(2)反应后所得溶液的溶质质量分数(写出计算过程,精确到0.1%)。
答案
自我综合评价(一)
1.D P2O5属于氧化物,NaHCO3属于盐,NH3·H2O属于碱,CH3COOH属于酸。
2.D 3.C
4.A 当溶液的pH小于7时,呈酸性,随着pH的减小,酸性增强,酱油、牛奶的pH都小于7,呈酸性,但是酱油的pH更小,所以酸性更强。
5.C 6.C 7.C
8.C 石灰水显碱性,能使酚酞试液变红。
9.C
10.D 当溶液的pH小于7时,呈酸性,且pH越小,酸性越强。用洁净干燥的玻璃棒蘸取盐酸滴在湿润的pH试纸上,相当于稀释了待测溶液,使溶液的酸性减弱,测定结果偏大,但结论正确。
11.B 12.D 13.A
14.D 液汁含有酸,显酸性,加入紫色石蕊试液,会变成红色,pH应小于7;碳酸钠溶液与硫酸和盐酸反应都会生成二氧化碳气体,所以无法证明含有哪种酸;加入氯化钡溶液后如图果有白色沉淀生成,说明生成了硫酸钡,则该酸为硫酸,如图果无明显现象,则证明含有盐酸。
15.D 将氢氧化钡溶液加入稀硫酸中,发生反应的化学方程式为H2SO4 +Ba(OH)2 BaSO4↓+2H2O。随着氢氧化钡的加入,生成的沉淀越来越多,烧杯中溶液的溶质会越来越少,恰好反应时溶质质量为零,氢氧化钡过量后,随着氢氧化钡的加入,溶质会越来越多;稀硫酸显酸性,pH小于7,随着氢氧化钡溶液的加入,烧杯中溶液的pH会越来越大,恰好完全反应时,pH等于7,氢氧化钡过量时pH大于7,但不会一直增大,最后接近原氢氧化钡溶液的pH;反应没有气体放出,随着氢氧化钡溶液的加入,烧杯中物质的总质量越来越大;反应生成硫酸钡沉淀,沉淀的质量从零开始增加,至反应结束后不再改变。
16.(1)紫色石蕊试液 (2)CaCO3
(3)氯化钠溶液
(1)紫色石蕊试液在酸、碱、盐中可以显示不同的颜色。取样品,滴入石蕊试液,溶液显红色的是盐酸,显紫色的是氯化钠溶液,显蓝色的是澄清石灰水。(2)氢氧化钙和空气中的二氧化碳反应会生成白色的碳酸钙沉淀,所以装澄清石灰水的试剂瓶瓶口常出现白膜,白膜的主要成分的化学式为CaCO3。(3)盐是由金属阳离子和酸根阴离子构成的化合物,所以属于盐的是氯化钠溶液。
17.(1)CaCO3CaO+CO2↑
CO2+Ca(OH)2CaCO3↓+H2O
(2)Ca(OH)2
(3)解离出的阴离子都是OH-
(4)Na2CO3 溶液
18.(1)能 (2)碱性 不一定 (3)作对照实验
(1)稀盐酸显酸性,能使紫甘蓝汁由紫色变成红色;氢氧化钠溶液显碱性,能使紫甘蓝汁由紫色变成绿色,所以紫甘蓝汁可以作酸碱指示剂。(2)草木灰溶液能使紫甘蓝汁由紫色变成绿色,所以草木灰溶液显碱性;草木灰的主要成分是碳酸钾,碳酸钾属于盐,故显碱性的溶液不一定是碱溶液。(3)向蒸馏水中滴加紫甘蓝汁的目的是验证水不能使紫甘蓝汁变色,起到了空白对照的作用。
19.(1)溶液由红色变为无色
(2)Na+ OH- Cl- (3)OH-
20.(1)酸
(2)HCl+NaOHNaCl+H2O(合理即可)
(3)有蓝色沉淀生成
21.(1)稀硫酸 氢氧化钠溶液 (2)H2SO4、Na2SO4
(1)由图像可知,pH开始时大于7,随滴入溶液体积的增加而逐渐减小,最后小于7,可知原溶液显碱性,不断加入酸性溶液,使pH减小,说明是把稀硫酸滴加到氢氧化钠溶液中。(2)滴入溶液体积为V2 mL时,溶液的pH小于7,溶液显酸性,说明稀硫酸过量,所得溶液中的溶质为H2SO4、Na2SO4。
22.[实验探究] ①牵牛花汁变成红色 ②黄 金属 ③气泡
[反思与评价] 纯碱(Na2CO3)不是碱,而是盐
[实验验证] ①放出 CaO+H2OCa(OH)2
②溶液先由无色变为蓝色,随着醋精的加入,溶液变为紫色,最后变为红色
Ca(OH)2+2CH3COOH(CH3COO)2Ca+2H2O
23.[实验探究] (1)软塑料瓶变瘪 气球胀大
(2)CO2能溶于水且能与水反应生成碳酸,也会导致容器内压强减小 取等体积的试管充满CO2,倒扣在与氢氧化钠溶液等体积的水中
(3)有气泡产生
[得出结论] CO2+2NaOHNa2CO3+H2O
24.解:(1)设反应生成氯化亚铁的质量为x,生成氢气的质量为y。
Fe+2HClFeCl2+H2↑
56 127 2
11.2 g x y
= x=25.4 g
= y=0.4 g
反应后烧杯中溶液质量为11.2 g+189.2 g-0.4 g=200 g 。
(2)反应后所得溶液的溶质质量分数为×100%=12.7%。
答:(1)反应后烧杯中溶液质量为200 g;(2)反应后所得溶液的溶质质量分数是12.7%。
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
