粤教版化学九年级下册课课练:滚动练习 常见的酸和碱(word版有答案)
文档属性
| 名称 | 粤教版化学九年级下册课课练:滚动练习 常见的酸和碱(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 160.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-29 11:49:11 | ||
图片预览


文档简介
滚动练习 常见的酸和碱
一、选择题
1.[2020·湘西州] 下列关于酸、碱的说法错误的是 ( )
A.苛性钠、烧碱、火碱都是氢氧化钠
B.氢氧化钙可以用来改良酸性土壤
C.稀盐酸能够使酚酞溶液变红
D.生活中许多常见的物质(如图柠檬、柑橘)中含有酸
2.下列各组物质间的反应,要借助酸碱指示剂才能判断出反应发生的是 ( )
A.锌和稀盐酸 B.盐酸和氢氧化钠
C.氧化铜和稀硫酸 D.氢氧化钡和稀硫酸
3.[2020·株洲] 下列物质间不能发生反应的是 ( )
A.稀盐酸和镁条 B.稀盐酸和铜丝
C.稀盐酸和氢氧化镁 D.稀盐酸和氢氧化铜
4.石灰浆抹过的墙壁上掉下一块白色固体,为探究其成分,进行如图下实验,由此得出的结论正确的是 ( )
实验步骤 实验现象
①将固体研磨成粉末状,加水搅拌 固体没有全部溶解
②取上层清液,滴加酚酞溶液 溶液呈红色
③取不溶物,滴加稀盐酸 有气泡产生
A.一定含有Ca(OH)2,可能有CaCO3
B.一定含有CaCO3和Ca(OH)2
C.一定没有CaCO3和Ca(OH)2
D.一定含有CaCO3,可能有Ca(OH)2
5.[2020·益阳] 下列物质混合,能发生反应且反应后溶液质量减少的是 ( )
A.铜丝与稀硫酸
B.稀硫酸与NaOH溶液
C.铁锈与稀硫酸
D.铜丝与AgNO3溶液
6.[2020·郴州] 下列关于Ca(OH)2的说法错误的是 ( )
A.微溶于水,水溶液呈碱性
B.能与酸反应,可用于治疗胃酸过多
C.与CuSO4溶液按一定比例混合,可配制波尔多液
D.澄清溶液可用来检验CO2
7.[2020·长沙] 通过实验以及对实验现象的观察、记录和分析,可以发现和验证化学原理。下面是小兰同学在完成酸、碱的性质实验时记录的部分实验现象,其中正确的是 ( )
A.打开盛有浓盐酸的试剂瓶瓶盖,瓶口有白烟产生
B.向氧化铁中加入足量稀硫酸,红棕色固体溶解,溶液由无色变成浅绿色
C.向氯化铜溶液中加入几滴氢氧化钠溶液,产生蓝色沉淀
D.向氢氧化钙溶液中加入几滴紫色石蕊溶液,石蕊溶液由紫色变成红色
8.向盛有100 g稀硫酸的小烧杯中,缓慢滴加氢氧化钡溶液至过量。发生反应的化学方程式为H2SO4+Ba(OH)2BaSO4↓+2H2O。烧杯中物质的某些量随着氢氧化钡溶液的滴加,其变化趋势正确的是 ( )
9.[2020·泰安] 向一定量的硫酸铜和稀硫酸的混合溶液中滴加氢氧化钠溶液,反应过程中产生沉淀的质量与加入的氢氧化钠溶液的质量关系如图所示。下列说法不正确的是( )
A.a点溶液中的溶质有2种
B.c点溶液中的溶质有3种
C.ab(不包括a点)段有沉淀生成
D.d点溶液的pH>7
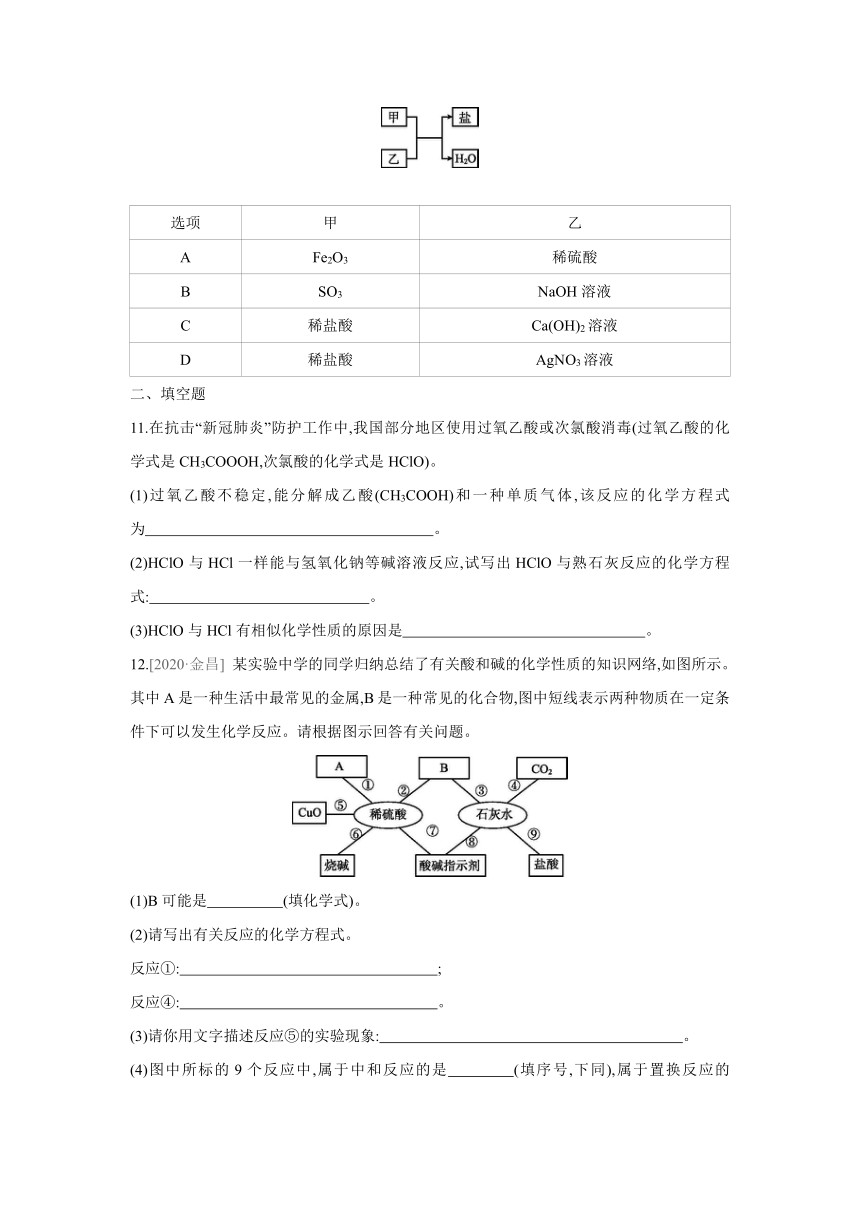
10.[2020·广东] 下列各组物质不能实现如图所示的转化关系的是 ( )
选项 甲 乙
A Fe2O3 稀硫酸
B SO3 NaOH溶液
C 稀盐酸 Ca(OH)2溶液
D 稀盐酸 AgNO3溶液
二、填空题
11.在抗击“新冠肺炎”防护工作中,我国部分地区使用过氧乙酸或次氯酸消毒(过氧乙酸的化学式是CH3COOOH,次氯酸的化学式是HClO)。
(1)过氧乙酸不稳定,能分解成乙酸(CH3COOH)和一种单质气体,该反应的化学方程式为 。
(2)HClO与HCl一样能与氢氧化钠等碱溶液反应,试写出HClO与熟石灰反应的化学方程式: 。
(3)HClO与HCl有相似化学性质的原因是 。
12.[2020·金昌] 某实验中学的同学归纳总结了有关酸和碱的化学性质的知识网络,如图所示。其中A是一种生活中最常见的金属,B是一种常见的化合物,图中短线表示两种物质在一定条件下可以发生化学反应。请根据图示回答有关问题。
(1)B可能是 (填化学式)。
(2)请写出有关反应的化学方程式。
反应①: ;
反应④: 。
(3)请你用文字描述反应⑤的实验现象: 。
(4)图中所标的9个反应中,属于中和反应的是 (填序号,下同),属于置换反应的是 。
13.某化学兴趣小组在学习碱的化学性质时,进行了如图所示的实验。
(1)图甲实验的目的是证明二氧化碳与氢氧化钠溶液确实发生了化学反应。写出该反应的化学方程式: 。
(2)图乙实验过程中没有观察到明显现象。若先向氢氧化钠溶液中加入 ,再逐滴滴加稀硫酸,可观察到 (填现象),证明稀硫酸与氢氧化钠溶液确实发生了化学反应。
(3)图丙实验中的现象为 。
三、计算题
14.实验室欲测定一瓶标签破损的稀硫酸中溶质的质量分数,现取10 g稀硫酸样品,将5%的氢氧化钠溶液逐滴加入样品中,边加边搅拌。随着氢氧化钠溶液的加入,溶液pH的变化情况如图所示。分析并计算:
(1)当pH=7时,消耗氢氧化钠溶液中NaOH的质量为 。
(2)稀硫酸中溶质的质量分数。
答案
1.C 稀盐酸显酸性,不能使酚酞溶液变红。
2.B 盐酸和氢氧化钠反应无明显现象,要借助酸碱指示剂判断反应发生。
3.B 铜在金属活动性顺序表中位于氢的后面,不与稀盐酸发生反应。
4.B
5.D 铜的金属活动性比银强,铜丝与硝酸银溶液反应生成硝酸铜溶液和银,反应的化学方程式为Cu+2AgNO3Cu(NO3)2+2Ag,每64份质量的铜可置换出216份质量的银,溶液的质量会减少。
6.B 氢氧化钙能与酸反应,但氢氧化钙具有腐蚀性,不能用于治疗胃酸过多。
7.C 浓盐酸具有挥发性,打开盛有浓盐酸的试剂瓶瓶盖,瓶口出现白雾,而不是白烟;向氧化铁中加入足量稀硫酸,红棕色固体溶解,溶液由无色变成黄色;向氯化铜溶液中加入几滴氢氧化钠溶液,生成氢氧化铜蓝色沉淀和氯化钠;氢氧化钙溶液显碱性,向氢氧化钙溶液中加入几滴紫色石蕊溶液,石蕊溶液由紫色变成蓝色。
8.C 向盛有100 g稀硫酸的小烧杯中,缓慢滴加氢氧化钡溶液至过量。水的质量会不断增加,但反应过程中有水生成,增加的水的质量不只是Ba(OH)2溶液中水的质量,故水的质量的增加速率先快后慢;随着氢氧化钡溶液的加入,烧杯中物质的总质量会不断增加;稀硫酸与氢氧化钡溶液反应生成硫酸钡沉淀和水,沉淀的质量不断增加,至恰好完全反应,不再发生变化;稀硫酸与氢氧化钡溶液反应生成硫酸钡沉淀和水,烧杯内液体的酸性逐渐减弱,碱性逐渐增强,当Ba(OH)2溶液过量时,溶液的pH会大于7。
9.B 向一定量的硫酸铜和稀硫酸的混合溶液中滴加氢氧化钠溶液,氢氧化钠先和稀硫酸反应生成硫酸钠和水,再和硫酸铜反应生成硫酸钠和氢氧化铜沉淀,其中a点表示氢氧化钠和稀硫酸恰好完全反应,b点表示硫酸铜和氢氧化钠恰好完全反应。由分析可知a点表示氢氧化钠和稀硫酸恰好完全反应,此时溶液中的溶质为硫酸钠和硫酸铜。c点表示稀硫酸完全反应后,硫酸铜反应一部分,溶液中的溶质为硫酸钠和硫酸铜。ab段表示硫酸铜和氢氧化钠反应,生成硫酸钠和氢氧化铜沉淀。d点表示硫酸铜完全反应后,继续滴加氢氧化钠溶液,氢氧化钠过量,溶液显碱性,故pH>7。
10.D 氧化铁与稀硫酸反应生成硫酸铁和水,能生成盐和水;三氧化硫与氢氧化钠反应生成硫酸钠和水,能生成盐和水;稀盐酸与氢氧化钙溶液反应生成氯化钙和水,能生成盐和水;稀盐酸与硝酸银溶液反应生成氯化银沉淀和硝酸,生成物是盐和酸。
11.(1)2CH3COOOH2CH3COOH+O2↑
(2)2HClO+Ca(OH)2Ca(ClO)2+2H2O
(3)在溶液中解离出的阳离子均为H+
(1)过氧乙酸不稳定,能分解成乙酸(CH3COOH)和一种单质气体,单质气体应为氧气,反应的化学方程式为2CH3COOOH2CH3COOH+O2↑。(2)HClO与熟石灰反应生成次氯酸钙和水,反应的化学方程式为2HClO+Ca(OH)2Ca(ClO)2+2H2O。(3)HClO与HCl有相似的化学性质,是因为在溶液中解离出的阳离子均为H+。
12.(1)Na2CO3(合理即可)
(2)Fe+H2SO4FeSO4+H2↑
CO2+Ca(OH)2CaCO3↓+H2O
(3)黑色粉末溶解,溶液由无色变为蓝色
(4)⑥⑨ ①
(1)B既能与酸反应,还能与碱反应,B应为盐,可能是Na2CO3。(2)A是一种生活中最常见的金属,则是铁,与稀硫酸反应生成硫酸亚铁和氢气,反应的化学方程式为Fe+H2SO4FeSO4+H2↑。反应④是二氧化碳与石灰水反应生成碳酸钙沉淀和水,反应的化学方程式为CO2+Ca(OH)2CaCO3↓+H2O。(3)反应⑤是氧化铜与稀硫酸反应生成硫酸铜和水,会观察到黑色粉末溶解,溶液由无色变为蓝色。(4)中和反应是酸与碱作用生成盐和水的反应,图中所标的9个反应中,属于中和反应的是⑥⑨;置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应的是①。
13.(1)2NaOH+CO2Na2CO3+H2O
(2)酚酞溶液 酚酞溶液由红色变为无色
(3)有蓝色沉淀产生,溶液由蓝色逐渐变为无色
(1)氢氧化钠和二氧化碳反应生成碳酸钠和水,该反应的化学方程式为2NaOH+CO2Na2CO3+H2O。(2)若先向氢氧化钠溶液中加入酚酞溶液,再逐滴滴加稀硫酸,可观察到酚酞溶液由红色变为无色,证明稀硫酸与氢氧化钠溶液确实发生了化学反应。(3)氢氧化钠和硫酸铜反应生成氢氧化铜蓝色沉淀和硫酸钠,观察到有蓝色沉淀产生,溶液由蓝色逐渐变为无色。
14.(1)0.8 g
(2)解:设10 g稀硫酸样品含有H2SO4的质量为x。
2NaOH+H2SO4Na2SO4+2H2O
80 98
0.8 g x
=
x=0.98 g
稀硫酸中溶质的质量分数为
×100%=9.8%。
答:稀硫酸中溶质的质量分数为9.8%。
(1)由图示可知,在溶液的pH等于7时,消耗的氢氧化钠溶液的质量为16 g,其中溶质的质量为16 g×5%=0.8 g。
一、选择题
1.[2020·湘西州] 下列关于酸、碱的说法错误的是 ( )
A.苛性钠、烧碱、火碱都是氢氧化钠
B.氢氧化钙可以用来改良酸性土壤
C.稀盐酸能够使酚酞溶液变红
D.生活中许多常见的物质(如图柠檬、柑橘)中含有酸
2.下列各组物质间的反应,要借助酸碱指示剂才能判断出反应发生的是 ( )
A.锌和稀盐酸 B.盐酸和氢氧化钠
C.氧化铜和稀硫酸 D.氢氧化钡和稀硫酸
3.[2020·株洲] 下列物质间不能发生反应的是 ( )
A.稀盐酸和镁条 B.稀盐酸和铜丝
C.稀盐酸和氢氧化镁 D.稀盐酸和氢氧化铜
4.石灰浆抹过的墙壁上掉下一块白色固体,为探究其成分,进行如图下实验,由此得出的结论正确的是 ( )
实验步骤 实验现象
①将固体研磨成粉末状,加水搅拌 固体没有全部溶解
②取上层清液,滴加酚酞溶液 溶液呈红色
③取不溶物,滴加稀盐酸 有气泡产生
A.一定含有Ca(OH)2,可能有CaCO3
B.一定含有CaCO3和Ca(OH)2
C.一定没有CaCO3和Ca(OH)2
D.一定含有CaCO3,可能有Ca(OH)2
5.[2020·益阳] 下列物质混合,能发生反应且反应后溶液质量减少的是 ( )
A.铜丝与稀硫酸
B.稀硫酸与NaOH溶液
C.铁锈与稀硫酸
D.铜丝与AgNO3溶液
6.[2020·郴州] 下列关于Ca(OH)2的说法错误的是 ( )
A.微溶于水,水溶液呈碱性
B.能与酸反应,可用于治疗胃酸过多
C.与CuSO4溶液按一定比例混合,可配制波尔多液
D.澄清溶液可用来检验CO2
7.[2020·长沙] 通过实验以及对实验现象的观察、记录和分析,可以发现和验证化学原理。下面是小兰同学在完成酸、碱的性质实验时记录的部分实验现象,其中正确的是 ( )
A.打开盛有浓盐酸的试剂瓶瓶盖,瓶口有白烟产生
B.向氧化铁中加入足量稀硫酸,红棕色固体溶解,溶液由无色变成浅绿色
C.向氯化铜溶液中加入几滴氢氧化钠溶液,产生蓝色沉淀
D.向氢氧化钙溶液中加入几滴紫色石蕊溶液,石蕊溶液由紫色变成红色
8.向盛有100 g稀硫酸的小烧杯中,缓慢滴加氢氧化钡溶液至过量。发生反应的化学方程式为H2SO4+Ba(OH)2BaSO4↓+2H2O。烧杯中物质的某些量随着氢氧化钡溶液的滴加,其变化趋势正确的是 ( )
9.[2020·泰安] 向一定量的硫酸铜和稀硫酸的混合溶液中滴加氢氧化钠溶液,反应过程中产生沉淀的质量与加入的氢氧化钠溶液的质量关系如图所示。下列说法不正确的是( )
A.a点溶液中的溶质有2种
B.c点溶液中的溶质有3种
C.ab(不包括a点)段有沉淀生成
D.d点溶液的pH>7
10.[2020·广东] 下列各组物质不能实现如图所示的转化关系的是 ( )
选项 甲 乙
A Fe2O3 稀硫酸
B SO3 NaOH溶液
C 稀盐酸 Ca(OH)2溶液
D 稀盐酸 AgNO3溶液
二、填空题
11.在抗击“新冠肺炎”防护工作中,我国部分地区使用过氧乙酸或次氯酸消毒(过氧乙酸的化学式是CH3COOOH,次氯酸的化学式是HClO)。
(1)过氧乙酸不稳定,能分解成乙酸(CH3COOH)和一种单质气体,该反应的化学方程式为 。
(2)HClO与HCl一样能与氢氧化钠等碱溶液反应,试写出HClO与熟石灰反应的化学方程式: 。
(3)HClO与HCl有相似化学性质的原因是 。
12.[2020·金昌] 某实验中学的同学归纳总结了有关酸和碱的化学性质的知识网络,如图所示。其中A是一种生活中最常见的金属,B是一种常见的化合物,图中短线表示两种物质在一定条件下可以发生化学反应。请根据图示回答有关问题。
(1)B可能是 (填化学式)。
(2)请写出有关反应的化学方程式。
反应①: ;
反应④: 。
(3)请你用文字描述反应⑤的实验现象: 。
(4)图中所标的9个反应中,属于中和反应的是 (填序号,下同),属于置换反应的是 。
13.某化学兴趣小组在学习碱的化学性质时,进行了如图所示的实验。
(1)图甲实验的目的是证明二氧化碳与氢氧化钠溶液确实发生了化学反应。写出该反应的化学方程式: 。
(2)图乙实验过程中没有观察到明显现象。若先向氢氧化钠溶液中加入 ,再逐滴滴加稀硫酸,可观察到 (填现象),证明稀硫酸与氢氧化钠溶液确实发生了化学反应。
(3)图丙实验中的现象为 。
三、计算题
14.实验室欲测定一瓶标签破损的稀硫酸中溶质的质量分数,现取10 g稀硫酸样品,将5%的氢氧化钠溶液逐滴加入样品中,边加边搅拌。随着氢氧化钠溶液的加入,溶液pH的变化情况如图所示。分析并计算:
(1)当pH=7时,消耗氢氧化钠溶液中NaOH的质量为 。
(2)稀硫酸中溶质的质量分数。
答案
1.C 稀盐酸显酸性,不能使酚酞溶液变红。
2.B 盐酸和氢氧化钠反应无明显现象,要借助酸碱指示剂判断反应发生。
3.B 铜在金属活动性顺序表中位于氢的后面,不与稀盐酸发生反应。
4.B
5.D 铜的金属活动性比银强,铜丝与硝酸银溶液反应生成硝酸铜溶液和银,反应的化学方程式为Cu+2AgNO3Cu(NO3)2+2Ag,每64份质量的铜可置换出216份质量的银,溶液的质量会减少。
6.B 氢氧化钙能与酸反应,但氢氧化钙具有腐蚀性,不能用于治疗胃酸过多。
7.C 浓盐酸具有挥发性,打开盛有浓盐酸的试剂瓶瓶盖,瓶口出现白雾,而不是白烟;向氧化铁中加入足量稀硫酸,红棕色固体溶解,溶液由无色变成黄色;向氯化铜溶液中加入几滴氢氧化钠溶液,生成氢氧化铜蓝色沉淀和氯化钠;氢氧化钙溶液显碱性,向氢氧化钙溶液中加入几滴紫色石蕊溶液,石蕊溶液由紫色变成蓝色。
8.C 向盛有100 g稀硫酸的小烧杯中,缓慢滴加氢氧化钡溶液至过量。水的质量会不断增加,但反应过程中有水生成,增加的水的质量不只是Ba(OH)2溶液中水的质量,故水的质量的增加速率先快后慢;随着氢氧化钡溶液的加入,烧杯中物质的总质量会不断增加;稀硫酸与氢氧化钡溶液反应生成硫酸钡沉淀和水,沉淀的质量不断增加,至恰好完全反应,不再发生变化;稀硫酸与氢氧化钡溶液反应生成硫酸钡沉淀和水,烧杯内液体的酸性逐渐减弱,碱性逐渐增强,当Ba(OH)2溶液过量时,溶液的pH会大于7。
9.B 向一定量的硫酸铜和稀硫酸的混合溶液中滴加氢氧化钠溶液,氢氧化钠先和稀硫酸反应生成硫酸钠和水,再和硫酸铜反应生成硫酸钠和氢氧化铜沉淀,其中a点表示氢氧化钠和稀硫酸恰好完全反应,b点表示硫酸铜和氢氧化钠恰好完全反应。由分析可知a点表示氢氧化钠和稀硫酸恰好完全反应,此时溶液中的溶质为硫酸钠和硫酸铜。c点表示稀硫酸完全反应后,硫酸铜反应一部分,溶液中的溶质为硫酸钠和硫酸铜。ab段表示硫酸铜和氢氧化钠反应,生成硫酸钠和氢氧化铜沉淀。d点表示硫酸铜完全反应后,继续滴加氢氧化钠溶液,氢氧化钠过量,溶液显碱性,故pH>7。
10.D 氧化铁与稀硫酸反应生成硫酸铁和水,能生成盐和水;三氧化硫与氢氧化钠反应生成硫酸钠和水,能生成盐和水;稀盐酸与氢氧化钙溶液反应生成氯化钙和水,能生成盐和水;稀盐酸与硝酸银溶液反应生成氯化银沉淀和硝酸,生成物是盐和酸。
11.(1)2CH3COOOH2CH3COOH+O2↑
(2)2HClO+Ca(OH)2Ca(ClO)2+2H2O
(3)在溶液中解离出的阳离子均为H+
(1)过氧乙酸不稳定,能分解成乙酸(CH3COOH)和一种单质气体,单质气体应为氧气,反应的化学方程式为2CH3COOOH2CH3COOH+O2↑。(2)HClO与熟石灰反应生成次氯酸钙和水,反应的化学方程式为2HClO+Ca(OH)2Ca(ClO)2+2H2O。(3)HClO与HCl有相似的化学性质,是因为在溶液中解离出的阳离子均为H+。
12.(1)Na2CO3(合理即可)
(2)Fe+H2SO4FeSO4+H2↑
CO2+Ca(OH)2CaCO3↓+H2O
(3)黑色粉末溶解,溶液由无色变为蓝色
(4)⑥⑨ ①
(1)B既能与酸反应,还能与碱反应,B应为盐,可能是Na2CO3。(2)A是一种生活中最常见的金属,则是铁,与稀硫酸反应生成硫酸亚铁和氢气,反应的化学方程式为Fe+H2SO4FeSO4+H2↑。反应④是二氧化碳与石灰水反应生成碳酸钙沉淀和水,反应的化学方程式为CO2+Ca(OH)2CaCO3↓+H2O。(3)反应⑤是氧化铜与稀硫酸反应生成硫酸铜和水,会观察到黑色粉末溶解,溶液由无色变为蓝色。(4)中和反应是酸与碱作用生成盐和水的反应,图中所标的9个反应中,属于中和反应的是⑥⑨;置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应的是①。
13.(1)2NaOH+CO2Na2CO3+H2O
(2)酚酞溶液 酚酞溶液由红色变为无色
(3)有蓝色沉淀产生,溶液由蓝色逐渐变为无色
(1)氢氧化钠和二氧化碳反应生成碳酸钠和水,该反应的化学方程式为2NaOH+CO2Na2CO3+H2O。(2)若先向氢氧化钠溶液中加入酚酞溶液,再逐滴滴加稀硫酸,可观察到酚酞溶液由红色变为无色,证明稀硫酸与氢氧化钠溶液确实发生了化学反应。(3)氢氧化钠和硫酸铜反应生成氢氧化铜蓝色沉淀和硫酸钠,观察到有蓝色沉淀产生,溶液由蓝色逐渐变为无色。
14.(1)0.8 g
(2)解:设10 g稀硫酸样品含有H2SO4的质量为x。
2NaOH+H2SO4Na2SO4+2H2O
80 98
0.8 g x
=
x=0.98 g
稀硫酸中溶质的质量分数为
×100%=9.8%。
答:稀硫酸中溶质的质量分数为9.8%。
(1)由图示可知,在溶液的pH等于7时,消耗的氢氧化钠溶液的质量为16 g,其中溶质的质量为16 g×5%=0.8 g。
