2022-2023学年人教版九年级化学上册 第三单元 课题3 元素 课件 (共36张PPT)
文档属性
| 名称 | 2022-2023学年人教版九年级化学上册 第三单元 课题3 元素 课件 (共36张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 8.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-30 16:16:21 | ||
图片预览







文档简介
(共36张PPT)
课题3 元素
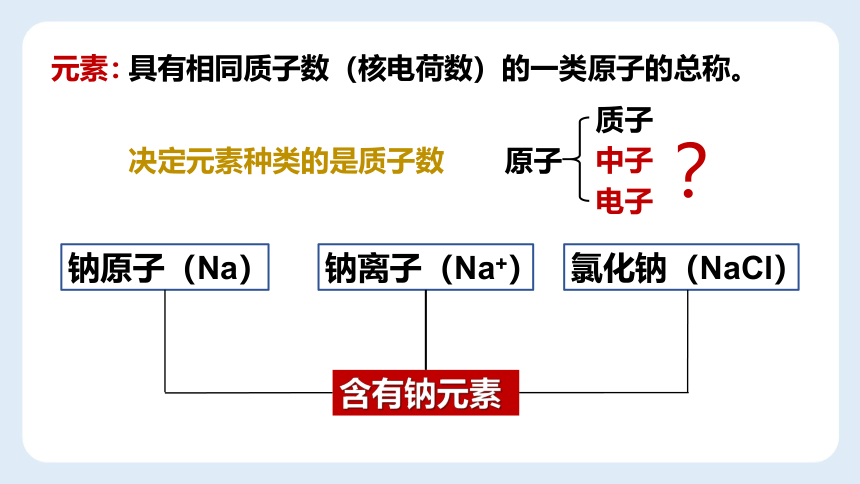
元素
钠原子(Na)
钠离子(Na+)
氯化钠(NaCl)
含有钠元素
钠原子(Na)
钠离子(Na+)
氯化钠(NaCl)
含有钠元素
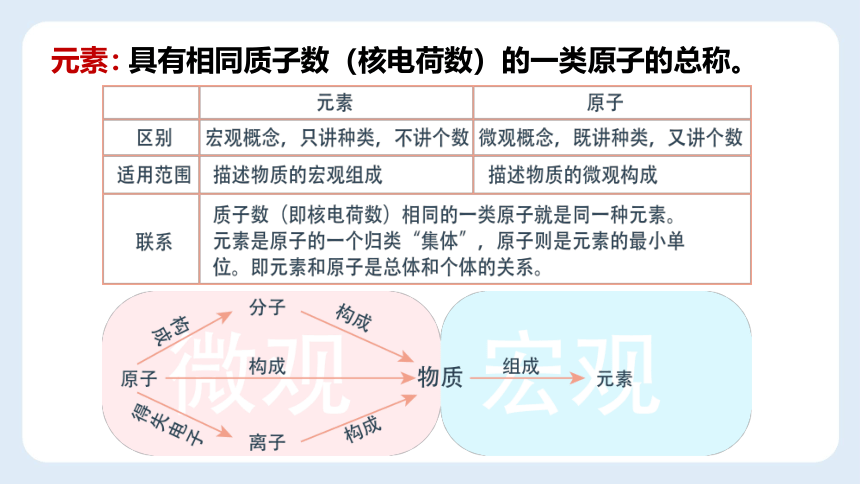
具有相同质子数(核电荷数)的一类原子的总称。
元素:
决定元素种类的是质子数
原子
质子
中子
电子
?
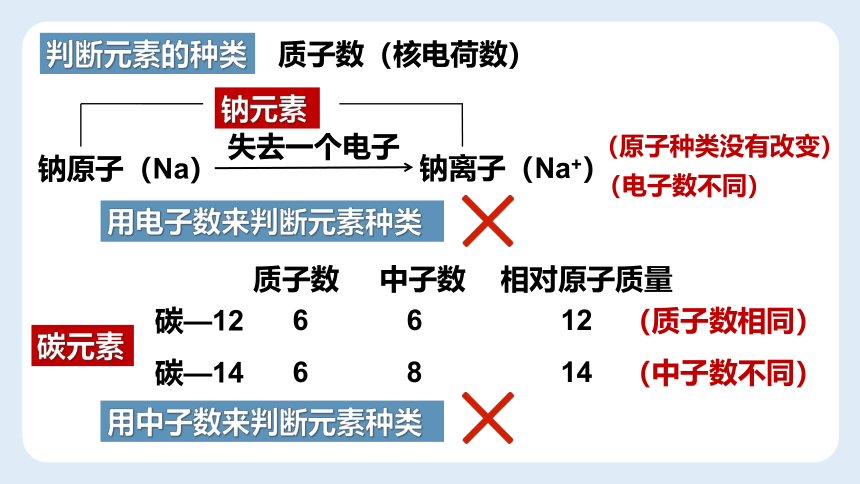
钠原子(Na)
钠离子(Na+)
失去一个电子
(原子种类没有改变)
钠元素
(电子数不同)
用电子数来判断元素种类
相对原子质量
质子数
中子数
6
6
碳—12
12
碳—14
6
8
14
碳元素
(质子数相同)
(中子数不同)
用中子数来判断元素种类
判断元素的种类
质子数(核电荷数)
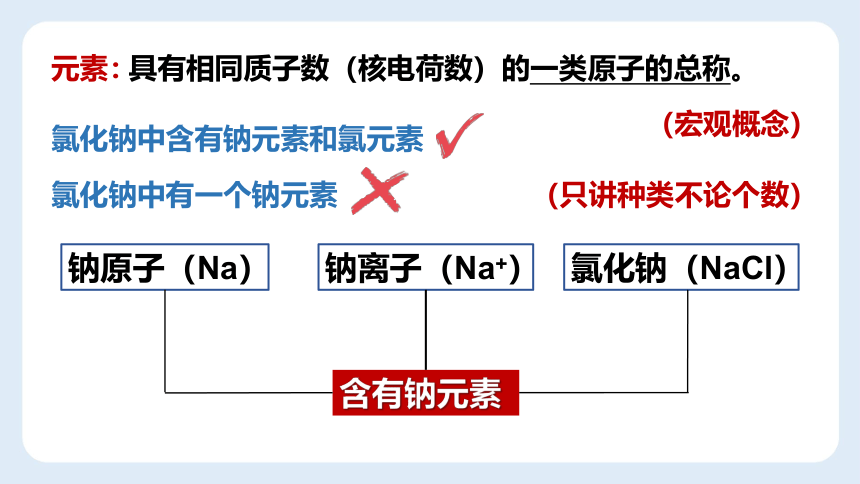
钠原子(Na)
钠离子(Na+)
氯化钠(NaCl)
含有钠元素
具有相同质子数(核电荷数)的一类原子的总称。
元素:
(宏观概念)
(只讲种类不论个数)
氯化钠中含有钠元素和氯元素
氯化钠中有一个钠元素
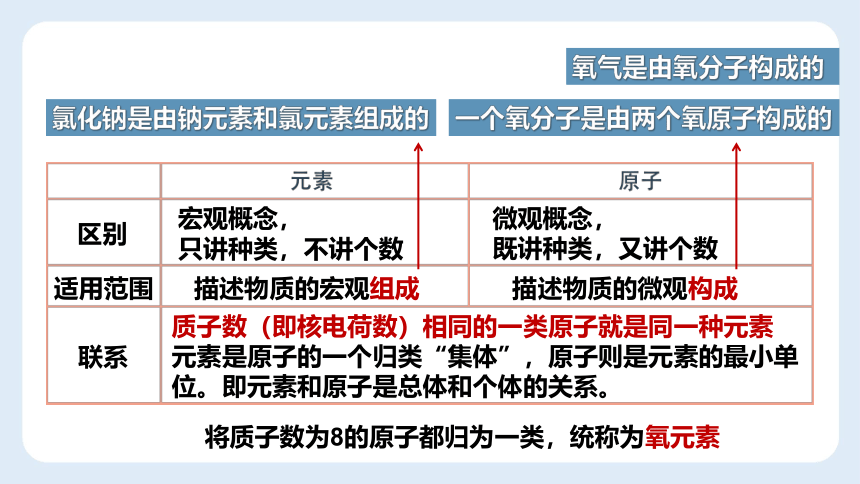
区别
宏观概念,
只讲种类,不讲个数
微观概念,
既讲种类,又讲个数
适用范围
描述物质的宏观组成
描述物质的微观构成
联系
质子数(即核电荷数)相同的一类原子就是同一种元素
元素是原子的一个归类“集体”,原子则是元素的最小单位。即元素和原子是总体和个体的关系。
氯化钠是由钠元素和氯元素组成的
氧气是由氧分子构成的
一个氧分子是由两个氧原子构成的
将质子数为8的原子都归为一类,统称为氧元素
具有相同质子数(核电荷数)的一类原子的总称。
元素:
元素符号
具有相同质子数(核电荷数)的一类原子的总称。
元素:
元素符号
氯原子(Cl)钠原子(Na)
氯离子(Cl–)钠离子(Na+)
(化学用语)
如:氧元素(O)、氮元素(N)
如:钠元素(Na)
元素符号的写法
① 由一个字母表示的元素符号要大写
如:O、N
② 由两个字母表示的元素符号,
(第一个字母大写,第二个字母要小写,“一大二小”)
如:Na、Cl
元素符号的写法
① 由一个字母表示的元素符号要大写
如:O、N
② 由两个字母表示的元素符号,
(第一个字母大写,第二个字母要小写,“一大二小”)
如:Na、Cl
O:
2O:
①氧元素(宏观)
②一个氧原子(微观)
两个氧原子(微观)
元素符号的意义:
①宏观:表示一种元素
②微观:表示这种元素的一个原子
(只讲种类不讲个数)
元素的分类
金属元素:“ 钅”(除汞)
“汞”是唯一一个在常温下呈液态的金属
非金属元素:
气态非金属元素:“ 气 ”,如:氧(O)、氮(N)
液态非金属元素:“ 氵”,如:溴(Br)
固态非金属元素:“ 石 ”,如:碳(C)、磷(P)
稀有气体元素: “ 气 ”
氦(He)、氖(Ne)、氩(Ar)、氪(Kr)、氙(Xe)、氡(Rn)
元素
元素的分布:
1、空气中含量位居前两位的元素:
氮(N)、氧(O)
2、地壳中含量位居前四位的元素:
氧(O)、硅(Si)、铝(Al)、铁(Fe)
地壳中含量最高的非金属元素和金属元素分别是什么?
非金属元素:
氧(O)
金属元素:
铝(Al)
元素的分布:
1、空气中含量位居前两位的元素:
氮(N)、氧(O)
2、地壳中含量位居前四位的元素:
氧(O)、硅(Si)、铝(Al)、铁(Fe)
3、生物细胞当中含量位居前四位的元素:
氧(O)、碳(C)、氢(H)、氮(N)
(非金属元素)
元素周期表
根据元素的原子结构和性质
按照原子序数有序地排列
称为元素周期表
决定元素种类的是原子的质子数(核电荷数)
根据元素的原子结构和性质
按照原子序数有序地排列
称为元素周期表
原子序数=核电荷数=质子数=核外电子数
可以从表中的每个小格内获得元素的哪些信息呢 ?
原子序数=核电荷数=质子数=核外电子数
横行(周期):共7个
纵行(族):18个纵行,
(8、9、10纵行为一族)
金属元素
非金属元素
稀有气体元素
16个族
为什么要按照这样一个结构来进行布局,有什么微妙之处呢?
原子结构示意图
元素周期律:
①每一横行:电子层数相同且等于同期数
从左往右,最外层电子数依次递增
金属元素
非金属元素
稀有气体元素
元素周期律:
①每一横行:电子层数相同且等于同期数
从左往右,最外层电子数依次递增
②每一纵行:从上往下,电子层数依次递增
最外层电子数相同(除He)
元素周期表的意义:
寻找新元素、新物质
课题3 元素
元素
钠原子(Na)
钠离子(Na+)
氯化钠(NaCl)
含有钠元素
钠原子(Na)
钠离子(Na+)
氯化钠(NaCl)
含有钠元素
具有相同质子数(核电荷数)的一类原子的总称。
元素:
决定元素种类的是质子数
原子
质子
中子
电子
?
钠原子(Na)
钠离子(Na+)
失去一个电子
(原子种类没有改变)
钠元素
(电子数不同)
用电子数来判断元素种类
相对原子质量
质子数
中子数
6
6
碳—12
12
碳—14
6
8
14
碳元素
(质子数相同)
(中子数不同)
用中子数来判断元素种类
判断元素的种类
质子数(核电荷数)
钠原子(Na)
钠离子(Na+)
氯化钠(NaCl)
含有钠元素
具有相同质子数(核电荷数)的一类原子的总称。
元素:
(宏观概念)
(只讲种类不论个数)
氯化钠中含有钠元素和氯元素
氯化钠中有一个钠元素
区别
宏观概念,
只讲种类,不讲个数
微观概念,
既讲种类,又讲个数
适用范围
描述物质的宏观组成
描述物质的微观构成
联系
质子数(即核电荷数)相同的一类原子就是同一种元素
元素是原子的一个归类“集体”,原子则是元素的最小单位。即元素和原子是总体和个体的关系。
氯化钠是由钠元素和氯元素组成的
氧气是由氧分子构成的
一个氧分子是由两个氧原子构成的
将质子数为8的原子都归为一类,统称为氧元素
具有相同质子数(核电荷数)的一类原子的总称。
元素:
元素符号
具有相同质子数(核电荷数)的一类原子的总称。
元素:
元素符号
氯原子(Cl)钠原子(Na)
氯离子(Cl–)钠离子(Na+)
(化学用语)
如:氧元素(O)、氮元素(N)
如:钠元素(Na)
元素符号的写法
① 由一个字母表示的元素符号要大写
如:O、N
② 由两个字母表示的元素符号,
(第一个字母大写,第二个字母要小写,“一大二小”)
如:Na、Cl
元素符号的写法
① 由一个字母表示的元素符号要大写
如:O、N
② 由两个字母表示的元素符号,
(第一个字母大写,第二个字母要小写,“一大二小”)
如:Na、Cl
O:
2O:
①氧元素(宏观)
②一个氧原子(微观)
两个氧原子(微观)
元素符号的意义:
①宏观:表示一种元素
②微观:表示这种元素的一个原子
(只讲种类不讲个数)
元素的分类
金属元素:“ 钅”(除汞)
“汞”是唯一一个在常温下呈液态的金属
非金属元素:
气态非金属元素:“ 气 ”,如:氧(O)、氮(N)
液态非金属元素:“ 氵”,如:溴(Br)
固态非金属元素:“ 石 ”,如:碳(C)、磷(P)
稀有气体元素: “ 气 ”
氦(He)、氖(Ne)、氩(Ar)、氪(Kr)、氙(Xe)、氡(Rn)
元素
元素的分布:
1、空气中含量位居前两位的元素:
氮(N)、氧(O)
2、地壳中含量位居前四位的元素:
氧(O)、硅(Si)、铝(Al)、铁(Fe)
地壳中含量最高的非金属元素和金属元素分别是什么?
非金属元素:
氧(O)
金属元素:
铝(Al)
元素的分布:
1、空气中含量位居前两位的元素:
氮(N)、氧(O)
2、地壳中含量位居前四位的元素:
氧(O)、硅(Si)、铝(Al)、铁(Fe)
3、生物细胞当中含量位居前四位的元素:
氧(O)、碳(C)、氢(H)、氮(N)
(非金属元素)
元素周期表
根据元素的原子结构和性质
按照原子序数有序地排列
称为元素周期表
决定元素种类的是原子的质子数(核电荷数)
根据元素的原子结构和性质
按照原子序数有序地排列
称为元素周期表
原子序数=核电荷数=质子数=核外电子数
可以从表中的每个小格内获得元素的哪些信息呢 ?
原子序数=核电荷数=质子数=核外电子数
横行(周期):共7个
纵行(族):18个纵行,
(8、9、10纵行为一族)
金属元素
非金属元素
稀有气体元素
16个族
为什么要按照这样一个结构来进行布局,有什么微妙之处呢?
原子结构示意图
元素周期律:
①每一横行:电子层数相同且等于同期数
从左往右,最外层电子数依次递增
金属元素
非金属元素
稀有气体元素
元素周期律:
①每一横行:电子层数相同且等于同期数
从左往右,最外层电子数依次递增
②每一纵行:从上往下,电子层数依次递增
最外层电子数相同(除He)
元素周期表的意义:
寻找新元素、新物质
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
