氧化还原反应
图片预览




文档简介
课件15张PPT。§2-3 氧化还原反应学习目标:⒈记住并理解有关概念
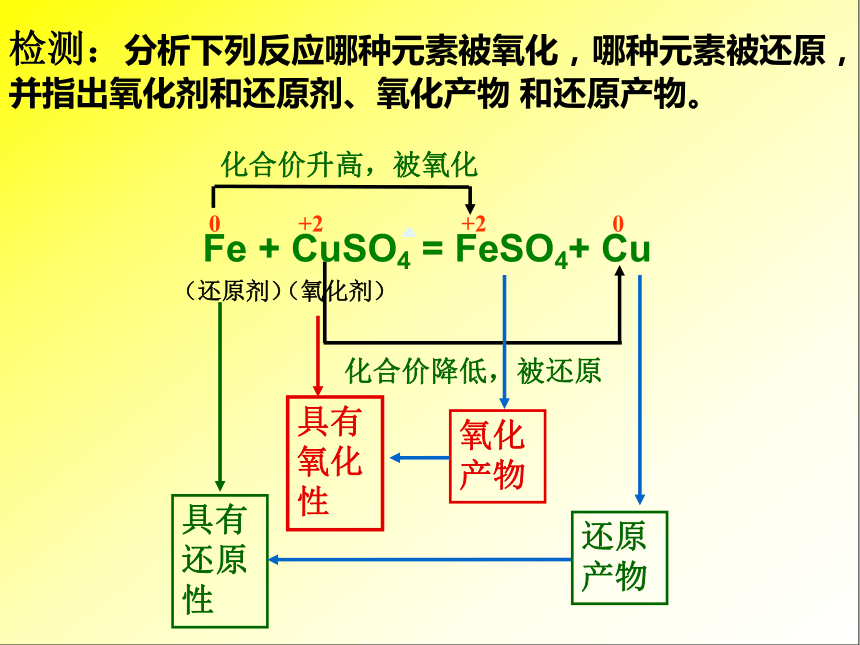
⒉会标电子转移的方向和数目 化合价升高,被氧化 化合价降低,被还原(还原剂)(氧化剂)0 +2 +2 0检测:分析下列反应哪种元素被氧化,哪种元素被还原,并指出氧化剂和还原剂、氧化产物 和还原产物。具有还原性具有氧化性氧化产物还原产物检测一:⑴口述上述概念的本质和特征。
⑵指出下列反应中的氧化剂、还原剂、氧化产物、还原产物。
①2Cu+O2+CO2+H2O=Cu2(OH)2CO3
②S+2KNO3+3C=K2S+N2↑+3CO2↑
①氧化剂O2、还原剂Cu;氧化产物和还原产物都是Cu2 (OH) 2CO3。
②氧化剂S、 KNO3;还原剂C;还原产物K2S、N2 ;氧化产物都是CO2。
0 0 +4 +2 +4 -2 0 +5 0 -2 0 +4 -2③2KMnO4=K2MnO4+MnO2+O2↑
④MnO2+4HCl=MnCl2+2H2O+Cl2↑
+1 +7 -2 +1 +6 -2 +4 0 +4 -2 +1 -1 +2 -1 0③氧化剂和还原剂都是KMnO4;氧化产物O2:还原产物是KMnO4和MnO2。
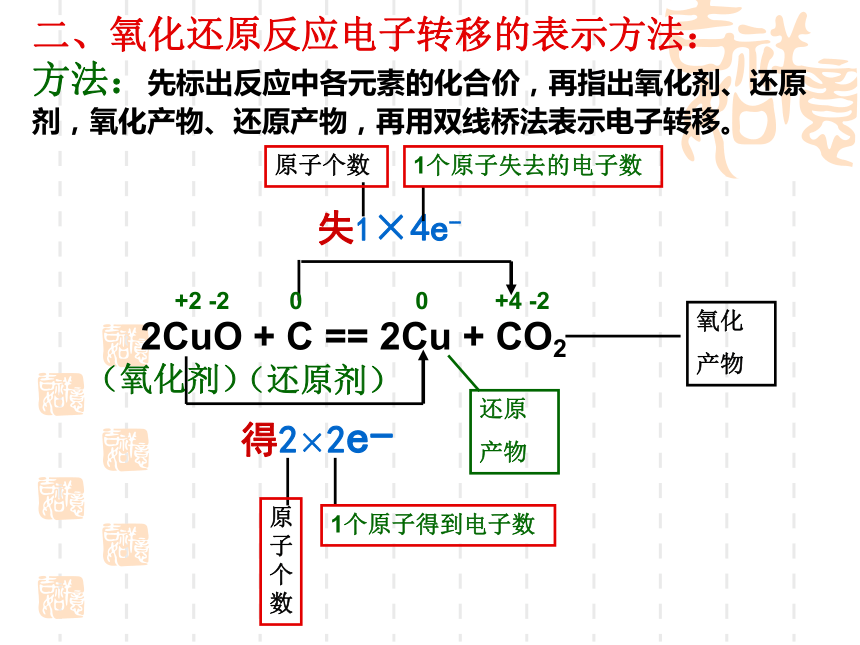
④氧化剂MnO2、还原剂HC1;氧化产物C12 ;还原产物MnCl22CuO + C == 2Cu + CO2 失1×4e- 得2×2e-高温+2 -2 0 0 +4 -2二、氧化还原反应电子转移的表示方法: 方法:先标出反应中各元素的化合价,再指出氧化剂、还原剂,氧化产物、还原产物,再用双线桥法表示电子转移。还原
产物1个原子得到电子数原子个数1个原子失去的电子数(氧化剂)(还原剂)原子个数氧化
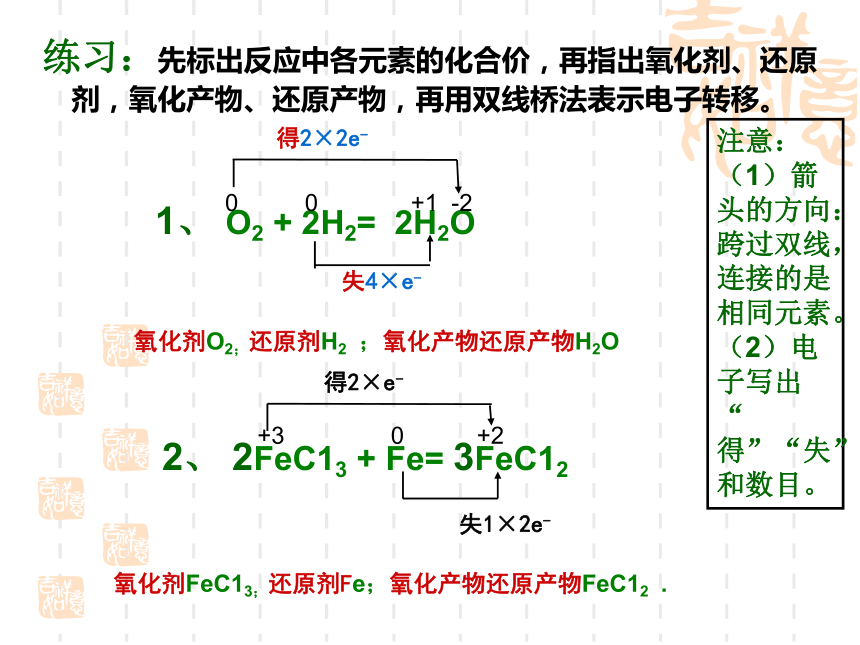
产物练习:先标出反应中各元素的化合价,再指出氧化剂、还原剂,氧化产物、还原产物,再用双线桥法表示电子转移。 1、 O2 + 2H2= 2H2O 2、 2FeC13 + Fe= 3FeC12 0 0 +1 -2得2×2e-失4×e-氧化剂O2;还原剂H2 ;氧化产物还原产物H2O氧化剂FeC13;还原剂Fe;氧化产物还原产物FeC12 .+3 0 +2 得2×e-失1×2e-注意:(1)箭头的方向:跨过双线,连接的是相同元素。
(2)电子写出“得”“失”和数目。练习:先标出反应中各元素的化合价,再指出氧化剂、还原剂,氧化产物、还原产物,再用双线桥法表示电子转移。 3、 Fe + 2HC1 = FeC12+ H2 ↑ 4、 4P + 5O2= 2P2 O50 +1 +2 0失1×2e-得2×e-氧化剂HC1;还原剂Fe;氧化产物FeC12 ;还原产物H2氧化剂O2;还原剂P ;氧化产物还原产物P2O5 .0 0 +5 -2失4×5e-得10×2e-
+4 -2 +1 -1 +2 -1 +1 -2 0
5、MnO2+4HCl==MnCl2+2H2O+Cl2↑得1×2e_失2×e _思考:在下列反应中1molMnO2完全反应,消耗 mol HCl,其中只有 molHCl被氧化而生成 molCl2,有
摩尔电子发生转移?
4212mol思考:在下列反应中2molMnO2完全反应,消耗 mol HCl,其中只有 molHCl被氧化而生成 molCl2,有
摩尔电子发生转移?
2.单线桥表示法: CuO + H2== Cu + H2O说明:⑴箭头方向由失电子的元素 指向得电子的元素(即由还原剂指向氧化剂)。
⑵数目为整个过程中得失电子总数。
2e-
1、2FeCl2+Cl2=2FeCl3
2、MnO2+4HCl=MnCl2+2H2O+Cl2↑
+2 -1 0 +3 -1 2e-+4 -2 +1 -1 +2 -1 +1 -2 0
2e-练一练练习:先标出反应中各元素的化合价,再指出氧化剂、还原剂,氧化产物、还原产物,再用单线桥法表示电子转移。 3、 O2 + 2H2= 2H2O 4、 2FeC13 + Fe= 3FeC12 0 0 +1 -24e-氧化剂O2;还原剂H2 ;氧化产物还原产物H2O氧化剂FeC13;还原剂Fe;氧化产物还原产物FeC12 .+3 0 +2 2e- 1、书写离子方程式时,拆成离子的物质有哪些?请写出!
2、不拆的:单质、氧化物、气体、水、 沉淀(参考溶解性表)。(1)强酸:HC1、HNO3、H2SO4
(2)强碱:NaOH、KOH、Ba(OH) 2 石灰水拆!
(3)可溶性盐:钠盐、钾盐、铵盐、硝酸盐
氯化物除AgC1;硫酸盐除BaSO4
注意:NaHCO3=Na++HCO3-同学们出现错误最多的离子方程式:1、NaHCO3=Na++HCO3- ( HCO3-不拆成开)
NaHCO3与HC1、HNO3、H2SO4反应的离子方程式为:
HCO3- +H+=CO2 ↑ + H2O
2、CaCO3与HC1反应的离子方程式(谁再错写100遍)
CaCO3 +2H+=Ca2+ + CO2 ↑ + H2O
3、Fe与HC1 【H2SO4 】反应的离子方程式(Fe是单质不拆!)
Fe +2H+= Fe 2+ + H2 ↑
4、 Fe(OH) 3与HC1反应的离子方程式【Fe(OH) 3是沉淀不拆!]
Fe(OH) 3 +3H+= Fe 3+ + 3H2O
5、MgO与HC1反应的离子方程式【氧化物不拆!]
MgO+2H+= Mg2+ + 2H2O
作业:标出下列反应中元素的化合价,用双线桥或单线桥分别表示出反应中电子的转移情况,再指出各反应的氧化剂、还原剂、氧化产物和还原产物;写出对应的离子方程式。
⒈Cu+ 2AgNO3 = Cu(NO3 ) 2 + 2Ag
⒉ 3Cu + 8HNO3= Cu(NO3 ) 2 + 2NO ↑ +4H2O
⒊ Mg + H2SO4 = MgSO4 + H2↑
⒋ Mg + CuSO4= MgSO4 +Cu
5、 2FeC13 + Fe= 3FeC12
6、 2FeC13 +Cu = 2FeC12 +CuC12
⒉会标电子转移的方向和数目 化合价升高,被氧化 化合价降低,被还原(还原剂)(氧化剂)0 +2 +2 0检测:分析下列反应哪种元素被氧化,哪种元素被还原,并指出氧化剂和还原剂、氧化产物 和还原产物。具有还原性具有氧化性氧化产物还原产物检测一:⑴口述上述概念的本质和特征。
⑵指出下列反应中的氧化剂、还原剂、氧化产物、还原产物。
①2Cu+O2+CO2+H2O=Cu2(OH)2CO3
②S+2KNO3+3C=K2S+N2↑+3CO2↑
①氧化剂O2、还原剂Cu;氧化产物和还原产物都是Cu2 (OH) 2CO3。
②氧化剂S、 KNO3;还原剂C;还原产物K2S、N2 ;氧化产物都是CO2。
0 0 +4 +2 +4 -2 0 +5 0 -2 0 +4 -2③2KMnO4=K2MnO4+MnO2+O2↑
④MnO2+4HCl=MnCl2+2H2O+Cl2↑
+1 +7 -2 +1 +6 -2 +4 0 +4 -2 +1 -1 +2 -1 0③氧化剂和还原剂都是KMnO4;氧化产物O2:还原产物是KMnO4和MnO2。
④氧化剂MnO2、还原剂HC1;氧化产物C12 ;还原产物MnCl22CuO + C == 2Cu + CO2 失1×4e- 得2×2e-高温+2 -2 0 0 +4 -2二、氧化还原反应电子转移的表示方法: 方法:先标出反应中各元素的化合价,再指出氧化剂、还原剂,氧化产物、还原产物,再用双线桥法表示电子转移。还原
产物1个原子得到电子数原子个数1个原子失去的电子数(氧化剂)(还原剂)原子个数氧化
产物练习:先标出反应中各元素的化合价,再指出氧化剂、还原剂,氧化产物、还原产物,再用双线桥法表示电子转移。 1、 O2 + 2H2= 2H2O 2、 2FeC13 + Fe= 3FeC12 0 0 +1 -2得2×2e-失4×e-氧化剂O2;还原剂H2 ;氧化产物还原产物H2O氧化剂FeC13;还原剂Fe;氧化产物还原产物FeC12 .+3 0 +2 得2×e-失1×2e-注意:(1)箭头的方向:跨过双线,连接的是相同元素。
(2)电子写出“得”“失”和数目。练习:先标出反应中各元素的化合价,再指出氧化剂、还原剂,氧化产物、还原产物,再用双线桥法表示电子转移。 3、 Fe + 2HC1 = FeC12+ H2 ↑ 4、 4P + 5O2= 2P2 O50 +1 +2 0失1×2e-得2×e-氧化剂HC1;还原剂Fe;氧化产物FeC12 ;还原产物H2氧化剂O2;还原剂P ;氧化产物还原产物P2O5 .0 0 +5 -2失4×5e-得10×2e-
+4 -2 +1 -1 +2 -1 +1 -2 0
5、MnO2+4HCl==MnCl2+2H2O+Cl2↑得1×2e_失2×e _思考:在下列反应中1molMnO2完全反应,消耗 mol HCl,其中只有 molHCl被氧化而生成 molCl2,有
摩尔电子发生转移?
4212mol思考:在下列反应中2molMnO2完全反应,消耗 mol HCl,其中只有 molHCl被氧化而生成 molCl2,有
摩尔电子发生转移?
2.单线桥表示法: CuO + H2== Cu + H2O说明:⑴箭头方向由失电子的元素 指向得电子的元素(即由还原剂指向氧化剂)。
⑵数目为整个过程中得失电子总数。
2e-
1、2FeCl2+Cl2=2FeCl3
2、MnO2+4HCl=MnCl2+2H2O+Cl2↑
+2 -1 0 +3 -1 2e-+4 -2 +1 -1 +2 -1 +1 -2 0
2e-练一练练习:先标出反应中各元素的化合价,再指出氧化剂、还原剂,氧化产物、还原产物,再用单线桥法表示电子转移。 3、 O2 + 2H2= 2H2O 4、 2FeC13 + Fe= 3FeC12 0 0 +1 -24e-氧化剂O2;还原剂H2 ;氧化产物还原产物H2O氧化剂FeC13;还原剂Fe;氧化产物还原产物FeC12 .+3 0 +2 2e- 1、书写离子方程式时,拆成离子的物质有哪些?请写出!
2、不拆的:单质、氧化物、气体、水、 沉淀(参考溶解性表)。(1)强酸:HC1、HNO3、H2SO4
(2)强碱:NaOH、KOH、Ba(OH) 2 石灰水拆!
(3)可溶性盐:钠盐、钾盐、铵盐、硝酸盐
氯化物除AgC1;硫酸盐除BaSO4
注意:NaHCO3=Na++HCO3-同学们出现错误最多的离子方程式:1、NaHCO3=Na++HCO3- ( HCO3-不拆成开)
NaHCO3与HC1、HNO3、H2SO4反应的离子方程式为:
HCO3- +H+=CO2 ↑ + H2O
2、CaCO3与HC1反应的离子方程式(谁再错写100遍)
CaCO3 +2H+=Ca2+ + CO2 ↑ + H2O
3、Fe与HC1 【H2SO4 】反应的离子方程式(Fe是单质不拆!)
Fe +2H+= Fe 2+ + H2 ↑
4、 Fe(OH) 3与HC1反应的离子方程式【Fe(OH) 3是沉淀不拆!]
Fe(OH) 3 +3H+= Fe 3+ + 3H2O
5、MgO与HC1反应的离子方程式【氧化物不拆!]
MgO+2H+= Mg2+ + 2H2O
作业:标出下列反应中元素的化合价,用双线桥或单线桥分别表示出反应中电子的转移情况,再指出各反应的氧化剂、还原剂、氧化产物和还原产物;写出对应的离子方程式。
⒈Cu+ 2AgNO3 = Cu(NO3 ) 2 + 2Ag
⒉ 3Cu + 8HNO3= Cu(NO3 ) 2 + 2NO ↑ +4H2O
⒊ Mg + H2SO4 = MgSO4 + H2↑
⒋ Mg + CuSO4= MgSO4 +Cu
5、 2FeC13 + Fe= 3FeC12
6、 2FeC13 +Cu = 2FeC12 +CuC12
