1.2探索酸的性质(第一课时)
图片预览






文档简介
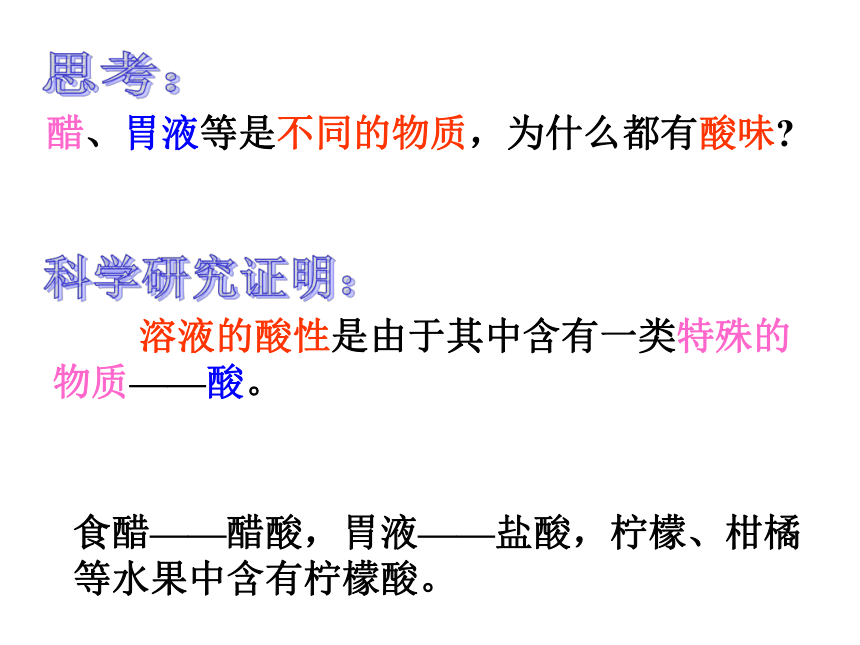
课件23张PPT。第二节 探索酸的性质第一课时当我们看到这些水果时,会有什么样的感觉呢?酸说一说:生活中有哪些东西是酸的? 胃酸、醋、酸梅、牛奶、可乐、雪碧等食醋——醋酸,胃液——盐酸,柠檬、柑橘等水果中含有柠檬酸。一、一些物质的电离2、电离:带电的原子或原子集团。1、离子:一些物质溶解于水或受热熔化时,离解成自由移动的离子的过程,叫做电离带正电荷的叫阳离子。带负电荷的叫阴离子。那么,为什么说这些物质都是酸呢?这样的溶液因含有自由离子,所以可以导电判断:
1、氯化钠在通电后发生电离,所以,
它的水溶液能导电。
2、氯化钠固体中无离子,所以不能导电。
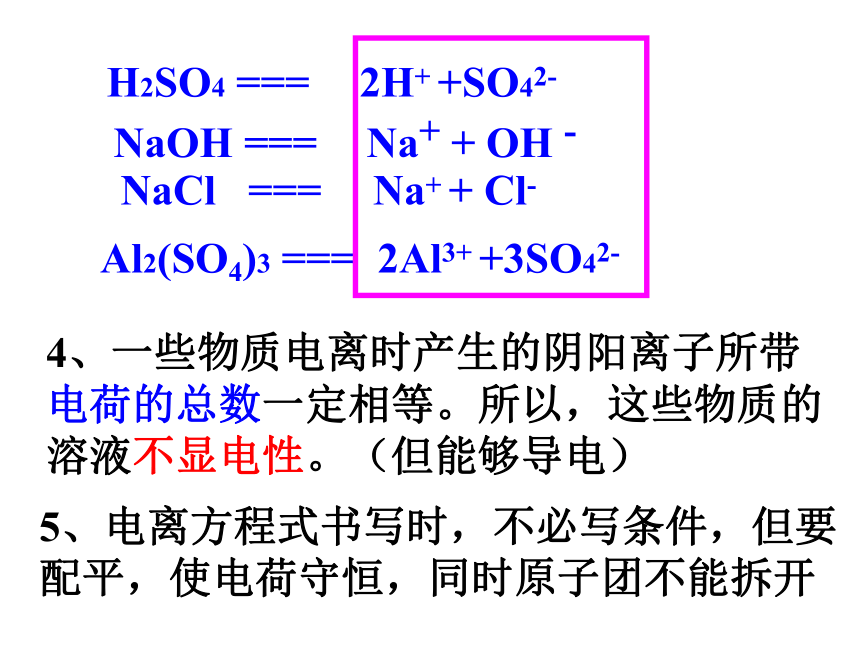
3、酒精溶液不能导电错错对3、电离的表示方法——电离方程式。NaOH ===NaCl ===H2SO4 ===电离方程式的书写:
1.左写分子式,右写离子符号
2.离子所带电荷可由化合价来确定,
标注在元素符号的右上角
3.原子团在电离过程中通常不分开2H+ +SO42-Na+ + Cl-Na+ + OH -Al2(SO4)3 ===2Al3+ +3SO42-4、一些物质电离时产生的阴阳离子所带电荷的总数一定相等。所以,这些物质的溶液不显电性。(但能够导电)5、电离方程式书写时,不必写条件,但要配平,使电荷守恒,同时原子团不能拆开NaOH ===NaCl ===H2SO4 ===2H+ +SO42-Na+ + Cl-Na+ + OH -Al2(SO4)3 ===2Al3+ +3SO42-盐酸:
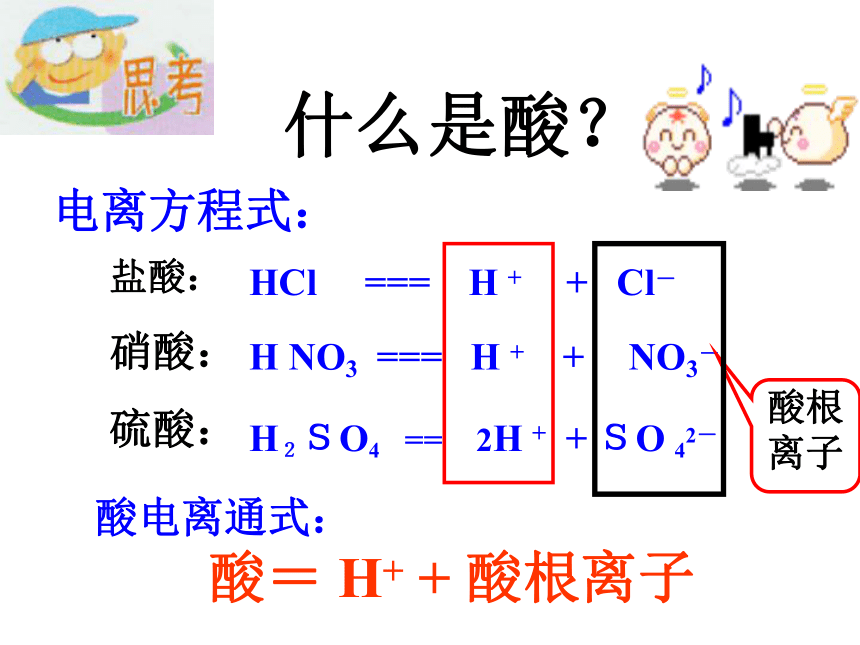
硝酸:
硫酸:HCl === H + + Cl-电离方程式:H NO3 === H + + NO3-H2SO4 == 2H + + SO 42-
酸电离通式:酸= H+ + 酸根离子什么是酸? 电离时产生的阳离子全部都是氢离子(H+)的化合物。一、什么是酸强酸:盐酸(HCl)、硫酸(H2SO4)、
硝酸(HNO3)
弱酸:醋酸(CH3COOH)试一试:你能写出常见的酸的酸根吗?想一想:1.在水溶液里能电离产生氢离子的化合物一定
是酸吗?2.酸一定含氢元素与氧元素,对吗?3.二氧化碳溶于水后也会产生氢离子,
二氧化碳是酸吗?错NaHSO4===Na+ + H+ + SO42-HCl氢氧化钠:
氢氧化钾:
氢氧化钡:NaOH === Na + + OH-写出电离方程式:KOH === k + + OH-Ba(OH)2 == Ba2+ + 2OH-
碱电离通式:碱= 金属离子 + OH-什么是碱? 碱是电离时产生的阴离子全部都是氢氧根离子(OH-)的化合物。判断:Cu2(OH)2CO3电离时有OH-离子,因此碱式碳酸铜是碱对吗?为什么?Cu2(OH)2CO3===2Cu2++2OH-+CO32-氯化钠:
硝酸钾:
硫酸钾:NaCl === Na + + Cl-写出电离方程式:KNO3 === k + + NO3-K2SO4 == 2K+ + SO4-
盐电离通式:盐= 金属离子(或铵根离子) + 酸根离子什么是盐?盐是电离时能生成金属离子(或铵根离子) 和 酸根离子的化合物。小结:酸= H+ + 酸根离子碱= 金属离子 + OH-盐= 金属离子(或铵根离子) + 酸根离子阳离子所带正电荷总数等于阴离子所带负电荷总数pH>7,碱性; pH =7,中性;pH<7,酸性那么,你知道还有什么方法可以测定物质的酸碱性?酸碱指示剂石蕊遇酸变红,遇碱变蓝;
酚酞遇酸不变色,遇碱变红。pH试纸3、酸碱指示剂可以定性地测定溶液的
酸碱性。4、常见指示剂在酸、碱性溶液中的颜色红色红色红色无色蓝色蓝色不变色不变色1、用玻璃棒分别蘸取少许水、氢氧化钠、盐酸,点在pH试纸中部,观察试纸的颜色变化。
2、在白色点滴板的空穴(或小试管)里分别滴入几滴上述样品,再滴加2—3滴紫色石蕊试液,观察其颜色的变化,并将结果填入表中。实验现象:物 质 的 颜 色 变 化不变色蓝红紫色蓝红石蕊遇酸变红,遇碱变蓝;
酚酞遇酸不变色,遇碱变红。五、自制酸碱指示剂1、取一些月季花、菊花、丝瓜花、一串红等植物的花、果、枝叶切碎、捣烂,用酒精浸制,所得的浸出液可以作为酸碱指示剂。P82、取食盐水、白醋、石灰水加以试验。并纪录变色情况。1、下列物质不属于酸的是 ( )
A、HNO3 B、NaHCO3
C、H3PO4 D、HI
2、用简单的方法区别水和硫酸,并写出实验步骤。
3、思考:一位科学家在做研究时不小心将盐酸滴到了紫花上,紫花逐渐变红色。看到这么个现象,许多问题在他的脑子里涌现出来,如果你是那个科学家,你会有什么问题,你会有什么想法?B练习:4.下列各组离子属于酸电离产生的是( )
A.H+、NO3-、SO42- B.OH-、Ba2+
C.H+、Na+、SO42- D. Na+ 、Ba2+、 Cl-
5.某一溶液的PH=2,该溶液呈 性,它能使紫色石蕊试液 色,无色酚酞试液 ,使蓝色石蕊试纸变 色。
6.下表列出了家庭中某些物质的PH:
上述物质能使无色酚酞试液变红色的是 . A酸红不变色红牙膏、 肥皂水7.将一定质量分数的硫酸溶液加水稀释,
下图正确表示PH变化的是( )
A
1、氯化钠在通电后发生电离,所以,
它的水溶液能导电。
2、氯化钠固体中无离子,所以不能导电。
3、酒精溶液不能导电错错对3、电离的表示方法——电离方程式。NaOH ===NaCl ===H2SO4 ===电离方程式的书写:
1.左写分子式,右写离子符号
2.离子所带电荷可由化合价来确定,
标注在元素符号的右上角
3.原子团在电离过程中通常不分开2H+ +SO42-Na+ + Cl-Na+ + OH -Al2(SO4)3 ===2Al3+ +3SO42-4、一些物质电离时产生的阴阳离子所带电荷的总数一定相等。所以,这些物质的溶液不显电性。(但能够导电)5、电离方程式书写时,不必写条件,但要配平,使电荷守恒,同时原子团不能拆开NaOH ===NaCl ===H2SO4 ===2H+ +SO42-Na+ + Cl-Na+ + OH -Al2(SO4)3 ===2Al3+ +3SO42-盐酸:
硝酸:
硫酸:HCl === H + + Cl-电离方程式:H NO3 === H + + NO3-H2SO4 == 2H + + SO 42-
酸电离通式:酸= H+ + 酸根离子什么是酸? 电离时产生的阳离子全部都是氢离子(H+)的化合物。一、什么是酸强酸:盐酸(HCl)、硫酸(H2SO4)、
硝酸(HNO3)
弱酸:醋酸(CH3COOH)试一试:你能写出常见的酸的酸根吗?想一想:1.在水溶液里能电离产生氢离子的化合物一定
是酸吗?2.酸一定含氢元素与氧元素,对吗?3.二氧化碳溶于水后也会产生氢离子,
二氧化碳是酸吗?错NaHSO4===Na+ + H+ + SO42-HCl氢氧化钠:
氢氧化钾:
氢氧化钡:NaOH === Na + + OH-写出电离方程式:KOH === k + + OH-Ba(OH)2 == Ba2+ + 2OH-
碱电离通式:碱= 金属离子 + OH-什么是碱? 碱是电离时产生的阴离子全部都是氢氧根离子(OH-)的化合物。判断:Cu2(OH)2CO3电离时有OH-离子,因此碱式碳酸铜是碱对吗?为什么?Cu2(OH)2CO3===2Cu2++2OH-+CO32-氯化钠:
硝酸钾:
硫酸钾:NaCl === Na + + Cl-写出电离方程式:KNO3 === k + + NO3-K2SO4 == 2K+ + SO4-
盐电离通式:盐= 金属离子(或铵根离子) + 酸根离子什么是盐?盐是电离时能生成金属离子(或铵根离子) 和 酸根离子的化合物。小结:酸= H+ + 酸根离子碱= 金属离子 + OH-盐= 金属离子(或铵根离子) + 酸根离子阳离子所带正电荷总数等于阴离子所带负电荷总数pH>7,碱性; pH =7,中性;pH<7,酸性那么,你知道还有什么方法可以测定物质的酸碱性?酸碱指示剂石蕊遇酸变红,遇碱变蓝;
酚酞遇酸不变色,遇碱变红。pH试纸3、酸碱指示剂可以定性地测定溶液的
酸碱性。4、常见指示剂在酸、碱性溶液中的颜色红色红色红色无色蓝色蓝色不变色不变色1、用玻璃棒分别蘸取少许水、氢氧化钠、盐酸,点在pH试纸中部,观察试纸的颜色变化。
2、在白色点滴板的空穴(或小试管)里分别滴入几滴上述样品,再滴加2—3滴紫色石蕊试液,观察其颜色的变化,并将结果填入表中。实验现象:物 质 的 颜 色 变 化不变色蓝红紫色蓝红石蕊遇酸变红,遇碱变蓝;
酚酞遇酸不变色,遇碱变红。五、自制酸碱指示剂1、取一些月季花、菊花、丝瓜花、一串红等植物的花、果、枝叶切碎、捣烂,用酒精浸制,所得的浸出液可以作为酸碱指示剂。P82、取食盐水、白醋、石灰水加以试验。并纪录变色情况。1、下列物质不属于酸的是 ( )
A、HNO3 B、NaHCO3
C、H3PO4 D、HI
2、用简单的方法区别水和硫酸,并写出实验步骤。
3、思考:一位科学家在做研究时不小心将盐酸滴到了紫花上,紫花逐渐变红色。看到这么个现象,许多问题在他的脑子里涌现出来,如果你是那个科学家,你会有什么问题,你会有什么想法?B练习:4.下列各组离子属于酸电离产生的是( )
A.H+、NO3-、SO42- B.OH-、Ba2+
C.H+、Na+、SO42- D. Na+ 、Ba2+、 Cl-
5.某一溶液的PH=2,该溶液呈 性,它能使紫色石蕊试液 色,无色酚酞试液 ,使蓝色石蕊试纸变 色。
6.下表列出了家庭中某些物质的PH:
上述物质能使无色酚酞试液变红色的是 . A酸红不变色红牙膏、 肥皂水7.将一定质量分数的硫酸溶液加水稀释,
下图正确表示PH变化的是( )
A
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
