1.2.2离子反应及其发生条件 课件 2022-2023学年高一上学期化学人教版(2019)必修第一册(共25张PPT)
文档属性
| 名称 | 1.2.2离子反应及其发生条件 课件 2022-2023学年高一上学期化学人教版(2019)必修第一册(共25张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-01 08:35:32 | ||
图片预览






文档简介
(共25张PPT)
化学人教版必修一
第二节 离子反应
第二课时
离子反应及其发生的条件
本节课的学习目标
1.知道什么是离子反应
2.学会书写离子方程式
3.理解离子反应发生的条件
【复习提问】
1、上节课学习了电解质、强电解质,举例说明强电解质有哪些?
2、写出下列电解质在水溶液中的电离方程式
硫酸铜 .
氯化钡 .
氯化氢 。
思考:下列表示是否正确?
醋酸 CH3COOH=CH3COO- + H+
水 H2O=H+ + OH-
硫酸钡 BaSO4=Ba2+ + SO42-
新课引入
今天我们学习离子反应,离子反应是指电解质在溶液里的
反应,那么,
两种或多种电解质在溶液中可以共同存在吗?
它们会发生怎样的反应?
反应有什么条件?
怎么样表示呢?
带着这些问题我们进行今天的学习研究。
5mL
氢氧化钡溶液
5mL
氢氧化钡溶液
5mL
氢氧化钡溶液
5mL
氢氧化钡溶液
a
b
c
d
1.分别滴加a.硫酸b.硫酸钠c.稀盐酸d.氯化钠观察现象
2.再各滴加几点酚酞溶液观察现象
实验探究1
a
b
c
d
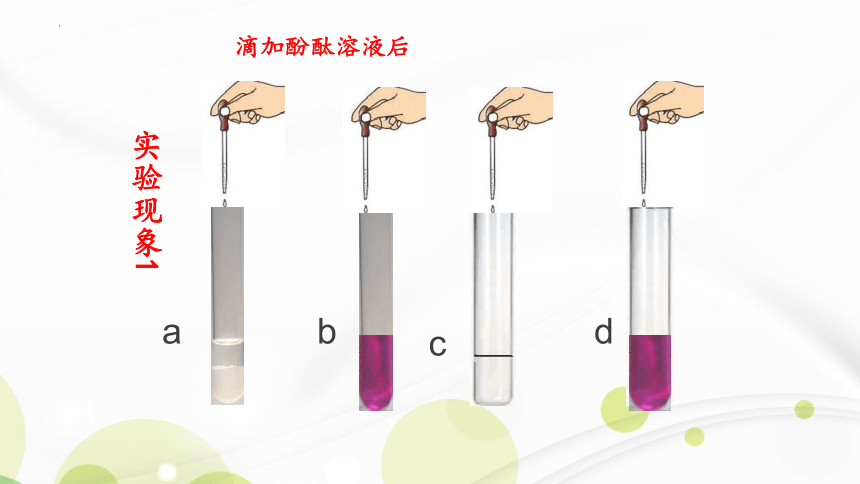
实验现象1
滴加酚酞溶液后
首先试管a、b中产生了白色沉淀,c、d中没
有明显变化,滴入酚酞后,发现b、d中溶液
变红而a、c中溶液颜色没有明显变化。
实验现象
2H2O
BaSO4
Ba(OH)2
Ba2+
2OH-
2H+
+
+
Na2SO4
Ba2+
2OH-
SO42-
2Na+
BaSO4
.
2OH-
+
+
2Na+
BaSO4
a试管中
b试管中
H2SO4
SO42-
BaSO4 + 2H2O
Ba(OH)2
实验1
Ba(OH)2
Ba2+
2OH-
2H+
2Cl-
+
+
Ba2+
2OH-
NaCl
Ba2+
2OH-
Cl-
Na+
+
+
Na+
c试管中
d试管中
2HCl
2Cl-
2H2O
2H2O
Ba2+
Ba(OH)2
不反应
Cl-
实验1
a试管中
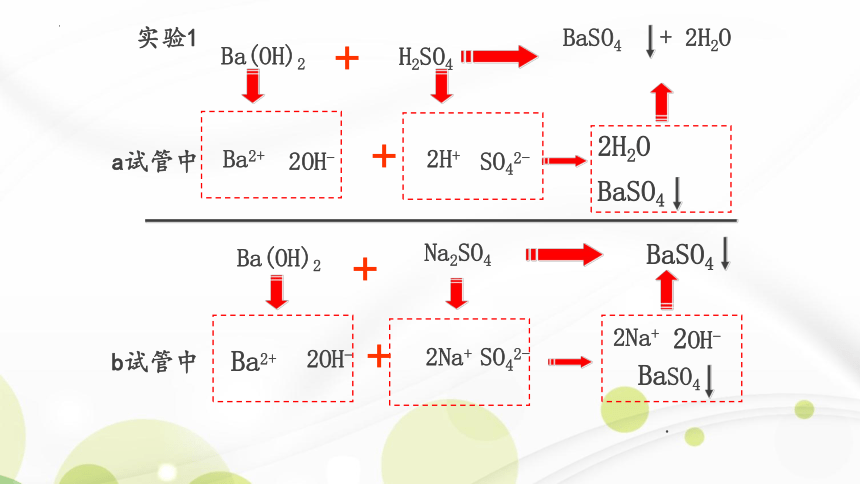
Ba2+ + SO42- + 2H+ + 2OH- = BaSO4 + 2H2O
b试管中
Ba2+ + SO42- = BaSO4
c试管中
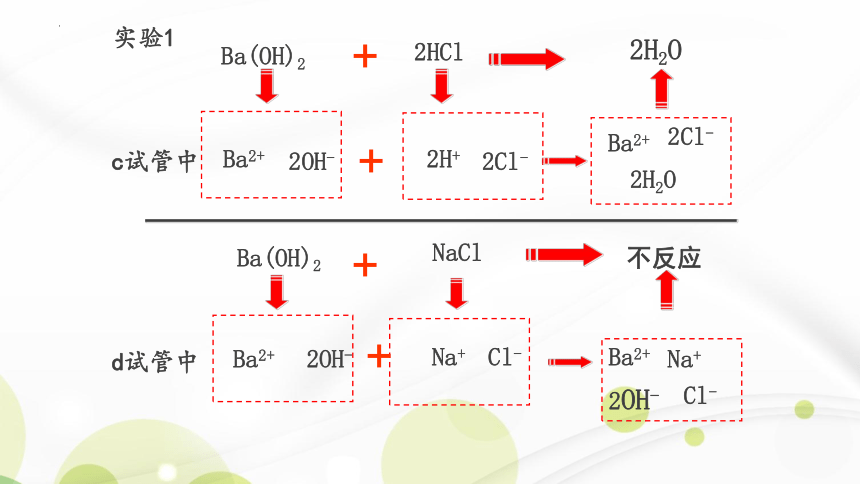
2H+ + 2OH- = 2H2O
d试管中
H+ + OH- = H2O
实验1分析
不反应
实验探究2
a
b
CuSO4和NaCl的混合液
CuCl2和Na2SO4的混合液
分别滴加BaCl2溶液
实验2
两个反应的实质相同,都是Ba2+ + SO42- = BaSO4
生成了白色沉淀BaSO4,即离子反应是化学反应的实质
一、离子反应
1.离子反应的概念:电解质在溶液中的反应实质是__________的反应。
离子之间
2.离子反应的表示方法——离子方程式
1)概念:用实际参加反应的__________来表示反应的
式子
离子符号
2).正确书写离子方程式的步骤
(1)写出正确的化学方程式:
例: 2AgNO3+CuCl2== 2AgCl↓+Cu(NO3)2
(2)把易溶于水、易电离(强酸\强碱\可溶性盐)的物质拆写成离子形式。难溶或难电离的物质以及气体等仍用化学式表示。
2Ag++2NO3-+Cu2++2Cl- == 2AgCl↓+Cu2++2NO3-
(3)删去方程式两边形式相同的离子:
(4)整理方程式并检查两边各元素的原子
个数和电荷总数是否相等:
2Ag++2NO3-+Cu2++2Cl- == 2AgCl↓+Cu2++2NO3-
2Ag+ +2Cl- == 2AgCl↓
Ag+ + Cl- == AgCl↓
能拆的→
强酸HCl、H2SO4、HNO3等;
强碱NaOH、KOH、Ba(OH)2等;
绝大多数可溶性盐:看课本P110页的溶解表
易溶且易电离的物质
(对于易电离的微溶反应物,改写时把握“清拆浑不拆”的原则,而微溶的生成物则“不拆”。)
A .① ② ④ ⑤ B. ② ③ ④ ⑧ ⑨
C. ①⑤ ⑥ ⑦ D. ③ ④ ⑥
练习:下列物质在书写离子反应方程式时可以拆成离子形式的是( )
① Cu(OH)2 ②Na2CO3 ③ K2SO4 ④ NaOH⑤CaCO3 ⑥BaSO4 ⑦H2O ⑧H2SO4 ⑨HCl
B
练习:写出下列反应的离子方程式
(1)盐酸与氢氧化钠溶液反应
(2)硫酸与氢氧化钾溶液反应
(3)硫酸钠溶液与氯化钡溶液反应
(4)硫酸铜溶液与硝酸钡溶液反应
SO42-+Ba2+=BaSO4↓
不仅可表示一定物质间的反应,而且可表示所有同一类型的反应
H+ + OH- = H2O
3). 离子方程式的意义
【思考与交流】
下列离子方程式能表示哪些物质之间的反应?能写出化学方程式吗?
⑴Ca2++CO32—=CaCO3↓
⑵Cu2++2OH—=Cu(OH)2↓
科学探究
【实验2-3】
实验内容 实验现象 化学方程式 离子方程式
1、向盛有约2mLCuSO4溶液的试管里加入约2mLNaOH溶液。
2、向盛有约2mLNaOH溶液的试管里加入几滴酚酞溶液,再用滴管向试管中慢慢滴入稀盐酸,至溶液恰好变色为止。
3、向盛有约2mLNa2CO3溶液的试管里滴入大约2mL稀盐酸 溶液。
完成实验报告,分析复分解型离子反应发生的条件?
科学探究
【实验2-3】
实验内容 实验现象 化学方程式 离子方程式
1、向盛有约2mLCuSO4溶液的试管里加入约2mLNaOH溶液。 生成蓝色沉淀 CuSO4+2NaOH= Cu(OH)2↓+Na2SO4 Cu2++2OH- =
Cu(OH)2↓
2、向盛有约2mLNaOH溶液的试管里加入几滴酚酞溶液,再用滴管向试管中慢慢滴入稀盐酸,至溶液恰好变色为止。 溶液先变红,随盐酸滴入,红色褪去 NaOH+HCl=NaCl +H2O
H++OH-= H2O
3、向盛有约2mLNa2CO3溶液的试管里滴入大约2mL稀盐酸 溶液。 气泡产生 Na2CO3+2HCl= 2NaCl+H2O+CO2↑ CO32-+2H+=
H2O+CO2↑
讨论总结复分解型离子反应的条件:
思考:以下方程可以反应,试分析反应可以进行的条件,已知其中的醋酸铅是易溶的弱电解质的盐。
2CH3COONa +Pb(NO3)2==Pb(CH3COO)2+ 2NaNO3
复分解型离子反应的条件:有气体、沉淀、弱电解质生成
有气体、沉淀、水生成
本课小结
1.离子反应:
2.离子方程式:
3.离子反应发生的条件
离子反应及其发生的条件
1).概念
2).书写步骤
3). 意义
谈一谈你对离子反应
“H+ + OH- = H2O”的认识?
课后思考
作业
P33 2、5、6、7、9、10
谢谢!
欢迎大家批评指正
化学人教版必修一
第二节 离子反应
第二课时
离子反应及其发生的条件
本节课的学习目标
1.知道什么是离子反应
2.学会书写离子方程式
3.理解离子反应发生的条件
【复习提问】
1、上节课学习了电解质、强电解质,举例说明强电解质有哪些?
2、写出下列电解质在水溶液中的电离方程式
硫酸铜 .
氯化钡 .
氯化氢 。
思考:下列表示是否正确?
醋酸 CH3COOH=CH3COO- + H+
水 H2O=H+ + OH-
硫酸钡 BaSO4=Ba2+ + SO42-
新课引入
今天我们学习离子反应,离子反应是指电解质在溶液里的
反应,那么,
两种或多种电解质在溶液中可以共同存在吗?
它们会发生怎样的反应?
反应有什么条件?
怎么样表示呢?
带着这些问题我们进行今天的学习研究。
5mL
氢氧化钡溶液
5mL
氢氧化钡溶液
5mL
氢氧化钡溶液
5mL
氢氧化钡溶液
a
b
c
d
1.分别滴加a.硫酸b.硫酸钠c.稀盐酸d.氯化钠观察现象
2.再各滴加几点酚酞溶液观察现象
实验探究1
a
b
c
d
实验现象1
滴加酚酞溶液后
首先试管a、b中产生了白色沉淀,c、d中没
有明显变化,滴入酚酞后,发现b、d中溶液
变红而a、c中溶液颜色没有明显变化。
实验现象
2H2O
BaSO4
Ba(OH)2
Ba2+
2OH-
2H+
+
+
Na2SO4
Ba2+
2OH-
SO42-
2Na+
BaSO4
.
2OH-
+
+
2Na+
BaSO4
a试管中
b试管中
H2SO4
SO42-
BaSO4 + 2H2O
Ba(OH)2
实验1
Ba(OH)2
Ba2+
2OH-
2H+
2Cl-
+
+
Ba2+
2OH-
NaCl
Ba2+
2OH-
Cl-
Na+
+
+
Na+
c试管中
d试管中
2HCl
2Cl-
2H2O
2H2O
Ba2+
Ba(OH)2
不反应
Cl-
实验1
a试管中
Ba2+ + SO42- + 2H+ + 2OH- = BaSO4 + 2H2O
b试管中
Ba2+ + SO42- = BaSO4
c试管中
2H+ + 2OH- = 2H2O
d试管中
H+ + OH- = H2O
实验1分析
不反应
实验探究2
a
b
CuSO4和NaCl的混合液
CuCl2和Na2SO4的混合液
分别滴加BaCl2溶液
实验2
两个反应的实质相同,都是Ba2+ + SO42- = BaSO4
生成了白色沉淀BaSO4,即离子反应是化学反应的实质
一、离子反应
1.离子反应的概念:电解质在溶液中的反应实质是__________的反应。
离子之间
2.离子反应的表示方法——离子方程式
1)概念:用实际参加反应的__________来表示反应的
式子
离子符号
2).正确书写离子方程式的步骤
(1)写出正确的化学方程式:
例: 2AgNO3+CuCl2== 2AgCl↓+Cu(NO3)2
(2)把易溶于水、易电离(强酸\强碱\可溶性盐)的物质拆写成离子形式。难溶或难电离的物质以及气体等仍用化学式表示。
2Ag++2NO3-+Cu2++2Cl- == 2AgCl↓+Cu2++2NO3-
(3)删去方程式两边形式相同的离子:
(4)整理方程式并检查两边各元素的原子
个数和电荷总数是否相等:
2Ag++2NO3-+Cu2++2Cl- == 2AgCl↓+Cu2++2NO3-
2Ag+ +2Cl- == 2AgCl↓
Ag+ + Cl- == AgCl↓
能拆的→
强酸HCl、H2SO4、HNO3等;
强碱NaOH、KOH、Ba(OH)2等;
绝大多数可溶性盐:看课本P110页的溶解表
易溶且易电离的物质
(对于易电离的微溶反应物,改写时把握“清拆浑不拆”的原则,而微溶的生成物则“不拆”。)
A .① ② ④ ⑤ B. ② ③ ④ ⑧ ⑨
C. ①⑤ ⑥ ⑦ D. ③ ④ ⑥
练习:下列物质在书写离子反应方程式时可以拆成离子形式的是( )
① Cu(OH)2 ②Na2CO3 ③ K2SO4 ④ NaOH⑤CaCO3 ⑥BaSO4 ⑦H2O ⑧H2SO4 ⑨HCl
B
练习:写出下列反应的离子方程式
(1)盐酸与氢氧化钠溶液反应
(2)硫酸与氢氧化钾溶液反应
(3)硫酸钠溶液与氯化钡溶液反应
(4)硫酸铜溶液与硝酸钡溶液反应
SO42-+Ba2+=BaSO4↓
不仅可表示一定物质间的反应,而且可表示所有同一类型的反应
H+ + OH- = H2O
3). 离子方程式的意义
【思考与交流】
下列离子方程式能表示哪些物质之间的反应?能写出化学方程式吗?
⑴Ca2++CO32—=CaCO3↓
⑵Cu2++2OH—=Cu(OH)2↓
科学探究
【实验2-3】
实验内容 实验现象 化学方程式 离子方程式
1、向盛有约2mLCuSO4溶液的试管里加入约2mLNaOH溶液。
2、向盛有约2mLNaOH溶液的试管里加入几滴酚酞溶液,再用滴管向试管中慢慢滴入稀盐酸,至溶液恰好变色为止。
3、向盛有约2mLNa2CO3溶液的试管里滴入大约2mL稀盐酸 溶液。
完成实验报告,分析复分解型离子反应发生的条件?
科学探究
【实验2-3】
实验内容 实验现象 化学方程式 离子方程式
1、向盛有约2mLCuSO4溶液的试管里加入约2mLNaOH溶液。 生成蓝色沉淀 CuSO4+2NaOH= Cu(OH)2↓+Na2SO4 Cu2++2OH- =
Cu(OH)2↓
2、向盛有约2mLNaOH溶液的试管里加入几滴酚酞溶液,再用滴管向试管中慢慢滴入稀盐酸,至溶液恰好变色为止。 溶液先变红,随盐酸滴入,红色褪去 NaOH+HCl=NaCl +H2O
H++OH-= H2O
3、向盛有约2mLNa2CO3溶液的试管里滴入大约2mL稀盐酸 溶液。 气泡产生 Na2CO3+2HCl= 2NaCl+H2O+CO2↑ CO32-+2H+=
H2O+CO2↑
讨论总结复分解型离子反应的条件:
思考:以下方程可以反应,试分析反应可以进行的条件,已知其中的醋酸铅是易溶的弱电解质的盐。
2CH3COONa +Pb(NO3)2==Pb(CH3COO)2+ 2NaNO3
复分解型离子反应的条件:有气体、沉淀、弱电解质生成
有气体、沉淀、水生成
本课小结
1.离子反应:
2.离子方程式:
3.离子反应发生的条件
离子反应及其发生的条件
1).概念
2).书写步骤
3). 意义
谈一谈你对离子反应
“H+ + OH- = H2O”的认识?
课后思考
作业
P33 2、5、6、7、9、10
谢谢!
欢迎大家批评指正
