2013-2014学年九年级化学(科粤版)配套特训题库:第五章 燃料
文档属性
| 名称 | 2013-2014学年九年级化学(科粤版)配套特训题库:第五章 燃料 |

|
|
| 格式 | zip | ||
| 文件大小 | 103.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-09-03 00:00:00 | ||
图片预览




文档简介
5.1 氢气 碳
【培优训练题】
1.天文工作者已在宇宙中发现了H3分子。下列关于H3分子的说法正确的是 ( )
A.H2和H3物理性质完全相同 B.每个H3分子中含有一个H2分子和一个H原子
C.H2和H3化学性质完全相同 D.H2和H3是不同的物质
2.(黑龙江初赛)化学上把同种元素组成的不同单质互称为同素异形体,例如白磷和红磷,下列各组物质互为同素异形体的是 ( )
A.CO和CO2 B.金刚石和石墨 C.冰和干冰 D.液氧和氧气
3.(山西竞赛题)下表列出了一定温度和压强下每立方厘米活性炭所能吸附的常见气体的体积。分析表中数据与气体的组成、性质的关系,你认为下列结论正确的是 ( )
气体的性质 H2 CO2 O2 N2 Cl2
气体的沸点/℃ -252 -78 -183 -196 -34
被吸咐体积/mL 4.5 97 35 11 494
A.气体分子中所含原子个数多,气体易被吸附
B.沸点越高的气体,越不易被吸附
C.气体是化合物时,易被吸附
D.气体的相对分子质量越大,越易被吸附
【情景创新题】
4.《日本工业新闻》报道了一条用炸药和碳粉炸出金刚石的消息,引起了许多人的兴趣,认为这种方法很新鲜。用爆炸法生产金刚石是日本工业技术院化学研究所发明的。因为在炸药爆炸的瞬间,可以产生40万个大气压的超高压和5000 ℃的超高温。按以往用石墨在2000 ℃加2万个大气压就能“压”出金刚石的情况,爆炸时产生的超高压和超高温条件应该说完全可以“压”出金刚石。科研人员把装有炸药和碳粉的钢制敞口容器,沉入到一个直径8米、深约5米的混凝土制成的水槽内。这样在爆炸时,其中的碳粉就基本上处于缺氧的条件下(深水中当然也有少量的氧,但微不足道),不会使碳燃烧成二氧化碳或一氧化碳。操作员一按电钮,只听水槽内轰的一声闷响,爆炸就算完成了。然后,将容器里的水取出来静置,让炸出的金刚石自然沉淀。
请同学们结合上述材料回答下列有关问题。
(1)下列叙述不属于金刚石用途的是 ( )
A.用来裁玻璃 B.琢磨成璀璨夺目的钻石 C.润滑剂 D.用作钻探机钻头
(2)日本科研人员用来制金刚石的原料是 (选填“碳粉”或“石墨”),所发生的变化属于 (选填“物理”或“化学”)变化。
(3)我们知道单质碳在高温下极易与氧气反应生成CO2或CO,不可能制出金刚石,请根据上述资料说说科研人员是怎样克服这一问题的。 。
(4)中国科学技术大学化学家在440 ℃和高压下,利用金属钠与二氧化碳作用得到了金刚石和碳酸钠,且金刚石的颗粒有望达到宝石级大小,它将给天然金刚石开采业带来极大挑战。请写出这一反应的化学方程式 。
参考答案
1.D 【解析】H2和H3分子结构不同,是不同的物质,物理性质、化学性质不会完全相同;每个H3分子中含有3个H原子。
2.B 【解析】CO和CO2虽然组成元素相同,但它们不是单质;冰和干冰组成元素不同,且均是化合物,不是单质;液氧和氧气虽然是同种元素组成的单质,但它们是同一种物质,只是状态不同而已。
3.D 【解析】对比各种气体的分子,二氧化碳的分子中原子个数最多,是化合物,但不是最容易被吸附,故A、C错误;对比各种气体的沸点,氯气的沸点最高,但最容易被吸附,B错误;计算几种气体的相对分子质量,氯气的最大,二氧化碳的次之,最小的是氢气,而最容易被吸附的是氯气,次之的是二氧化碳,最不容易被吸附的是氢气,说明相对分子质量越大,越容易被吸附。
4.(1)C (2)碳粉 化学 (3)使碳粉在缺氧条件下合成金刚石
(4)4Na+3CO2 C+2Na2CO3
【解析】(1)金刚石最大的用途体现在它的硬度大,可用来裁玻璃和作钻探机钻头,又因其璀璨夺目,常温下性质稳定常用作装饰品钻石;(2)根据背景资料可知日本科研人员用来制金刚石的原料是碳粉,因碳粉和金刚石的结构(即碳原子排列方式)不同,它们属于两种不同的碳单质,因此用碳粉制造金刚石属于化学变化;(3)科研人员是在缺氧条件下将碳粉“炸”成金刚石的,因为没有氧气,碳粉无法变成CO或CO2;(4)该反应的反应物是钠和二氧化碳,生成物是金刚石(碳)和碳酸钠,并根据化学方程式书写步骤完成书写和配平。
二氧化碳的性质
【培优训练题】
1.(自贡中考题)有甲、乙、丙三种纯净物,甲为黑色固体,乙、丙为无色气体。点燃时,甲既能生成乙,也能生成丙;丙点燃也能生成乙。在以下关于这三种物质推断的叙述中,正确的是 ( )
A.甲是一种化合物 B.乙是一氧化碳
C.丙是一氧化碳 D.丙是二氧化碳
2.在相同的温度和压强下,相同体积的气体含有相同的分子数, 反之亦然。取同温同压下的相同体积的CO和O2混合,在一定条件下充分反应,恢复到初始温度和压强,下列说法正确的是 ( )
A.参加反应的CO和 O2的体积比为2︰1
B.生成CO2的分子个数为原来分子总数的三分之二
C.反应后气体的体积为原来的三分之二
D.反应后气体中C、O原子的个数比为1︰2
【情景创新题】
3.2011年 3月26日晚8时30分至9时30分,“地球一小时”如约而至,全国数十个城市、数亿人参与其中,力诺瑞特也第三次参与全球互联,与全球4000多座城市共享“熄灯一小时”的美丽黑暗。3月26日晚上20点30分,凯德中国旗下的凯德置地、凯德商用、雅诗阁中国和凯德惠居(中国)分布在全国37个城市的80家物业将同时熄灯10小时。凯德中国一直致力于绿色环保事业,2011年更是加大了参与力度,旗下参与物业数量比去年增加33%,从去年的60个物业扩展到80个物业以表达公司始终坚持“为了明天,共筑绿色”的环保理念和决心。
请根据材料回答下列问题:
(1)近年来大气中二氧化碳含量不断上升的主要原因是 ,自然界中消耗二氧化碳的主要途径是 。
(2)下列做法不符合减少二氧化碳排放的是 (填序号)。
①改造或淘汰高能耗、高污染产业 ②大力发展火力发电 ③研制和开发新能源替代传统能源 ④优化建筑设计,增强室内自然采光,减少照明用电
(3)世界自然基金会发起“地球一小时”活动,号召晚上熄灯一小时。3月26日晚上20点30分,凯德中国旗下的凯德置地、凯德商用、雅诗阁中国和凯德惠居(中国)分布在全国37个城市的80家物业将同时熄灯10小时。 彰显新世界中国地产对减碳和环保的决心及承担。下列说法与提倡这个活动的主要目的相符合的是 。
①节约能源 ②减少温室气体排放 ③欣赏城市夜景 ④关注全球气候
(4)地球温度持续升高,假若你是地球,你最担忧的是 。
(5)请你说出从自身做起减少“温室效应”的一种做法 。
参考答案
1.C 【解析】黑色固体若为单质碳,则乙、丙物质为一氧化碳或二氧化碳,又因为丙点燃也能生成乙,则丙为一氧化碳气体、乙为二氧化碳气体。
2.A 【解析】根据发生的反应2CO+O22CO2,参加反应的CO和 O2的分子个数比为2︰1,则参加反应的CO和 O2的体积比为2︰1;若最初两种气体都有2体积,则生成2体积二氧化碳,生成二氧化碳的分子个数为原来分子总数的二分之一;反应后剩余1体积氧气,生成2体积二氧化碳,反应后总体积为原来总体积的四分之三;根据质量守恒定律,反应后与反应前气体中C、O原子个数比相同,都为1︰3。
3.(1)含碳矿物燃料的燃烧 植物的光合作用(或海水的吸收) (2)② (3)①②④
(4)冰川融化陆地大量被淹没,土地沙漠化,植物无法生长,人类无法生存(符合题意即可)
(5)植树造林、种花种草(或不使用一次性木筷,减少使用面巾纸等合理答案)
5.3 二氧化碳的制取
【培优训练题】
1.(山西竞赛题)实验室不能用块状大理石与稀硫酸制取二氧化碳气体,而能用大理石粉末与稀硫酸制取二氧化碳气体。由此得出的合理结论是 ( )
A.块状大理石与稀硫酸不反应
B.反应物之间接触面积越大,越有利于反应的进行
C.块状大理石与大理石粉末的化学性质不同
D.块状大理石与大理石粉末的组成、结构不同
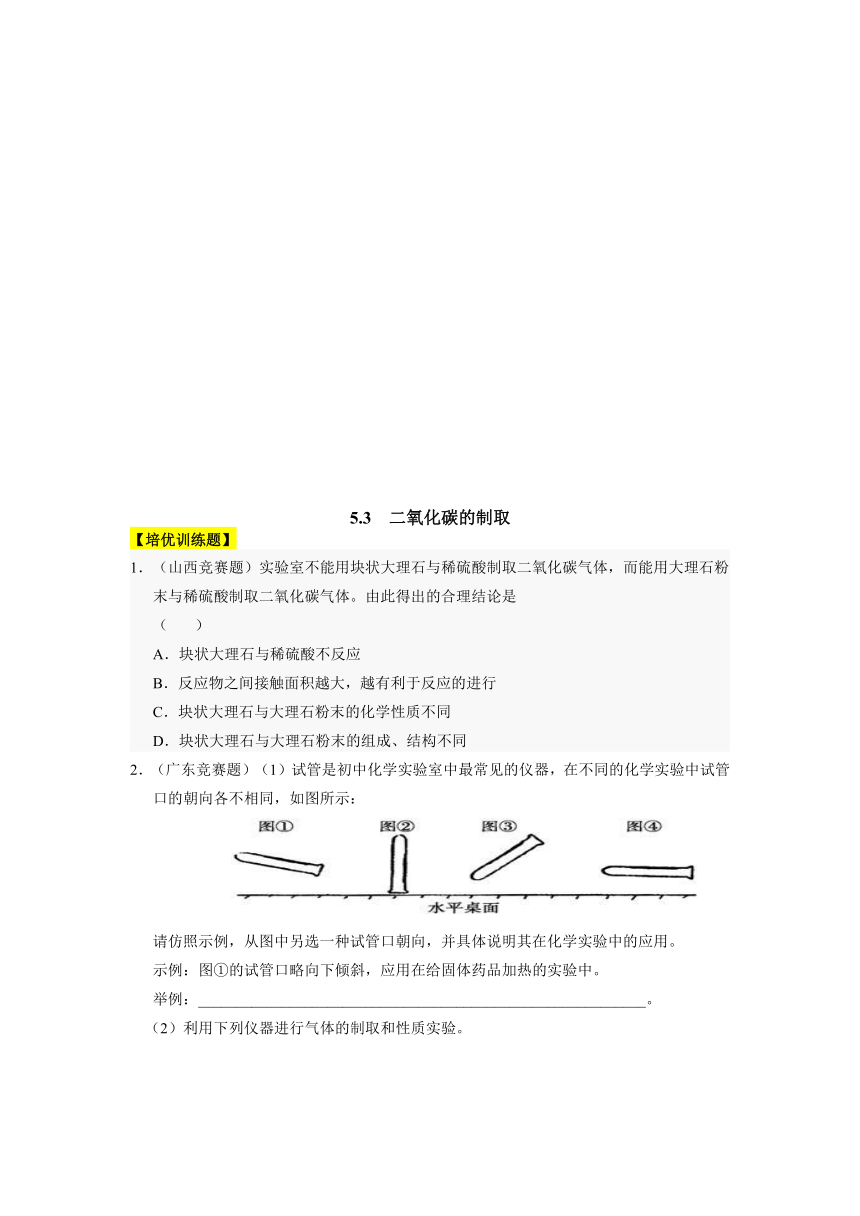
2.(广东竞赛题)(1)试管是初中化学实验室中最常见的仪器,在不同的化学实验中试管口的朝向各不相同,如图所示:
请仿照示例,从图中另选一种试管口朝向,并具体说明其在化学实验中的应用。
示例:图①的试管口略向下倾斜,应用在给固体药品加热的实验中。
举例:___________________________________________________________。
(2)利用下列仪器进行气体的制取和性质实验。
请完成下列问题:
①写出下列仪器名称:G___________ ,H___________。
②实验室用高锰酸钾制取并收集氧气,应选择的仪器是______________(填序号,下同)。
③实验室要制取较多量的二氧化碳,装配气体发生装置时,应选择的仪器是________。
④检验二氧化碳气体收集满的方法是__________________________________________。
⑤实验室制取二氧化碳气体反应的化学方程式是________________________________。
3.某钙片的标签如右图所示,此钙片成分中只有碳酸钙含有钙元素。
(1)请通过计算说明此标签中的含钙量是否错误。
(2)为测定这种钙片含钙量,小东每次取10片钙片放入已称量的盛有 足量盐酸的烧杯中,充分反应后再称量烧杯和剩余物的总质量。小东做了三次实验,数据如下:
①请计算每片此钙片含碳酸钙的质量。
②你认为应该建议厂家如何更改标签
【情景创新题】
4.埃及艳后的王冠上镶有一颗珍珠是当时世界上最大的珍珠,名叫“埃及的眼泪”。 公元前44年其部下安东尼举兵进攻埃及,克娄巴特拉七世无法抵抗安东尼的进攻,准备投降并以“埃及的眼泪”讨好安东尼。在欢迎安东尼的宴会开始前,一个侍女报告说,王妹的女佣偷去了“埃及的眼泪”并把它吞到肚里去了。女王想杀了女佣取出珍珠,但又怕被玷污的东西送人反而是一种亵渎。犹豫之时,王妹突然建议说:“让她喝醋,醋喝多了她就会泻个不停,一定会把珍珠泻下来。”于是女王令人一个劲地给女佣灌醋,女佣果真泻个不停,但始终没有见珍珠下来。
请根据题给材料完成下列探究:
【猜想与假设】你认为“珍珠”主要成分可能是 ,理由是 。
【实验设计】若证明你的猜想正确,设计实验如下:取一个小玻璃杯,放入少量珍珠粉末,然后加入一些醋精(主要成分是醋酸CH3COOH),立即用蘸有澄清石灰水的玻璃片盖住。
【实验现象】你观察到现象是 。
【实验结论】根据实验现象推出你的猜想正确。已知CaCO3+2HCl====CaCl2+H2O
+CO2↑,请你写出碳酸钙与醋酸反应的化学方程式 。
【反思与应用】医疗上,可以用珍珠粉治疗胃酸(主要成分是盐酸)过多症,原理是
。
参考答案
1.B 【解析】大理石的主要成分碳酸钙与稀硫酸反应,生成微溶于水的硫酸钙,随着反应的进行硫酸钙会附着在大理石的表面,使碳酸钙与硫酸隔绝,反应停止,而用大理石粉末即可避免此现象的发生;块状大理石与大理石粉末只是形状不同,组成、结构、化学性质都相同。
2.(1)图③试管口向上倾斜,应用在加热液体的实验中(图②试管口朝下,可以用来收集密度比空气密度小的气体。合理答案均可)
(2)①集气瓶 长颈漏斗 ②A B C E G J ③D G H
④将燃着的木条放在集气瓶口,发现木条熄灭,说明二氧化碳已收集满了
⑤CaCO3+2HCl===CaCl2+CO2↑+H2O
【解析】图②试管口朝下,可以用来收集密度比空气密度小的气体;图③试管口向上倾斜可
做加热液体的实验;图④试管平放,可用来向试管中添加固体药品等,答案合理即可;实验室用高锰酸钾制取并收集氧气,对固体加热制取气体,发生装置要选择试管、铁架台、酒精灯,收集装置选择玻璃弯管、集气瓶、水槽(排水法收集);制取较多量的二氧化碳,发生装置选择容积较大的反应容器集气瓶、双孔橡皮塞、长颈漏斗;因为二氧化碳只能用排空气法收集,验满时用燃着的木条放在集气瓶的瓶口,木条熄灭就证明收集满了。
3.(1)本品若为纯碳酸钙, 每片含钙量为:×40%=0.32 g
因此本品每片不可能含钙0.75 g。
(2)10片钙片反应生成二氧化碳的质量为22 g+8 g-26.7 g=3.3 g
①设10片钙片含碳酸钙的质量为 x。
CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
100 44
x 3.3 g
= x = 7.5 g
因此每片此钙片含碳酸钙 0.75 g 。
②每片此钙片的含钙量 = 0.75 g×40% = 0.3 g ,建议厂家将含钙量:“每片含钙0.75 g”改为“每片含
钙0.3 g”
4.【猜想与假设】碳酸钙 碳酸钙能与酸反应导致珍珠溶解了
【实验现象】珍珠粉逐渐减少,且表面冒出气泡;澄清石灰水变浑浊
【实验结论】CaCO3+2CH3COOH===Ca(CH3COO)2+ H2O+CO2↑
【反思与应用】珍珠中含有大量的碳酸钙,能与胃液中的盐酸反应,减少胃液中的盐酸含量,缓解病症
5.4 古生物的“遗产”——化石燃料
【培优训练题】
1.(河北竞赛题)防止全球变暖,请低碳生活吧!下列建议不利于该主题的是 ( )
A.及时关闭电脑 B.常骑自行车,少开私家车
C.自备购物袋 D.多用柴草作燃料
2.(全国竞赛题)关于天然气的下列叙述中不正确的是 ( )
A.天然气和沼气的主要成分都是甲烷
B.液化石油气灶具改为天然气作燃料,燃烧时应减小进空气量或增大进天然气量
C.天然气与空气混合点燃,不会发生爆炸
D.与煤炭相比,天然气燃烧产生的废气中,SO2等污染物较少
3.氯气(Cl2)和氧气(O2)都是活泼的非金属单质,在一定条件下它们都能跟甲烷(CH4)反应。已知O2和CH4充分反应后的生成物是CO2和H2O,由此推断Cl2和CH4充分反应后的生成物是 ( )
(温馨提示:氯气(Cl2)和氧气(O2)具有相似的化学性质)
A.CCl4和HCl B.CCl4和H2 C.CH2Cl2和H2 D.C和HCl
4.(山东竞赛题) 据报道,科学家在深海发现了一种外表象冰的固态物质,这种物质的成分是甲烷水合物(CH4·xH2O),称为可燃冰。通常状况下,这种物质不稳定、易分解、易燃,在低温或高压下呈固态。其储量超过煤和石油的总储量,是很有前途的待开发能源。
(1)请你分析可燃冰作为能源有什么优点? 。
(2)科学家对在我国南海海域发现的可燃冰的组分进行研究后,测得其含碳的质量分数 为7.5%,则x的值为 。
【情景创新题】
5.据《南方日报》报道,广东清远阳山在社会主义新农村建设中大手笔投
入建设沼气池,近5年来共投入1406.9万元建设沼气池4644个,年产沼气
567万立方米,为1.26万农户每年节省燃料费开支1386万元、肥料成本
126万元。
阳山县委、县政府把加快推进农村沼气建设作为优化农村能源结构、保护生态 环境、转变农业发展方式、改善农民生活生产条件、推进社会主义新农村建设的重要举措来抓。该县因地制宜推广以沼气建设为纽带的“猪、沼、菜(鱼、果、稻)”等生态家园模式,发展循环经济,提高沼气建设的综合效益,初步形成了“家庭养殖—沼气—菜(稻、果、鱼)”“规模养殖—沼气—蓄水池—山地果园开发”“规模养殖—沼气—保温(照明)—果(鱼、菜、稻)”综合利用三大模式。
根据以上信息和我们掌握的知识回答下列问题:
(1)“猪、沼、菜(鱼、果、稻)” 是综合利用猪的粪便发酵的产物,猪粪便发酵产生沼气的过程属于 ______________(选填“物理”或“化学”)变化。
(2)阳山县使用沼气对建设社会主义新农村有非常积极的意义,燃烧沼气用于煮饭、照明是将化学能分别转化为 能和 能;沼气的的主要成分是甲烷,其在氧气中完全燃烧的化学方程式为 。
(3)下列叙述正确的是 (填序号)。
A.用灯火是试验检验人是否可入沼气池中清洗沼气池
B.沼气是一种可再生能源
C.沼气泄漏,遇明火可能会发生爆炸
D.沼渣属于化学肥料
(4)写出“猪—-沼—菜(鱼、果、稻)”发展模式的一点积极意义 。
参考答案
1.D 【解析】柴草燃料生成二氧化碳,多用柴草作燃料加大二氧化碳的排放量,不属于低碳生活。
2.C【解析】天然气是可燃性气体,可燃性气体与空气混合达到爆炸极限,遇到明火极易发生爆炸。
3.A 【解析】甲烷和氧气反应是甲烷中的两种元素均结合氧,则类似的甲烷和氯气反应是甲烷中的两种元素均结合氯。
4. (1)储量大、对环境友好、低温下为固态好运输,用时易液化 (2) 8
5.(1)化学 (2)热 光(或电) CH4 + 2O2 CO2 + 2H2O (3)BC
(4)保护农村环境(节约资源或保护生态环境或转变农业发展方式或改善农民生活生产条件等合理答案)
【解析】沼气的主要成分是甲烷,它具有可燃性,与空气混合遇到明火容易发生爆炸;沼渣属于农家
肥料。
第五章综合练习
【培优训练题】
1.(河南初赛)下列说法正确的是 ( )
A.用煤炉取暖时,在炉子上放一盆水可以防止一氧化碳中毒
B.干冰灭火器灭火只是利用了二氧化碳的化学性质
C.H2CO3、CO、CH4、C四种物质中,碳元素的化合是从由高到低的顺序排列的
D.相同质量的Na2CO3、CaCO3分别与足量盐酸反应,CaCO3产生的CO2质量多
2.已知在相同温度和压强下,含相同分子数的任何气体所占的体积相同,现有一套以天然气(主要是CH4)为燃料的灶具欲改烧液化石油气(C3H8),要使C3H8 完全燃烧,应采用的措施正确的是 ( )
A.减少空气的进气量,增大液化石油气的进气量
B.增大空气的进气量,也增大液化石油气的进气量
C.增大空气的进气量,或减少液化石油气的进气量
D.同时减少空气和液化石油气的进气量
3.(全国复赛)一定量的木炭在盛有氮气和氧气混合气体的密闭容器中燃烧后生成CO和CO2,且测得反应后所得CO、CO2、N2的混合气体中碳元素的质量分数为24%,则其中氮气的质量分数可能为
( )
A.10% B.30% C.50% D.70%
4.(广东竞赛题)A、B、C、D都是初中化学中的常见物质,具有如右下图所示的转化关系(反应条件,其他反应物及多余产物均已略去)。
(1)若A是一种白色难溶于水的钙盐,
由三种元素组成,C是一种参与植物
光合作用的气体。则 A、B、C、D
四种物质分别是:A ;B ;C ;D 。
(2)若A是人类赖以生存的一种无色液体,D是一种黑色固体。则 A、B、C、D四种物质分别是:A ;B ;C ;D 。
5.(宁波竞赛题)结合图示实验装置,回答下列问题。
(1)图中a、b仪器的名称:a ,b 。
(2)用高锰酸钾固体制氧气,选用的发生装置是__________(选填“A” “B”或“C”),装入药品前应先 ,反应的化学方程式是 。
(3)用块状固体和液体不加热制取气体时,改用C装置(多孔隔板用来放块状固体)代替B装置的优点是 (答出一点即可)。
(4)右图是某微型实验的装置图。试管中反
应发生后a处的变化是 ,
b处的变化是 ,烧杯中的
现象是 。
微型实验装置的优点是(请答两点):
① __;
② 。
参考答案
1.D 【解析】选项A中CO难溶于水;选项B中二氧化碳灭火既利用了其化学性质(不燃烧,也不支持燃烧),又利用了其物理性质(密度比空气大);选项C中CH4中碳元素的化合价为-4,而单质C中碳元素化合价为0。
2.C 【解析】根据CH4和C3H8的化学式可知,燃烧都生成二氧化碳和水,所以分别燃烧1体积的CH4和C3H8,后者比前者消耗更多的氧气(CH4——2O2,C3H8——5O2),所以燃烧天然气的灶具改为烧液化石油气,可以增大空气的进气量,也可以减少液化石油气的进气量。
3.B 【解析】假设混合气体是CO2和N2,则说明24%的碳元素均来自CO2,求得混合气体中二氧化碳的质量分数为:24% ÷ ×100%=88%,推知氮气的质量分数为12%;假设混合气体是CO和N2,则说明24%的碳元素均来自CO,求得混合气体中一氧化碳的质量分数为:24% ÷ ×100%=56%,推知氮气的质量分数为44%。因混合气体是CO、CO2、N2三种物质组成的,故混合气体中氮气质量分数应该在12% ~ 44%之间。
4.(1)CaCO3 CaO CO2 Ca(OH)2 (2)H2O O2 H2 CuO(合理答案均可)
【解析】(1)C是一种参与植物光合作用的气体,C一定是二氧化碳;A是一种白色难溶于水的钙盐,由三种元素组成,分解生成二氧化碳,A一定是碳酸钙,则B为氧化钙;(2)若A是人类赖以生存的一种无色液体,A是水,水分解生成B、C,B、C应是氢气和氧气,B与其他物质反应能生成黑色固体,C与黑色固体反应又生成水,B应是氧气,D是一种金属氧化物,如氧化铜或四氧化三铁等,C是氢气。
5.(1)酒精灯 长颈漏斗 (2)A 检查装置气密性
2KMnO4 K2MnO4+MnO2+O2↑
(3)可以随时使反应停止或开始(或方便控制反应的发生与停止)
(4)由紫色变红色 澄清石灰水变浑浊 低处的蜡烛先熄灭
节约药品、产生的污染物少(或废弃物少,合理即可)
【解析】高锰酸钾固体制氧气选择对固体加热的装置A,制取气体的装置加药品前都要检查装置的气密性;C装置中加入多孔的隔板,固体药品放在隔板上,液体从长颈漏斗加入与隔板上的固体药品接触反应发生,不需要生成气体时关闭阀门,反应进行生成的气体排不出,容器内压强增大,液体药品压回长颈漏斗,固液分离反应停止,打开阀门气体排出压强减小,液体流回试管中,反应继续发生,所以此装置可以控制反应的发生;微型实验最大的优点节省药品,减少有害物质的排放。
【培优训练题】
1.天文工作者已在宇宙中发现了H3分子。下列关于H3分子的说法正确的是 ( )
A.H2和H3物理性质完全相同 B.每个H3分子中含有一个H2分子和一个H原子
C.H2和H3化学性质完全相同 D.H2和H3是不同的物质
2.(黑龙江初赛)化学上把同种元素组成的不同单质互称为同素异形体,例如白磷和红磷,下列各组物质互为同素异形体的是 ( )
A.CO和CO2 B.金刚石和石墨 C.冰和干冰 D.液氧和氧气
3.(山西竞赛题)下表列出了一定温度和压强下每立方厘米活性炭所能吸附的常见气体的体积。分析表中数据与气体的组成、性质的关系,你认为下列结论正确的是 ( )
气体的性质 H2 CO2 O2 N2 Cl2
气体的沸点/℃ -252 -78 -183 -196 -34
被吸咐体积/mL 4.5 97 35 11 494
A.气体分子中所含原子个数多,气体易被吸附
B.沸点越高的气体,越不易被吸附
C.气体是化合物时,易被吸附
D.气体的相对分子质量越大,越易被吸附
【情景创新题】
4.《日本工业新闻》报道了一条用炸药和碳粉炸出金刚石的消息,引起了许多人的兴趣,认为这种方法很新鲜。用爆炸法生产金刚石是日本工业技术院化学研究所发明的。因为在炸药爆炸的瞬间,可以产生40万个大气压的超高压和5000 ℃的超高温。按以往用石墨在2000 ℃加2万个大气压就能“压”出金刚石的情况,爆炸时产生的超高压和超高温条件应该说完全可以“压”出金刚石。科研人员把装有炸药和碳粉的钢制敞口容器,沉入到一个直径8米、深约5米的混凝土制成的水槽内。这样在爆炸时,其中的碳粉就基本上处于缺氧的条件下(深水中当然也有少量的氧,但微不足道),不会使碳燃烧成二氧化碳或一氧化碳。操作员一按电钮,只听水槽内轰的一声闷响,爆炸就算完成了。然后,将容器里的水取出来静置,让炸出的金刚石自然沉淀。
请同学们结合上述材料回答下列有关问题。
(1)下列叙述不属于金刚石用途的是 ( )
A.用来裁玻璃 B.琢磨成璀璨夺目的钻石 C.润滑剂 D.用作钻探机钻头
(2)日本科研人员用来制金刚石的原料是 (选填“碳粉”或“石墨”),所发生的变化属于 (选填“物理”或“化学”)变化。
(3)我们知道单质碳在高温下极易与氧气反应生成CO2或CO,不可能制出金刚石,请根据上述资料说说科研人员是怎样克服这一问题的。 。
(4)中国科学技术大学化学家在440 ℃和高压下,利用金属钠与二氧化碳作用得到了金刚石和碳酸钠,且金刚石的颗粒有望达到宝石级大小,它将给天然金刚石开采业带来极大挑战。请写出这一反应的化学方程式 。
参考答案
1.D 【解析】H2和H3分子结构不同,是不同的物质,物理性质、化学性质不会完全相同;每个H3分子中含有3个H原子。
2.B 【解析】CO和CO2虽然组成元素相同,但它们不是单质;冰和干冰组成元素不同,且均是化合物,不是单质;液氧和氧气虽然是同种元素组成的单质,但它们是同一种物质,只是状态不同而已。
3.D 【解析】对比各种气体的分子,二氧化碳的分子中原子个数最多,是化合物,但不是最容易被吸附,故A、C错误;对比各种气体的沸点,氯气的沸点最高,但最容易被吸附,B错误;计算几种气体的相对分子质量,氯气的最大,二氧化碳的次之,最小的是氢气,而最容易被吸附的是氯气,次之的是二氧化碳,最不容易被吸附的是氢气,说明相对分子质量越大,越容易被吸附。
4.(1)C (2)碳粉 化学 (3)使碳粉在缺氧条件下合成金刚石
(4)4Na+3CO2 C+2Na2CO3
【解析】(1)金刚石最大的用途体现在它的硬度大,可用来裁玻璃和作钻探机钻头,又因其璀璨夺目,常温下性质稳定常用作装饰品钻石;(2)根据背景资料可知日本科研人员用来制金刚石的原料是碳粉,因碳粉和金刚石的结构(即碳原子排列方式)不同,它们属于两种不同的碳单质,因此用碳粉制造金刚石属于化学变化;(3)科研人员是在缺氧条件下将碳粉“炸”成金刚石的,因为没有氧气,碳粉无法变成CO或CO2;(4)该反应的反应物是钠和二氧化碳,生成物是金刚石(碳)和碳酸钠,并根据化学方程式书写步骤完成书写和配平。
二氧化碳的性质
【培优训练题】
1.(自贡中考题)有甲、乙、丙三种纯净物,甲为黑色固体,乙、丙为无色气体。点燃时,甲既能生成乙,也能生成丙;丙点燃也能生成乙。在以下关于这三种物质推断的叙述中,正确的是 ( )
A.甲是一种化合物 B.乙是一氧化碳
C.丙是一氧化碳 D.丙是二氧化碳
2.在相同的温度和压强下,相同体积的气体含有相同的分子数, 反之亦然。取同温同压下的相同体积的CO和O2混合,在一定条件下充分反应,恢复到初始温度和压强,下列说法正确的是 ( )
A.参加反应的CO和 O2的体积比为2︰1
B.生成CO2的分子个数为原来分子总数的三分之二
C.反应后气体的体积为原来的三分之二
D.反应后气体中C、O原子的个数比为1︰2
【情景创新题】
3.2011年 3月26日晚8时30分至9时30分,“地球一小时”如约而至,全国数十个城市、数亿人参与其中,力诺瑞特也第三次参与全球互联,与全球4000多座城市共享“熄灯一小时”的美丽黑暗。3月26日晚上20点30分,凯德中国旗下的凯德置地、凯德商用、雅诗阁中国和凯德惠居(中国)分布在全国37个城市的80家物业将同时熄灯10小时。凯德中国一直致力于绿色环保事业,2011年更是加大了参与力度,旗下参与物业数量比去年增加33%,从去年的60个物业扩展到80个物业以表达公司始终坚持“为了明天,共筑绿色”的环保理念和决心。
请根据材料回答下列问题:
(1)近年来大气中二氧化碳含量不断上升的主要原因是 ,自然界中消耗二氧化碳的主要途径是 。
(2)下列做法不符合减少二氧化碳排放的是 (填序号)。
①改造或淘汰高能耗、高污染产业 ②大力发展火力发电 ③研制和开发新能源替代传统能源 ④优化建筑设计,增强室内自然采光,减少照明用电
(3)世界自然基金会发起“地球一小时”活动,号召晚上熄灯一小时。3月26日晚上20点30分,凯德中国旗下的凯德置地、凯德商用、雅诗阁中国和凯德惠居(中国)分布在全国37个城市的80家物业将同时熄灯10小时。 彰显新世界中国地产对减碳和环保的决心及承担。下列说法与提倡这个活动的主要目的相符合的是 。
①节约能源 ②减少温室气体排放 ③欣赏城市夜景 ④关注全球气候
(4)地球温度持续升高,假若你是地球,你最担忧的是 。
(5)请你说出从自身做起减少“温室效应”的一种做法 。
参考答案
1.C 【解析】黑色固体若为单质碳,则乙、丙物质为一氧化碳或二氧化碳,又因为丙点燃也能生成乙,则丙为一氧化碳气体、乙为二氧化碳气体。
2.A 【解析】根据发生的反应2CO+O22CO2,参加反应的CO和 O2的分子个数比为2︰1,则参加反应的CO和 O2的体积比为2︰1;若最初两种气体都有2体积,则生成2体积二氧化碳,生成二氧化碳的分子个数为原来分子总数的二分之一;反应后剩余1体积氧气,生成2体积二氧化碳,反应后总体积为原来总体积的四分之三;根据质量守恒定律,反应后与反应前气体中C、O原子个数比相同,都为1︰3。
3.(1)含碳矿物燃料的燃烧 植物的光合作用(或海水的吸收) (2)② (3)①②④
(4)冰川融化陆地大量被淹没,土地沙漠化,植物无法生长,人类无法生存(符合题意即可)
(5)植树造林、种花种草(或不使用一次性木筷,减少使用面巾纸等合理答案)
5.3 二氧化碳的制取
【培优训练题】
1.(山西竞赛题)实验室不能用块状大理石与稀硫酸制取二氧化碳气体,而能用大理石粉末与稀硫酸制取二氧化碳气体。由此得出的合理结论是 ( )
A.块状大理石与稀硫酸不反应
B.反应物之间接触面积越大,越有利于反应的进行
C.块状大理石与大理石粉末的化学性质不同
D.块状大理石与大理石粉末的组成、结构不同
2.(广东竞赛题)(1)试管是初中化学实验室中最常见的仪器,在不同的化学实验中试管口的朝向各不相同,如图所示:
请仿照示例,从图中另选一种试管口朝向,并具体说明其在化学实验中的应用。
示例:图①的试管口略向下倾斜,应用在给固体药品加热的实验中。
举例:___________________________________________________________。
(2)利用下列仪器进行气体的制取和性质实验。
请完成下列问题:
①写出下列仪器名称:G___________ ,H___________。
②实验室用高锰酸钾制取并收集氧气,应选择的仪器是______________(填序号,下同)。
③实验室要制取较多量的二氧化碳,装配气体发生装置时,应选择的仪器是________。
④检验二氧化碳气体收集满的方法是__________________________________________。
⑤实验室制取二氧化碳气体反应的化学方程式是________________________________。
3.某钙片的标签如右图所示,此钙片成分中只有碳酸钙含有钙元素。
(1)请通过计算说明此标签中的含钙量是否错误。
(2)为测定这种钙片含钙量,小东每次取10片钙片放入已称量的盛有 足量盐酸的烧杯中,充分反应后再称量烧杯和剩余物的总质量。小东做了三次实验,数据如下:
①请计算每片此钙片含碳酸钙的质量。
②你认为应该建议厂家如何更改标签
【情景创新题】
4.埃及艳后的王冠上镶有一颗珍珠是当时世界上最大的珍珠,名叫“埃及的眼泪”。 公元前44年其部下安东尼举兵进攻埃及,克娄巴特拉七世无法抵抗安东尼的进攻,准备投降并以“埃及的眼泪”讨好安东尼。在欢迎安东尼的宴会开始前,一个侍女报告说,王妹的女佣偷去了“埃及的眼泪”并把它吞到肚里去了。女王想杀了女佣取出珍珠,但又怕被玷污的东西送人反而是一种亵渎。犹豫之时,王妹突然建议说:“让她喝醋,醋喝多了她就会泻个不停,一定会把珍珠泻下来。”于是女王令人一个劲地给女佣灌醋,女佣果真泻个不停,但始终没有见珍珠下来。
请根据题给材料完成下列探究:
【猜想与假设】你认为“珍珠”主要成分可能是 ,理由是 。
【实验设计】若证明你的猜想正确,设计实验如下:取一个小玻璃杯,放入少量珍珠粉末,然后加入一些醋精(主要成分是醋酸CH3COOH),立即用蘸有澄清石灰水的玻璃片盖住。
【实验现象】你观察到现象是 。
【实验结论】根据实验现象推出你的猜想正确。已知CaCO3+2HCl====CaCl2+H2O
+CO2↑,请你写出碳酸钙与醋酸反应的化学方程式 。
【反思与应用】医疗上,可以用珍珠粉治疗胃酸(主要成分是盐酸)过多症,原理是
。
参考答案
1.B 【解析】大理石的主要成分碳酸钙与稀硫酸反应,生成微溶于水的硫酸钙,随着反应的进行硫酸钙会附着在大理石的表面,使碳酸钙与硫酸隔绝,反应停止,而用大理石粉末即可避免此现象的发生;块状大理石与大理石粉末只是形状不同,组成、结构、化学性质都相同。
2.(1)图③试管口向上倾斜,应用在加热液体的实验中(图②试管口朝下,可以用来收集密度比空气密度小的气体。合理答案均可)
(2)①集气瓶 长颈漏斗 ②A B C E G J ③D G H
④将燃着的木条放在集气瓶口,发现木条熄灭,说明二氧化碳已收集满了
⑤CaCO3+2HCl===CaCl2+CO2↑+H2O
【解析】图②试管口朝下,可以用来收集密度比空气密度小的气体;图③试管口向上倾斜可
做加热液体的实验;图④试管平放,可用来向试管中添加固体药品等,答案合理即可;实验室用高锰酸钾制取并收集氧气,对固体加热制取气体,发生装置要选择试管、铁架台、酒精灯,收集装置选择玻璃弯管、集气瓶、水槽(排水法收集);制取较多量的二氧化碳,发生装置选择容积较大的反应容器集气瓶、双孔橡皮塞、长颈漏斗;因为二氧化碳只能用排空气法收集,验满时用燃着的木条放在集气瓶的瓶口,木条熄灭就证明收集满了。
3.(1)本品若为纯碳酸钙, 每片含钙量为:×40%=0.32 g
因此本品每片不可能含钙0.75 g。
(2)10片钙片反应生成二氧化碳的质量为22 g+8 g-26.7 g=3.3 g
①设10片钙片含碳酸钙的质量为 x。
CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
100 44
x 3.3 g
= x = 7.5 g
因此每片此钙片含碳酸钙 0.75 g 。
②每片此钙片的含钙量 = 0.75 g×40% = 0.3 g ,建议厂家将含钙量:“每片含钙0.75 g”改为“每片含
钙0.3 g”
4.【猜想与假设】碳酸钙 碳酸钙能与酸反应导致珍珠溶解了
【实验现象】珍珠粉逐渐减少,且表面冒出气泡;澄清石灰水变浑浊
【实验结论】CaCO3+2CH3COOH===Ca(CH3COO)2+ H2O+CO2↑
【反思与应用】珍珠中含有大量的碳酸钙,能与胃液中的盐酸反应,减少胃液中的盐酸含量,缓解病症
5.4 古生物的“遗产”——化石燃料
【培优训练题】
1.(河北竞赛题)防止全球变暖,请低碳生活吧!下列建议不利于该主题的是 ( )
A.及时关闭电脑 B.常骑自行车,少开私家车
C.自备购物袋 D.多用柴草作燃料
2.(全国竞赛题)关于天然气的下列叙述中不正确的是 ( )
A.天然气和沼气的主要成分都是甲烷
B.液化石油气灶具改为天然气作燃料,燃烧时应减小进空气量或增大进天然气量
C.天然气与空气混合点燃,不会发生爆炸
D.与煤炭相比,天然气燃烧产生的废气中,SO2等污染物较少
3.氯气(Cl2)和氧气(O2)都是活泼的非金属单质,在一定条件下它们都能跟甲烷(CH4)反应。已知O2和CH4充分反应后的生成物是CO2和H2O,由此推断Cl2和CH4充分反应后的生成物是 ( )
(温馨提示:氯气(Cl2)和氧气(O2)具有相似的化学性质)
A.CCl4和HCl B.CCl4和H2 C.CH2Cl2和H2 D.C和HCl
4.(山东竞赛题) 据报道,科学家在深海发现了一种外表象冰的固态物质,这种物质的成分是甲烷水合物(CH4·xH2O),称为可燃冰。通常状况下,这种物质不稳定、易分解、易燃,在低温或高压下呈固态。其储量超过煤和石油的总储量,是很有前途的待开发能源。
(1)请你分析可燃冰作为能源有什么优点? 。
(2)科学家对在我国南海海域发现的可燃冰的组分进行研究后,测得其含碳的质量分数 为7.5%,则x的值为 。
【情景创新题】
5.据《南方日报》报道,广东清远阳山在社会主义新农村建设中大手笔投
入建设沼气池,近5年来共投入1406.9万元建设沼气池4644个,年产沼气
567万立方米,为1.26万农户每年节省燃料费开支1386万元、肥料成本
126万元。
阳山县委、县政府把加快推进农村沼气建设作为优化农村能源结构、保护生态 环境、转变农业发展方式、改善农民生活生产条件、推进社会主义新农村建设的重要举措来抓。该县因地制宜推广以沼气建设为纽带的“猪、沼、菜(鱼、果、稻)”等生态家园模式,发展循环经济,提高沼气建设的综合效益,初步形成了“家庭养殖—沼气—菜(稻、果、鱼)”“规模养殖—沼气—蓄水池—山地果园开发”“规模养殖—沼气—保温(照明)—果(鱼、菜、稻)”综合利用三大模式。
根据以上信息和我们掌握的知识回答下列问题:
(1)“猪、沼、菜(鱼、果、稻)” 是综合利用猪的粪便发酵的产物,猪粪便发酵产生沼气的过程属于 ______________(选填“物理”或“化学”)变化。
(2)阳山县使用沼气对建设社会主义新农村有非常积极的意义,燃烧沼气用于煮饭、照明是将化学能分别转化为 能和 能;沼气的的主要成分是甲烷,其在氧气中完全燃烧的化学方程式为 。
(3)下列叙述正确的是 (填序号)。
A.用灯火是试验检验人是否可入沼气池中清洗沼气池
B.沼气是一种可再生能源
C.沼气泄漏,遇明火可能会发生爆炸
D.沼渣属于化学肥料
(4)写出“猪—-沼—菜(鱼、果、稻)”发展模式的一点积极意义 。
参考答案
1.D 【解析】柴草燃料生成二氧化碳,多用柴草作燃料加大二氧化碳的排放量,不属于低碳生活。
2.C【解析】天然气是可燃性气体,可燃性气体与空气混合达到爆炸极限,遇到明火极易发生爆炸。
3.A 【解析】甲烷和氧气反应是甲烷中的两种元素均结合氧,则类似的甲烷和氯气反应是甲烷中的两种元素均结合氯。
4. (1)储量大、对环境友好、低温下为固态好运输,用时易液化 (2) 8
5.(1)化学 (2)热 光(或电) CH4 + 2O2 CO2 + 2H2O (3)BC
(4)保护农村环境(节约资源或保护生态环境或转变农业发展方式或改善农民生活生产条件等合理答案)
【解析】沼气的主要成分是甲烷,它具有可燃性,与空气混合遇到明火容易发生爆炸;沼渣属于农家
肥料。
第五章综合练习
【培优训练题】
1.(河南初赛)下列说法正确的是 ( )
A.用煤炉取暖时,在炉子上放一盆水可以防止一氧化碳中毒
B.干冰灭火器灭火只是利用了二氧化碳的化学性质
C.H2CO3、CO、CH4、C四种物质中,碳元素的化合是从由高到低的顺序排列的
D.相同质量的Na2CO3、CaCO3分别与足量盐酸反应,CaCO3产生的CO2质量多
2.已知在相同温度和压强下,含相同分子数的任何气体所占的体积相同,现有一套以天然气(主要是CH4)为燃料的灶具欲改烧液化石油气(C3H8),要使C3H8 完全燃烧,应采用的措施正确的是 ( )
A.减少空气的进气量,增大液化石油气的进气量
B.增大空气的进气量,也增大液化石油气的进气量
C.增大空气的进气量,或减少液化石油气的进气量
D.同时减少空气和液化石油气的进气量
3.(全国复赛)一定量的木炭在盛有氮气和氧气混合气体的密闭容器中燃烧后生成CO和CO2,且测得反应后所得CO、CO2、N2的混合气体中碳元素的质量分数为24%,则其中氮气的质量分数可能为
( )
A.10% B.30% C.50% D.70%
4.(广东竞赛题)A、B、C、D都是初中化学中的常见物质,具有如右下图所示的转化关系(反应条件,其他反应物及多余产物均已略去)。
(1)若A是一种白色难溶于水的钙盐,
由三种元素组成,C是一种参与植物
光合作用的气体。则 A、B、C、D
四种物质分别是:A ;B ;C ;D 。
(2)若A是人类赖以生存的一种无色液体,D是一种黑色固体。则 A、B、C、D四种物质分别是:A ;B ;C ;D 。
5.(宁波竞赛题)结合图示实验装置,回答下列问题。
(1)图中a、b仪器的名称:a ,b 。
(2)用高锰酸钾固体制氧气,选用的发生装置是__________(选填“A” “B”或“C”),装入药品前应先 ,反应的化学方程式是 。
(3)用块状固体和液体不加热制取气体时,改用C装置(多孔隔板用来放块状固体)代替B装置的优点是 (答出一点即可)。
(4)右图是某微型实验的装置图。试管中反
应发生后a处的变化是 ,
b处的变化是 ,烧杯中的
现象是 。
微型实验装置的优点是(请答两点):
① __;
② 。
参考答案
1.D 【解析】选项A中CO难溶于水;选项B中二氧化碳灭火既利用了其化学性质(不燃烧,也不支持燃烧),又利用了其物理性质(密度比空气大);选项C中CH4中碳元素的化合价为-4,而单质C中碳元素化合价为0。
2.C 【解析】根据CH4和C3H8的化学式可知,燃烧都生成二氧化碳和水,所以分别燃烧1体积的CH4和C3H8,后者比前者消耗更多的氧气(CH4——2O2,C3H8——5O2),所以燃烧天然气的灶具改为烧液化石油气,可以增大空气的进气量,也可以减少液化石油气的进气量。
3.B 【解析】假设混合气体是CO2和N2,则说明24%的碳元素均来自CO2,求得混合气体中二氧化碳的质量分数为:24% ÷ ×100%=88%,推知氮气的质量分数为12%;假设混合气体是CO和N2,则说明24%的碳元素均来自CO,求得混合气体中一氧化碳的质量分数为:24% ÷ ×100%=56%,推知氮气的质量分数为44%。因混合气体是CO、CO2、N2三种物质组成的,故混合气体中氮气质量分数应该在12% ~ 44%之间。
4.(1)CaCO3 CaO CO2 Ca(OH)2 (2)H2O O2 H2 CuO(合理答案均可)
【解析】(1)C是一种参与植物光合作用的气体,C一定是二氧化碳;A是一种白色难溶于水的钙盐,由三种元素组成,分解生成二氧化碳,A一定是碳酸钙,则B为氧化钙;(2)若A是人类赖以生存的一种无色液体,A是水,水分解生成B、C,B、C应是氢气和氧气,B与其他物质反应能生成黑色固体,C与黑色固体反应又生成水,B应是氧气,D是一种金属氧化物,如氧化铜或四氧化三铁等,C是氢气。
5.(1)酒精灯 长颈漏斗 (2)A 检查装置气密性
2KMnO4 K2MnO4+MnO2+O2↑
(3)可以随时使反应停止或开始(或方便控制反应的发生与停止)
(4)由紫色变红色 澄清石灰水变浑浊 低处的蜡烛先熄灭
节约药品、产生的污染物少(或废弃物少,合理即可)
【解析】高锰酸钾固体制氧气选择对固体加热的装置A,制取气体的装置加药品前都要检查装置的气密性;C装置中加入多孔的隔板,固体药品放在隔板上,液体从长颈漏斗加入与隔板上的固体药品接触反应发生,不需要生成气体时关闭阀门,反应进行生成的气体排不出,容器内压强增大,液体药品压回长颈漏斗,固液分离反应停止,打开阀门气体排出压强减小,液体流回试管中,反应继续发生,所以此装置可以控制反应的发生;微型实验最大的优点节省药品,减少有害物质的排放。
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
