化学(人教版2019)选择性必修2 2.3 分子结构与物质的性质(共47张ppt)
文档属性
| 名称 | 化学(人教版2019)选择性必修2 2.3 分子结构与物质的性质(共47张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-02 11:37:46 | ||
图片预览








文档简介
(共47张PPT)
§2-3
分子结构与物质的性质
人教版高中化学选择性必修二 第二章 分子结构与性质
目录
键的极性与分子的极性
1
范德华力及其对物质性质的影响
2
氢键及其对物质性质的影响
3
人教版高中化学选修三 第二章 分子结构与性质
溶解性
4
手性
5
无机含氧酸分子的酸性
6
共价键
原子间通过共用电子对形成的化学键。
极性共价键:共用电子对偏向一方,电荷分部不均匀
非极性共价键:共用电子对不偏移,电荷分布均匀
思考:
1、共用电子对不偏向或有偏向是由什么因素引起的呢
2、何为电负性?
---这是由于原子对共用电子对的吸引力不同造成的
---用来描述不同元素的原子对键合电子吸引力的大小
一.键的极性与分子的极性
1、极性键与非极性键
A、键的极性的判断依据:
共用电子对是否有偏向或偏离
B、共用电子对是否有偏向或偏离的影响因素:
键合原子的电负性不同造成的
C、键的极性的判断方法:
(1)同种非金属元素的原子间形成的共价键是非极性键。
(2)不同种非金属元素的原子间形成的共价键是极性键。
小结:
练习与巩固
1.含有非极性键的离子化合物是( )
A.
NaOH B. Na2O2 C. NaCl D. NH4Cl
2.下列元素间形成的共价键中,极性最强的是( )
A.F―F
B.H―F
C.H―Cl
D.H―O
B
B
思考与讨论
1、根据电荷分布是否均匀,共价键有极性、非极性之分,以共价键结合的分子是否也有极性、非极性之分呢?
2、分子的极性又是根据什么来判定呢?
一.键的极性与分子的极性
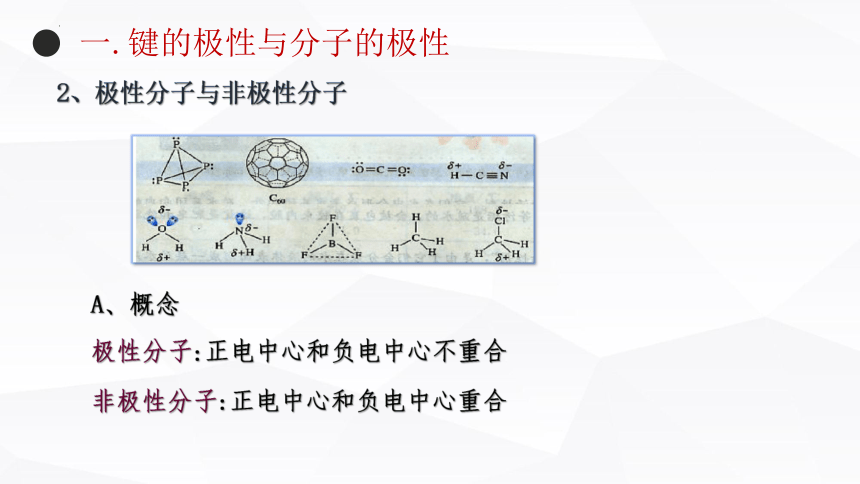
2、极性分子与非极性分子
极性分子:正电中心和负电中心不重合
非极性分子:正电中心和负电中心重合
A、概念
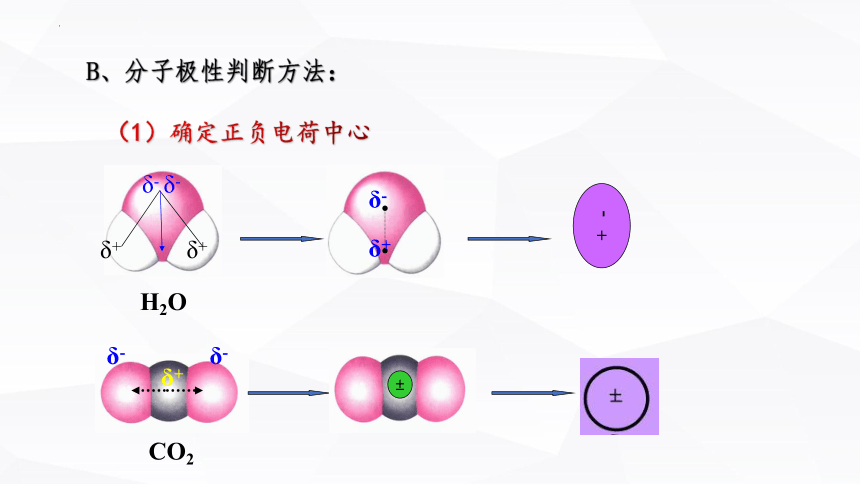
B、分子极性判断方法:
(1)确定正负电荷中心
H2O
δ+
δ+
δ- δ-
δ-
δ+
+ -
δ+
δ-
CO2
±
δ-
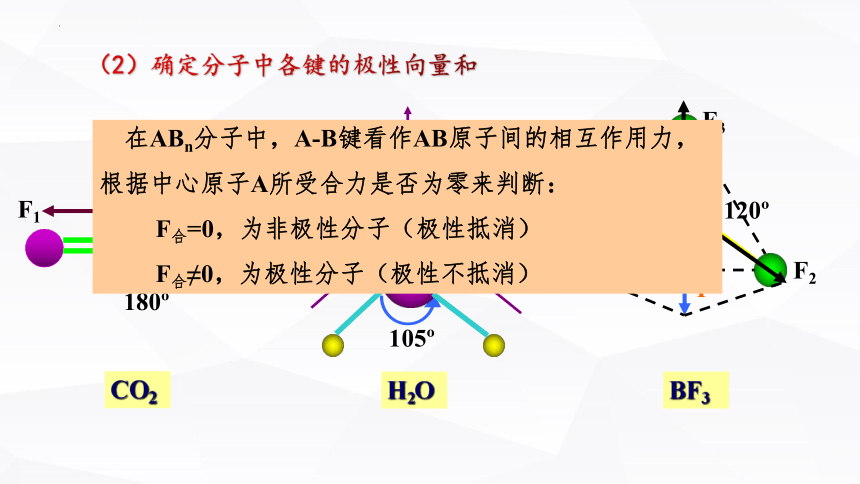
(2)确定分子中各键的极性向量和
180
F1
F合=0
CO2
105
F1
F2
F合≠0
H2O
120
F1
F3
F’
BF3
F2
F2
在ABn分子中,A-B键看作AB原子间的相互作用力,
根据中心原子A所受合力是否为零来判断:
F合=0,为非极性分子(极性抵消)
F合≠0,为极性分子(极性不抵消)
109 28'
CH4: 正四面体型 ,对称结构,C-H键的极性互相抵消( F合=0) ,是非极性分子
C
H
H
H
H
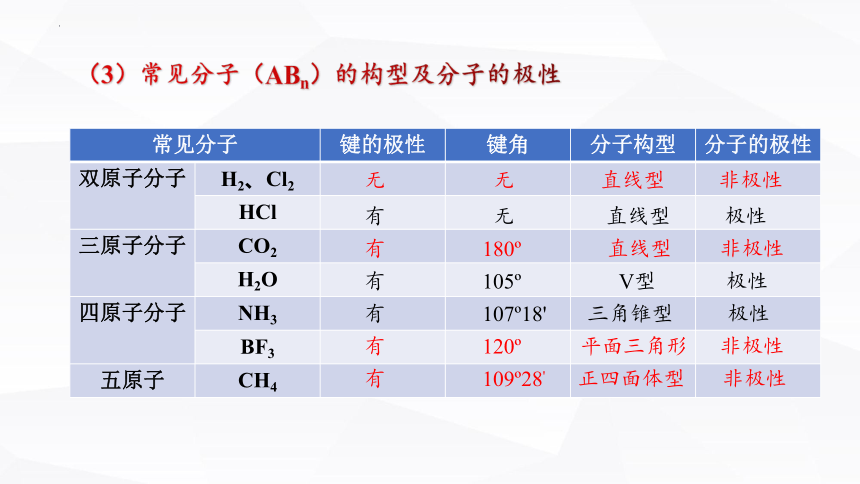
常见分子 键的极性 键角 分子构型 分子的极性
双原子分子 H2、Cl2
HCl
三原子分子 CO2
H2O
四原子分子 NH3
BF3
五原子 CH4
(3)常见分子(ABn)的构型及分子的极性
无 无 直线型 非极性
有 无 直线型 极性
有 105 V型 极性
有 180 直线型 非极性
有 107 18' 三角锥型 极性
有 120 平面三角形 非极性
有 109 28' 正四面体型 非极性
(4)判断ABn型分子极性的经验规律
当中心原子A的化合价的绝对值等于该元素的价电子数时,该分子一般为非极性分子;否则为极性分子。
[练习]
判断下列分子是极性分子还是非极性分子:
PCl3、CCl4、CS2、SO2
非极性分子
小结:
键长、键角
分子的空间结构
键的极性
分子的极性
1、什么是表面活性剂?亲水基团?疏水基团?肥皂和洗涤剂的去污原理是什么?
2、什么是单分子膜?双分子膜?为什么双分子膜以头向外而尾向内的方式排列
二.范德华力及其对物质性质的影响
思考:
气体在加压或降温是为什么会变为液体、固体呢
定义:存在一种把分子聚集在一起的作用力而我们把这种作用力称为分子间作用力,又叫范德华力。
※范德华力很弱,约比化学键的键能小1-2数量级。
(1)范德华力大小
(2)范德华力与相对分子质量的关系
※结构相似时,相对分子质量越大,范德华力越大。
(3)范德华力与分子的极性的关系
※相对分子质量相同或相近时,分子的极性越大,范德华力越大。
(4)范德华力对物质熔沸点的影响
※结构相似的分子,相对分子质量越大,范德华力越大,分子的熔沸点越高。
小结:
范德华力:把分子聚集在一起的作用力。
分子间作用力范围很小,即分子充分接近时才有相互间的作用力。
分子间作用力
化学键(共价键)
三.氢键及其对物质性质的影响
是由已经与电负性很强的原子形成共价键的氢原子(如水分子中的氢)与另一个分子中电负性很强的原子(如水分子中的氧)之间的作用力。
1.氢键的概念:
2.氢键的本质:
是除范德华力外的另一种分子间作用力,氢键的大小,介于化学键与范德华力之间,不属于化学键。但也有键长、键能。
3.氢键的表示:
表示为:X-H Y(X、Y为N、O、F)
注意:
1、实线表示共价键,虚线表示氢键。
2、形成条件
①X原子与H形成共价键,且X的电负性大;
②Y原子的电负性大、半径小且有孤电子对,一般为N、O、F。
3、氢键具有方向性和饱和性。
4.氢键的种类:
5.氢键对物质性质影响:
分子间氢键使物质熔沸点升高
分子内氢键使物质熔沸点降低
(形成分子内氢键物质比分子间氢键的沸点和熔点更低)
(2)对物质溶解度的影响
极性溶剂里,溶质分子与溶剂分子间的氢键使溶质溶解度增大,而当溶质分子形成分子内氢键时使溶质溶解度减小。
(1)对物质熔沸点的影响
思考:NH3为什么极易溶于水?NH3溶于水是 形成N-H…O还是形成O-H…N
…
(3)对水的密度的影响
在水蒸气中,水以单个H2O 分子形式存在;
在液态水中,几个水分子通过氢键结合,形成(H2O)n缔合分子;
在固态水(冰)中,水分子大范围地以氢键互相联结。
范德华力 氢键 共价键
定义
作用微粒
强弱
对物质性质的影响
分子间普遍存在的作用力
已经与电负性很强的原子形成共价键的氢原子与另一分子中电负性很强的原子之间的作用力
原子之间通过共用电子对形成的化学键
相邻原子之间
分子间或分子内氢原子与电负性很强的F、O、N之间
分子之间
弱
较强
很强
范德华力越大,物质熔沸点越高
对某些物质(如水、氨气)的溶解性、熔沸点都产生影响
物质的稳定性
四.溶解性
思考:为什么蔗糖和氨易溶于水,难溶于四氯化碳;而萘和碘却易溶于四氯化碳,难溶于水?
(1)内因:相似相溶原理
“相似相溶”规律: 非极性溶质一般易溶于非极性溶剂,
极性溶质一般易溶于极性溶剂。
③溶质与水发生反应时可增大其溶解度,如:SO2。
(2)外因:影响固体溶解度的主要因素是温度;
影响气体溶解度的主要因素是温度和压强。
水是常见的极性溶剂,离子化合物是强极性物质,很多易溶于水。
(3)其他因素:
①如果溶质与溶剂之间能形成氢键,则溶解度增大,
且氢键越强,溶解性越好。如:NH3。
②“相似相溶”还适用于分子结构的相似性。
1. NH3是极性分子,CH4为非极性分子,而水是极性分子,根据“相似相溶”规律, NH3易溶于水,而CH4不易溶于水。并且NH3与水分子之间还可以形成氢键,使得NH3更易溶于水。
2. 油漆是非极性分子,有机溶剂如(乙酸乙酯)也是非极性溶剂,而水为极性溶剂,根据“相似相溶”规律,应当用有机溶剂溶解油漆而不能用水溶解油漆。
3. 实验表明碘在四氯化碳溶液中的溶解性较好。这是因为碘和四氯化碳都是非极性分子,非极性溶质一般能溶于非极性溶剂,而水是极性分子。
思考:观察一下两组图片,有何特征?
五.手性
具有完全相同的组成和原子排列的一对分子,如同左手和右手一样互为镜像,却在三维空间里不能重叠,互称手性异构体。有手性异构体的分子叫做手性分子。
如果一个碳原子所联结的四个原子或原子团各不相同,那么该碳原子称为手性碳原子,记作﹡C 。
乳酸分子
手性碳原子:
六.无机含氧酸的酸性
1.在同一周期中,处于最高价态的元素,其含氧酸的酸性随原子序数递增,自左至右增强。
如:H3PO4 < H2SO4 < HClO4
2.在同一主族中,处于相同价态的不同元素,其含氧酸的酸性随成酸元素的原子序数递增,自上而下减弱。
3.同一元素若能形成几种不同价态的含氧酸,其酸性依化合价的递增而递增。
如:HClO< HClO2< HClO3思考:不难看出,对于同一种元素的含氧酸来说,该元素的化合价越高,其含氧酸的酸性越强。那么如何解释这种现象呢?
化学上有一种见解,认为含氧酸的通式可写成(HO)mROn,如果成酸元素R相同,则n值越大,R的正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出H+,即酸性越强。
例如,H2SO3可写成(HO)2SO,n=1;
H2SO4可写成(HO)2SO2,n=2。
所以H2SO4的酸性强于H2SO3。
理论解释:
本节小结
键的极性与分子的极性
1
范德华力及其对物质性质的影响
2
氢键及其对物质性质的影响
3
溶解性
4
手性
5
无机含氧酸分子的酸性
6
定义、判断、规律、
应用(解释客观问题)
相似相容原理,应用
应用
§2-3
分子结构与物质的性质
人教版高中化学选择性必修二 第二章 分子结构与性质
目录
键的极性与分子的极性
1
范德华力及其对物质性质的影响
2
氢键及其对物质性质的影响
3
人教版高中化学选修三 第二章 分子结构与性质
溶解性
4
手性
5
无机含氧酸分子的酸性
6
共价键
原子间通过共用电子对形成的化学键。
极性共价键:共用电子对偏向一方,电荷分部不均匀
非极性共价键:共用电子对不偏移,电荷分布均匀
思考:
1、共用电子对不偏向或有偏向是由什么因素引起的呢
2、何为电负性?
---这是由于原子对共用电子对的吸引力不同造成的
---用来描述不同元素的原子对键合电子吸引力的大小
一.键的极性与分子的极性
1、极性键与非极性键
A、键的极性的判断依据:
共用电子对是否有偏向或偏离
B、共用电子对是否有偏向或偏离的影响因素:
键合原子的电负性不同造成的
C、键的极性的判断方法:
(1)同种非金属元素的原子间形成的共价键是非极性键。
(2)不同种非金属元素的原子间形成的共价键是极性键。
小结:
练习与巩固
1.含有非极性键的离子化合物是( )
A.
NaOH B. Na2O2 C. NaCl D. NH4Cl
2.下列元素间形成的共价键中,极性最强的是( )
A.F―F
B.H―F
C.H―Cl
D.H―O
B
B
思考与讨论
1、根据电荷分布是否均匀,共价键有极性、非极性之分,以共价键结合的分子是否也有极性、非极性之分呢?
2、分子的极性又是根据什么来判定呢?
一.键的极性与分子的极性
2、极性分子与非极性分子
极性分子:正电中心和负电中心不重合
非极性分子:正电中心和负电中心重合
A、概念
B、分子极性判断方法:
(1)确定正负电荷中心
H2O
δ+
δ+
δ- δ-
δ-
δ+
+ -
δ+
δ-
CO2
±
δ-
(2)确定分子中各键的极性向量和
180
F1
F合=0
CO2
105
F1
F2
F合≠0
H2O
120
F1
F3
F’
BF3
F2
F2
在ABn分子中,A-B键看作AB原子间的相互作用力,
根据中心原子A所受合力是否为零来判断:
F合=0,为非极性分子(极性抵消)
F合≠0,为极性分子(极性不抵消)
109 28'
CH4: 正四面体型 ,对称结构,C-H键的极性互相抵消( F合=0) ,是非极性分子
C
H
H
H
H
常见分子 键的极性 键角 分子构型 分子的极性
双原子分子 H2、Cl2
HCl
三原子分子 CO2
H2O
四原子分子 NH3
BF3
五原子 CH4
(3)常见分子(ABn)的构型及分子的极性
无 无 直线型 非极性
有 无 直线型 极性
有 105 V型 极性
有 180 直线型 非极性
有 107 18' 三角锥型 极性
有 120 平面三角形 非极性
有 109 28' 正四面体型 非极性
(4)判断ABn型分子极性的经验规律
当中心原子A的化合价的绝对值等于该元素的价电子数时,该分子一般为非极性分子;否则为极性分子。
[练习]
判断下列分子是极性分子还是非极性分子:
PCl3、CCl4、CS2、SO2
非极性分子
小结:
键长、键角
分子的空间结构
键的极性
分子的极性
1、什么是表面活性剂?亲水基团?疏水基团?肥皂和洗涤剂的去污原理是什么?
2、什么是单分子膜?双分子膜?为什么双分子膜以头向外而尾向内的方式排列
二.范德华力及其对物质性质的影响
思考:
气体在加压或降温是为什么会变为液体、固体呢
定义:存在一种把分子聚集在一起的作用力而我们把这种作用力称为分子间作用力,又叫范德华力。
※范德华力很弱,约比化学键的键能小1-2数量级。
(1)范德华力大小
(2)范德华力与相对分子质量的关系
※结构相似时,相对分子质量越大,范德华力越大。
(3)范德华力与分子的极性的关系
※相对分子质量相同或相近时,分子的极性越大,范德华力越大。
(4)范德华力对物质熔沸点的影响
※结构相似的分子,相对分子质量越大,范德华力越大,分子的熔沸点越高。
小结:
范德华力:把分子聚集在一起的作用力。
分子间作用力范围很小,即分子充分接近时才有相互间的作用力。
分子间作用力
化学键(共价键)
三.氢键及其对物质性质的影响
是由已经与电负性很强的原子形成共价键的氢原子(如水分子中的氢)与另一个分子中电负性很强的原子(如水分子中的氧)之间的作用力。
1.氢键的概念:
2.氢键的本质:
是除范德华力外的另一种分子间作用力,氢键的大小,介于化学键与范德华力之间,不属于化学键。但也有键长、键能。
3.氢键的表示:
表示为:X-H Y(X、Y为N、O、F)
注意:
1、实线表示共价键,虚线表示氢键。
2、形成条件
①X原子与H形成共价键,且X的电负性大;
②Y原子的电负性大、半径小且有孤电子对,一般为N、O、F。
3、氢键具有方向性和饱和性。
4.氢键的种类:
5.氢键对物质性质影响:
分子间氢键使物质熔沸点升高
分子内氢键使物质熔沸点降低
(形成分子内氢键物质比分子间氢键的沸点和熔点更低)
(2)对物质溶解度的影响
极性溶剂里,溶质分子与溶剂分子间的氢键使溶质溶解度增大,而当溶质分子形成分子内氢键时使溶质溶解度减小。
(1)对物质熔沸点的影响
思考:NH3为什么极易溶于水?NH3溶于水是 形成N-H…O还是形成O-H…N
…
(3)对水的密度的影响
在水蒸气中,水以单个H2O 分子形式存在;
在液态水中,几个水分子通过氢键结合,形成(H2O)n缔合分子;
在固态水(冰)中,水分子大范围地以氢键互相联结。
范德华力 氢键 共价键
定义
作用微粒
强弱
对物质性质的影响
分子间普遍存在的作用力
已经与电负性很强的原子形成共价键的氢原子与另一分子中电负性很强的原子之间的作用力
原子之间通过共用电子对形成的化学键
相邻原子之间
分子间或分子内氢原子与电负性很强的F、O、N之间
分子之间
弱
较强
很强
范德华力越大,物质熔沸点越高
对某些物质(如水、氨气)的溶解性、熔沸点都产生影响
物质的稳定性
四.溶解性
思考:为什么蔗糖和氨易溶于水,难溶于四氯化碳;而萘和碘却易溶于四氯化碳,难溶于水?
(1)内因:相似相溶原理
“相似相溶”规律: 非极性溶质一般易溶于非极性溶剂,
极性溶质一般易溶于极性溶剂。
③溶质与水发生反应时可增大其溶解度,如:SO2。
(2)外因:影响固体溶解度的主要因素是温度;
影响气体溶解度的主要因素是温度和压强。
水是常见的极性溶剂,离子化合物是强极性物质,很多易溶于水。
(3)其他因素:
①如果溶质与溶剂之间能形成氢键,则溶解度增大,
且氢键越强,溶解性越好。如:NH3。
②“相似相溶”还适用于分子结构的相似性。
1. NH3是极性分子,CH4为非极性分子,而水是极性分子,根据“相似相溶”规律, NH3易溶于水,而CH4不易溶于水。并且NH3与水分子之间还可以形成氢键,使得NH3更易溶于水。
2. 油漆是非极性分子,有机溶剂如(乙酸乙酯)也是非极性溶剂,而水为极性溶剂,根据“相似相溶”规律,应当用有机溶剂溶解油漆而不能用水溶解油漆。
3. 实验表明碘在四氯化碳溶液中的溶解性较好。这是因为碘和四氯化碳都是非极性分子,非极性溶质一般能溶于非极性溶剂,而水是极性分子。
思考:观察一下两组图片,有何特征?
五.手性
具有完全相同的组成和原子排列的一对分子,如同左手和右手一样互为镜像,却在三维空间里不能重叠,互称手性异构体。有手性异构体的分子叫做手性分子。
如果一个碳原子所联结的四个原子或原子团各不相同,那么该碳原子称为手性碳原子,记作﹡C 。
乳酸分子
手性碳原子:
六.无机含氧酸的酸性
1.在同一周期中,处于最高价态的元素,其含氧酸的酸性随原子序数递增,自左至右增强。
如:H3PO4 < H2SO4 < HClO4
2.在同一主族中,处于相同价态的不同元素,其含氧酸的酸性随成酸元素的原子序数递增,自上而下减弱。
3.同一元素若能形成几种不同价态的含氧酸,其酸性依化合价的递增而递增。
如:HClO< HClO2< HClO3
化学上有一种见解,认为含氧酸的通式可写成(HO)mROn,如果成酸元素R相同,则n值越大,R的正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出H+,即酸性越强。
例如,H2SO3可写成(HO)2SO,n=1;
H2SO4可写成(HO)2SO2,n=2。
所以H2SO4的酸性强于H2SO3。
理论解释:
本节小结
键的极性与分子的极性
1
范德华力及其对物质性质的影响
2
氢键及其对物质性质的影响
3
溶解性
4
手性
5
无机含氧酸分子的酸性
6
定义、判断、规律、
应用(解释客观问题)
相似相容原理,应用
应用
