化学(人教版2019)选择性必修2 2.2 分子的空间结构(共72张ppt)
文档属性
| 名称 | 化学(人教版2019)选择性必修2 2.2 分子的空间结构(共72张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-02 11:38:43 | ||
图片预览








文档简介
(共72张PPT)
§2-2
分子的空间结构
人教版高中化学选择性必修二 第二章 分子结构与性质
目录
形形色色的分子
1
价层电子对互斥模型
2
杂化轨道理论简介
3
人教版高中化学选修三 第二章 分子结构与性质
配合物理论简介
4
σ键和π键
判断、应用
思考:H2O、CO2、NH3、BF3的空间结构是怎样的?
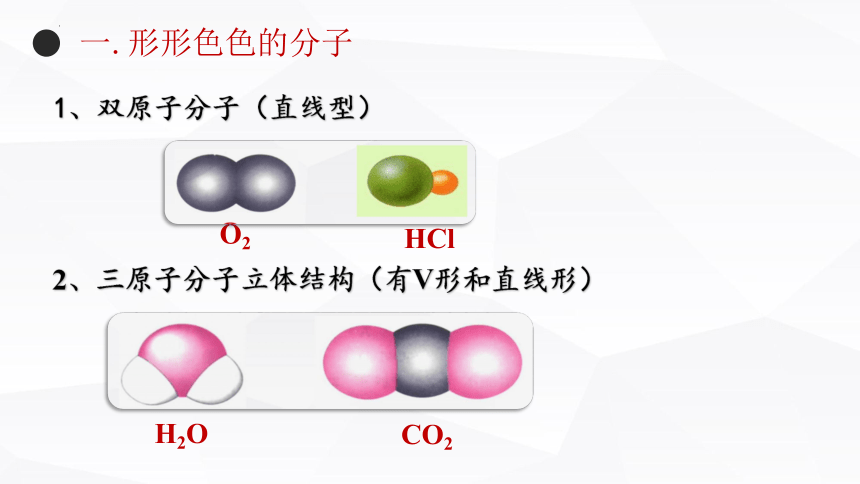
一.形形色色的分子
O2
HCl
H2O
CO2
1、双原子分子(直线型)
2、三原子分子立体结构(有V形和直线形)
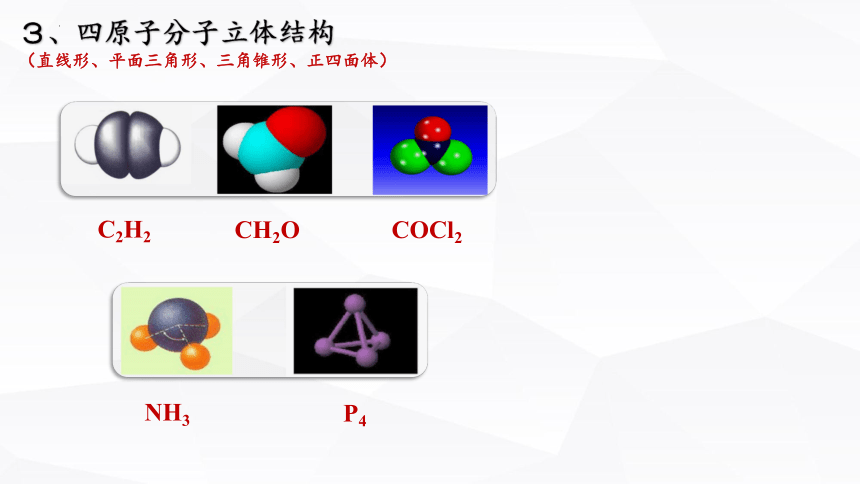
3、四原子分子立体结构
(直线形、平面三角形、三角锥形、正四面体)
C2H2
CH2O
COCl2
NH3
P4
4、五原子分子立体结构
最常见的是正四面体
CH4
C6H6
C8H8
CH3OH
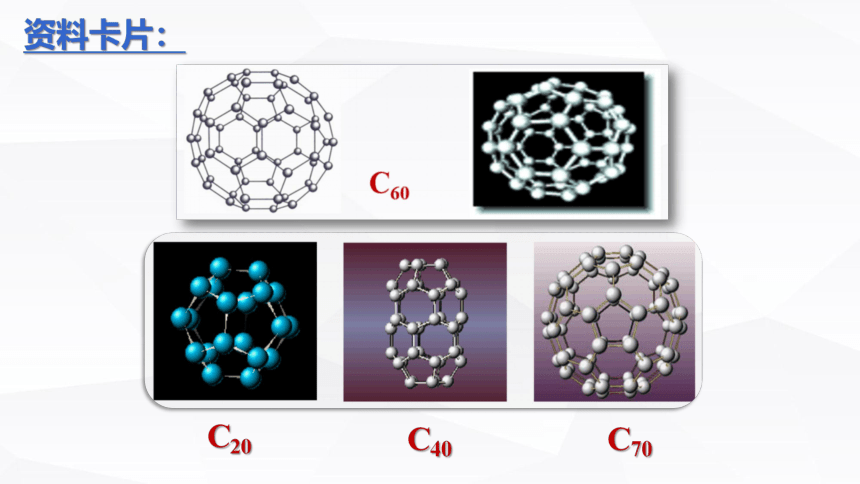
5、其它:
C20
C40
C70
资料卡片:
分子的立体结构
大部分分子由多个原子构成,它们以共价键形式结合,它们在空间中的形状就是空间构型,有直线形(如CO,N2,CO2),有平面三角形(如BFЗ),有正四面体(CH4),有三角锥(NHз)。
思考:
同为三原子分子,CO2 和 H2O 分子的空间结构却不同,什么原因?
直线形
V形
思考:
同为四原子分子, CH2O与 NH3分子的空间结构却不同,什么原因?
三角锥形
平面三角形
对ABm型分子或离子,中心原子A价层电子对(包括成键电子对和孤对电子)之间存在排斥力,将使分子中的原子处于尽可能远的相对位置上,以使各原子之间斥力最小,分子体系能量最低。
(1)理论要点:
二.价层电子对互斥理论(VSEPR theory)
2
电子对数目与立体结构
4
3
5
6
(2)模型:
一个分子或离子中的价层电子对在空间的分布(即含孤对电子的VSEPR模型)
2 3 4 5 6
直线形 平面三角形 正四面体 三角双锥体 正八面体
①对ABm型分子,若中心原子A价层电子对只有成键电子对(即中心原子的价电子都用于形成共价键),则价层电子对的相对位置就是分子的构型;
化学式 CO2 CH4
结构式
模型
分子立体结构
②若中心原子A价层电子对包括成键电子对和孤对电子(中心原子上有孤对电子),则价层电子对的相对位置不是分子的构型, 如:
化学式 NH3 H2O
结构式
模型
分子立体结构
以ABn型分子为例:
中心原子:A
价层电子对(vp)=σ键电子对+中心原子的孤电子对
σ 键电子对(bp)=n
中心原子的孤电子对(lp)= 1/2(a-xb ±离子电荷数)
(3) 如何确定价层电子对数:
分子 或 离子 中 心 原 子 中心原子上的孤电子对数(lp) 1/2(a-xb) 与中心原子结合的原子数(bp) (σ键数) 价层电子对数(vp)=
lp+bp
a x b
中心原子的价电子数 与中心原子结合的原子数 与中心原子结合的原子最多能接受的电子数
SO2 S
SO32– S
CO32– C
NH4+ N
6
6+2=8
4+2=6
2
3
3
2
2
2
1
1
0
2
3
3
3
4
3
5-1= 4
4
1
0
4
4
(4)价层电子对互斥理论
对几种分子或离子立体构型的推测
分子或离子 σ键电子对数 孤电子对数 价层电子对数 VSEPR模 型 立 体
构 型
SO2
SO32-
CO32-
2
1
3
3
1
4
3
0
3
分子 或 离子 中 心 原 子 中心原子上的孤电子对数(lp) 1/2(a-xb) 与中心原子结合的原子数(bp) (σ键数) 价层电子对数(Vp)= lp+bp VSEPR模型 立体构型
a x b
中心原子的价电子数 与中心原子结合的原子数 与中心原子结合的原子最多能接受的电子数
BF3 B
NH4+ N
SO32– S
5-1= 4
4
1
0
4
4
正四面体
正四面体
3
3
1
0
3
3
平面三角形
平面三角形
6+2= 8
3
1
1
4
4
正四面体
三角锥形
分子立体构型的求得过程:
一、计算中心原子孤电子对数 lp=1/2(a-xb)
二、计算中心原子的价电子对数 Vp=lp+bp
三、得到VSEPR模型
四、得到分子的立体构型
随堂练习:
B
BC
C
联想·质疑:
1、写出C原子核外电子的轨道排布式,并由此推测:CH4分子的C原子有没有可能形成四个共价键?怎样才能形成四个共价键?
2、如果C原子就以1个2s轨道和3个2p轨道上的单电子,分别与四个H原子的1s轨道上的单电子重叠成键,所形成的四个共价键能否完全相同?这与CH4分子的实际情况是否吻合?
如何才能使CH4分子中的C原子与四个H原子形成完全等同的四个共价键呢?
原子轨道?
伸展方向?
109.5°
C的电子排布:1s22s22p2
由1个s轨道和3个p轨道混杂并重新组合成4个能量与形状完全相同的轨道。
⒈sp3杂化
三.杂化轨道理论
为了四个杂化轨道在空间尽可能远离,使轨道间的排斥最小,4个杂化轨道的伸展方向分别指向正四面体的四个顶点。
理论分析:四个H原子分别以4个s轨道与C原子上的四个sp3杂化轨道相互重叠后,就形成了四个性质、能量和键角都完全相同的s-sp3σ键,形成一个正四面体构型的分子。
109.5°
⒉sp2杂化
⑴ BF3分子的形成和空间构型
B的电子排布:1s22s22p1
由1个s轨道和2个p轨道混杂并重新组合成3个能量与形状完全相同的轨道。
为使轨道间的排斥力最小,3个sp2杂化轨道呈正三角形分布,夹角为1200。当3个sp2杂化轨道分别与其他3个相同原子的轨道重叠成键后,就会形成平面三角形构型的分子。
理论分析:B原子的三个SP2杂化轨道分别与3个F原子含有单电子的2p轨道重叠,形成3个sp2-p的σ键。故BF3 分子的空间构型是平面三角形。
『思考』:通过分析CH2=CH2分子的结构,你认为分子中的C原子是否也需要“杂化”?它又应该进行怎样的“杂化”?
⑵ CH2=CH2分子的形成和空间构型
『思考』:根据以上对sp2杂化过程的分析,自己尝试推测一下乙烯分子中C原子的杂化类型和成键情况,尤其是C=C的形成情况?现在你能否解释乙烯分子的结构特点了?
C的电子排布:1s22s22p2
sp2杂化:乙烯
苯中碳原子也是以sp2杂化的:
⒊sp1杂化
BeCl2分子的形成和空间构型
Be的电子排布:1s22s22p0
由1个s轨道和1个p轨道混杂并重新组合成2个能量与形状完全相同的轨道。
为使轨道间的排斥能最小,轨道间的夹角为1800 。当2个sp1杂化轨道与其他原子轨道重叠成键后就会形成直线型分子。
理论分析:Be原子上的两个sp1杂化轨道分别与2个Cl原子中含有单电子的3p轨道重叠,形成2个sp p的σ键,所以BeCl2分子的空间构型为直线。
BeCl2分子的空间构型:
杂化轨道理论小结:
1、杂化轨道:
原子中能量相近的几个轨道间通过相互的混杂,形成相同数量的几个能量与形状都相同的新轨道。
2、杂化轨道的特点:
1) 杂化轨道也是原子轨道,因此,它们可以与其他原子 的单电子配对成键。
2) 杂化轨道全部都用于形成σ键或容纳孤对电子,剩余的p轨道还可形成 键。
3) 杂化轨道的空间伸展方向要按一定规律发生变化。
3.三种sp杂化轨道的比较
杂 化 类 型 sp1 sp2 sp3
参与杂化的原子轨道 1个 s + 1个p 1个s + 2个p 1个s + 3个p
杂化轨道数 2个sp1 杂化轨道 3个sp2 杂化轨道 4个sp3
杂化轨道
杂化轨道间夹角 1800 1200 109.50
空间构型 直 线 正三角形 正四面体
实例 BeCl2 , C2H2 BF3 , C2H4 CH4 , CCl4
杂化轨道数 = 中心原子价层电子对数
= 中心原子孤对电子对数+中心原子结合的原子数
4.中心原子杂化类型判断的一般方法
代表物 价层电子对数 Vp=lp+bp 杂化轨道类型 分子结构
CO2
CH2O
SO2
CH4
NH3
H2O
0+2=2
sp
直线形
0+3=3
sp2
平面三角形
1+2=3
sp2
V形
0+4=4
sp3
正四体形
1+3=4
sp3
三角锥形
2+2=4
sp3
V形
杂化类型 dsp2 sp3d sp3d2
d2sp3
杂化轨道 4 5 6
轨道夹角 180°/90° 90°/120°/180 ° 90°/180°
空间构型 平面正方形 三角双锥 正八面体
示例 Cu(NH3)42+ PCl5 SF6、SiF62-
5.其它杂化类型
※:此类杂化一般是金属作为中心原子用于形成配位化合物
实例分析:
试解释CCl4分子的空间构型。
CCl4分子的中心原子是C,其价层电子组态为2s22px12py1。在形成CCl4分子的过程中,C原子的2s轨道上的1个电子被激发到2p空轨道,价层电子组态为2s12px12py12pz1,1个2s轨道和3个2p轨道进行sp3杂化,形成夹角均为109028′的4个完全等同的sp3杂化轨道。其形成过程可表示为
理论分析:C原子的4个sp3杂化轨道分别与4个Cl原子含有单电子的2p轨道重叠,形成4个sp3-p的σ键。故CCl4 分子的空间构型是正四面体。
实验测定:CCl4分子中有四个完全等同的C-Cl键,其分子的空间构型为正四面体。
练习:
用杂化轨道理论分析下列物质的杂化类型、成键情况和 分子的空间构型。
(1) CO2 (2)H2O
(3)HCHO (4)HCN
新闻:
1994年12月至1995年3月,清华大学92级化学系物理化学和仪器分析专业2班学生朱令中了铊毒,病情严重。
1995年4月10日开始,为救治清华女生朱令铊中毒,各国医生为她“网上会诊”,曾引起国内外舆论界的轰动。1995年4月底,经北京市职业病卫生防治所的陈震阳教授化验确诊后,在协和医院,用某药救治。在服用该药后不到24小时内,朱令体内的铊量开始下降,10天之后,她的血液、脑脊液中铊离子的含量就降至为零。
该药是一种配合物叫普鲁士蓝
普鲁士蓝: 是一种深蓝色的颜料,在画图和青花瓷器中应用。
是 1704 年普鲁士人狄斯巴赫在染料作坊中为寻找蓝色染料,而将兽皮、兽血同草木灰在铁锅中强烈地煮沸而得到的直到20年以后,一些化学家才了解普鲁士蓝是什么物质,也掌握了它的生产方法。
经研究确定化学式为 KFe[Fe(CN) 6 ] (六氰合铁酸亚铁钾) 。
德国的前身普鲁士军队的制服颜色就是使用该种颜色,直至第一次世界大战前夕才更换成土灰色。
在医疗上铊可取代普鲁士蓝上的钾后,形成不溶性物质排出体外,对治疗经急慢性铊中毒有一定疗效。
Fe3++3SCN- = Fe(SCN)3
思考:在溶液中为什么不能大量共存?为什么不打沉淀符号?
天蓝色
天蓝色
无 色
无 色
固体颜色
溶液颜色
CuSO4
CuCl2·2H2O
NaCl
K2SO4
白 色
绿 色
白 色
白 色
无色离子
天蓝色离子
Na+ Cl-
K+ SO42-
Cu2+
实验探究:
什么离子呈天蓝色?
Cu
OH2
H2O
H2O
H2O
2+
四种溶液中哪些离子呈无色?
思考交流:Cu2+与H2O是如何结合成[Cu(H2O)4]2+ ?
Cu2+
空轨道接受孤电子对
提供孤电子对
H2O
Cu
OH2
H2O
H2O
H2O
2+
电子对给予体
电子对接受体
配位键
四.配合物理论
1.配位键
定义:提供孤电子对的原子与接受孤电子对的原子之间形成的共价键
形成条件:
一方提供孤电子对
一方提供空轨道
想一想:NH4+是否含有配位键?
表示方法:
A → B
电子对给予体
电子对接受体
特征
是一种特殊的共价键
具有共价键的饱和性与方向性
键参数与一般共价键的键参数相同
2.配位化合物
定义:通常把接受孤电子对的金属离子(或原子)与某些提供孤电子对的分子或离子以配位键结合形成的化合物称为配位化合物,简称配合物。
组成:
内界
配离子
中心离子
配位体(配体)
配位数
外界
[Cu(NH3)4] SO4
A.中心原子(离子)
能够提供空轨道接受孤电子对的金属原子或离子
如:Fe、Co、Ni、Cu、Zn、Ag、Pt、Au及离子
B.配位体(配体)
提供孤电子对的分子或离子
如:X-、OH-、CN-、SCN-、H2O、NH3、CO
C.配位原子
配位体中提供孤电子对的原子,常见的配位原子有X、O、S、N、P等
D.配位数
配位体的数目,即配位键的数目
E.内界
由中心原子(离子)与配体结合而构成
F.配离子的电荷数
配离子的电荷数等于中心离子和配体电荷数的代数和
命名:
A.配离子(从右向左,配位数→配体→合→中心原子或中心离子→化合物)
B.配合物→类似于酸、碱、盐
六氰合铁酸钾
氢氧化二氨合银
三氯一氨合铂酸钾
硫酸四氨合铜
[Cu(NH3)4] SO4
K3[Fe(CN)6]
[Ag(NH3)2]OH
K[Pt(NH3)Cl3]
练习:
实验2-2 现 象
向硫酸铜水溶液中加入氨水
继续加入氨水
蓝色沉淀
深蓝色的透明溶液
离子方程式:
Cu2++2NH3·H2O==Cu(OH)2↓+2NH4+
Cu(OH)2+4NH3·H2O==[Cu(NH3)4]2++2OH-+4H2O
所得溶液为: [Cu(NH3)4]SO4
深蓝色离子: [Cu(NH3)4]2+
总反应:Cu2++ 4NH3·H2O=[ Cu(NH3)4] 2+ + 4H2O
配合物的性质:
A、配合物具有一定的稳定性,配位键越强,配合物越稳定,当遇上配合能力更强的配体时,由一种配离子可能会转变成另一种更稳定的配离子。
B、配合物一般为强电解质,外界能完全电离,而内界离子很难电离,其电离程度很小.
完全电离:[Cu(NH3)4]SO4=[Cu(NH3)4]2++SO42-
很难电离:[Cu(NH3)4]2+ Cu2++4NH3
练习:
0.01mol氯化铬(CrCl3·6H2O)在水溶液中用过量的AgNO3溶液处理,产生0.02molAgCl沉淀,此氯化铬最可能为( )
A.[Cr(H2O)6] Cl3
B.[Cr(H2O)5 Cl] Cl2·H2O
C.[Cr(H2O)4Cl2] Cl·2H2O
D.[Cr(H2O)3Cl3]·3H2O
B
配合物的形成对性质的影响:
颜色的改变
B.溶解度改变
C.稳定性增强
三价铁离子的检验
Fe3++3SCN- = Fe(SCN)3
Fig.1 血红素(含铁配合物)
Fig.2 叶绿素(含镁配合物)
Fig.3 维生素B12 (含钴配合物)
Fig.4 固氮酶中Fe—Mo中心结构
示意图
Fig.5 第二代铂类抗癌药(碳铂)
示意图
配合物的应用:
A.在生命体中的应用
B.在医药中的应用
C.配合物与生物固氮
D.在生产生活中的应用
王水溶金
叶绿素
血红蛋白
抗癌药物
酶
维生素B12
钴配合物
含锌的配合物
含锌酶有80多种
固氮酶
照相技术的定影
电解氧化铝的助熔剂 Na3[AlF6]
镀银工业
H[AuCl4]
小结:
1、配位键:定义、形成条件、表示方法、特征
2、配合物:定义、组成、命名、性质、应用
B
§2-2
分子的空间结构
人教版高中化学选择性必修二 第二章 分子结构与性质
目录
形形色色的分子
1
价层电子对互斥模型
2
杂化轨道理论简介
3
人教版高中化学选修三 第二章 分子结构与性质
配合物理论简介
4
σ键和π键
判断、应用
思考:H2O、CO2、NH3、BF3的空间结构是怎样的?
一.形形色色的分子
O2
HCl
H2O
CO2
1、双原子分子(直线型)
2、三原子分子立体结构(有V形和直线形)
3、四原子分子立体结构
(直线形、平面三角形、三角锥形、正四面体)
C2H2
CH2O
COCl2
NH3
P4
4、五原子分子立体结构
最常见的是正四面体
CH4
C6H6
C8H8
CH3OH
5、其它:
C20
C40
C70
资料卡片:
分子的立体结构
大部分分子由多个原子构成,它们以共价键形式结合,它们在空间中的形状就是空间构型,有直线形(如CO,N2,CO2),有平面三角形(如BFЗ),有正四面体(CH4),有三角锥(NHз)。
思考:
同为三原子分子,CO2 和 H2O 分子的空间结构却不同,什么原因?
直线形
V形
思考:
同为四原子分子, CH2O与 NH3分子的空间结构却不同,什么原因?
三角锥形
平面三角形
对ABm型分子或离子,中心原子A价层电子对(包括成键电子对和孤对电子)之间存在排斥力,将使分子中的原子处于尽可能远的相对位置上,以使各原子之间斥力最小,分子体系能量最低。
(1)理论要点:
二.价层电子对互斥理论(VSEPR theory)
2
电子对数目与立体结构
4
3
5
6
(2)模型:
一个分子或离子中的价层电子对在空间的分布(即含孤对电子的VSEPR模型)
2 3 4 5 6
直线形 平面三角形 正四面体 三角双锥体 正八面体
①对ABm型分子,若中心原子A价层电子对只有成键电子对(即中心原子的价电子都用于形成共价键),则价层电子对的相对位置就是分子的构型;
化学式 CO2 CH4
结构式
模型
分子立体结构
②若中心原子A价层电子对包括成键电子对和孤对电子(中心原子上有孤对电子),则价层电子对的相对位置不是分子的构型, 如:
化学式 NH3 H2O
结构式
模型
分子立体结构
以ABn型分子为例:
中心原子:A
价层电子对(vp)=σ键电子对+中心原子的孤电子对
σ 键电子对(bp)=n
中心原子的孤电子对(lp)= 1/2(a-xb ±离子电荷数)
(3) 如何确定价层电子对数:
分子 或 离子 中 心 原 子 中心原子上的孤电子对数(lp) 1/2(a-xb) 与中心原子结合的原子数(bp) (σ键数) 价层电子对数(vp)=
lp+bp
a x b
中心原子的价电子数 与中心原子结合的原子数 与中心原子结合的原子最多能接受的电子数
SO2 S
SO32– S
CO32– C
NH4+ N
6
6+2=8
4+2=6
2
3
3
2
2
2
1
1
0
2
3
3
3
4
3
5-1= 4
4
1
0
4
4
(4)价层电子对互斥理论
对几种分子或离子立体构型的推测
分子或离子 σ键电子对数 孤电子对数 价层电子对数 VSEPR模 型 立 体
构 型
SO2
SO32-
CO32-
2
1
3
3
1
4
3
0
3
分子 或 离子 中 心 原 子 中心原子上的孤电子对数(lp) 1/2(a-xb) 与中心原子结合的原子数(bp) (σ键数) 价层电子对数(Vp)= lp+bp VSEPR模型 立体构型
a x b
中心原子的价电子数 与中心原子结合的原子数 与中心原子结合的原子最多能接受的电子数
BF3 B
NH4+ N
SO32– S
5-1= 4
4
1
0
4
4
正四面体
正四面体
3
3
1
0
3
3
平面三角形
平面三角形
6+2= 8
3
1
1
4
4
正四面体
三角锥形
分子立体构型的求得过程:
一、计算中心原子孤电子对数 lp=1/2(a-xb)
二、计算中心原子的价电子对数 Vp=lp+bp
三、得到VSEPR模型
四、得到分子的立体构型
随堂练习:
B
BC
C
联想·质疑:
1、写出C原子核外电子的轨道排布式,并由此推测:CH4分子的C原子有没有可能形成四个共价键?怎样才能形成四个共价键?
2、如果C原子就以1个2s轨道和3个2p轨道上的单电子,分别与四个H原子的1s轨道上的单电子重叠成键,所形成的四个共价键能否完全相同?这与CH4分子的实际情况是否吻合?
如何才能使CH4分子中的C原子与四个H原子形成完全等同的四个共价键呢?
原子轨道?
伸展方向?
109.5°
C的电子排布:1s22s22p2
由1个s轨道和3个p轨道混杂并重新组合成4个能量与形状完全相同的轨道。
⒈sp3杂化
三.杂化轨道理论
为了四个杂化轨道在空间尽可能远离,使轨道间的排斥最小,4个杂化轨道的伸展方向分别指向正四面体的四个顶点。
理论分析:四个H原子分别以4个s轨道与C原子上的四个sp3杂化轨道相互重叠后,就形成了四个性质、能量和键角都完全相同的s-sp3σ键,形成一个正四面体构型的分子。
109.5°
⒉sp2杂化
⑴ BF3分子的形成和空间构型
B的电子排布:1s22s22p1
由1个s轨道和2个p轨道混杂并重新组合成3个能量与形状完全相同的轨道。
为使轨道间的排斥力最小,3个sp2杂化轨道呈正三角形分布,夹角为1200。当3个sp2杂化轨道分别与其他3个相同原子的轨道重叠成键后,就会形成平面三角形构型的分子。
理论分析:B原子的三个SP2杂化轨道分别与3个F原子含有单电子的2p轨道重叠,形成3个sp2-p的σ键。故BF3 分子的空间构型是平面三角形。
『思考』:通过分析CH2=CH2分子的结构,你认为分子中的C原子是否也需要“杂化”?它又应该进行怎样的“杂化”?
⑵ CH2=CH2分子的形成和空间构型
『思考』:根据以上对sp2杂化过程的分析,自己尝试推测一下乙烯分子中C原子的杂化类型和成键情况,尤其是C=C的形成情况?现在你能否解释乙烯分子的结构特点了?
C的电子排布:1s22s22p2
sp2杂化:乙烯
苯中碳原子也是以sp2杂化的:
⒊sp1杂化
BeCl2分子的形成和空间构型
Be的电子排布:1s22s22p0
由1个s轨道和1个p轨道混杂并重新组合成2个能量与形状完全相同的轨道。
为使轨道间的排斥能最小,轨道间的夹角为1800 。当2个sp1杂化轨道与其他原子轨道重叠成键后就会形成直线型分子。
理论分析:Be原子上的两个sp1杂化轨道分别与2个Cl原子中含有单电子的3p轨道重叠,形成2个sp p的σ键,所以BeCl2分子的空间构型为直线。
BeCl2分子的空间构型:
杂化轨道理论小结:
1、杂化轨道:
原子中能量相近的几个轨道间通过相互的混杂,形成相同数量的几个能量与形状都相同的新轨道。
2、杂化轨道的特点:
1) 杂化轨道也是原子轨道,因此,它们可以与其他原子 的单电子配对成键。
2) 杂化轨道全部都用于形成σ键或容纳孤对电子,剩余的p轨道还可形成 键。
3) 杂化轨道的空间伸展方向要按一定规律发生变化。
3.三种sp杂化轨道的比较
杂 化 类 型 sp1 sp2 sp3
参与杂化的原子轨道 1个 s + 1个p 1个s + 2个p 1个s + 3个p
杂化轨道数 2个sp1 杂化轨道 3个sp2 杂化轨道 4个sp3
杂化轨道
杂化轨道间夹角 1800 1200 109.50
空间构型 直 线 正三角形 正四面体
实例 BeCl2 , C2H2 BF3 , C2H4 CH4 , CCl4
杂化轨道数 = 中心原子价层电子对数
= 中心原子孤对电子对数+中心原子结合的原子数
4.中心原子杂化类型判断的一般方法
代表物 价层电子对数 Vp=lp+bp 杂化轨道类型 分子结构
CO2
CH2O
SO2
CH4
NH3
H2O
0+2=2
sp
直线形
0+3=3
sp2
平面三角形
1+2=3
sp2
V形
0+4=4
sp3
正四体形
1+3=4
sp3
三角锥形
2+2=4
sp3
V形
杂化类型 dsp2 sp3d sp3d2
d2sp3
杂化轨道 4 5 6
轨道夹角 180°/90° 90°/120°/180 ° 90°/180°
空间构型 平面正方形 三角双锥 正八面体
示例 Cu(NH3)42+ PCl5 SF6、SiF62-
5.其它杂化类型
※:此类杂化一般是金属作为中心原子用于形成配位化合物
实例分析:
试解释CCl4分子的空间构型。
CCl4分子的中心原子是C,其价层电子组态为2s22px12py1。在形成CCl4分子的过程中,C原子的2s轨道上的1个电子被激发到2p空轨道,价层电子组态为2s12px12py12pz1,1个2s轨道和3个2p轨道进行sp3杂化,形成夹角均为109028′的4个完全等同的sp3杂化轨道。其形成过程可表示为
理论分析:C原子的4个sp3杂化轨道分别与4个Cl原子含有单电子的2p轨道重叠,形成4个sp3-p的σ键。故CCl4 分子的空间构型是正四面体。
实验测定:CCl4分子中有四个完全等同的C-Cl键,其分子的空间构型为正四面体。
练习:
用杂化轨道理论分析下列物质的杂化类型、成键情况和 分子的空间构型。
(1) CO2 (2)H2O
(3)HCHO (4)HCN
新闻:
1994年12月至1995年3月,清华大学92级化学系物理化学和仪器分析专业2班学生朱令中了铊毒,病情严重。
1995年4月10日开始,为救治清华女生朱令铊中毒,各国医生为她“网上会诊”,曾引起国内外舆论界的轰动。1995年4月底,经北京市职业病卫生防治所的陈震阳教授化验确诊后,在协和医院,用某药救治。在服用该药后不到24小时内,朱令体内的铊量开始下降,10天之后,她的血液、脑脊液中铊离子的含量就降至为零。
该药是一种配合物叫普鲁士蓝
普鲁士蓝: 是一种深蓝色的颜料,在画图和青花瓷器中应用。
是 1704 年普鲁士人狄斯巴赫在染料作坊中为寻找蓝色染料,而将兽皮、兽血同草木灰在铁锅中强烈地煮沸而得到的直到20年以后,一些化学家才了解普鲁士蓝是什么物质,也掌握了它的生产方法。
经研究确定化学式为 KFe[Fe(CN) 6 ] (六氰合铁酸亚铁钾) 。
德国的前身普鲁士军队的制服颜色就是使用该种颜色,直至第一次世界大战前夕才更换成土灰色。
在医疗上铊可取代普鲁士蓝上的钾后,形成不溶性物质排出体外,对治疗经急慢性铊中毒有一定疗效。
Fe3++3SCN- = Fe(SCN)3
思考:在溶液中为什么不能大量共存?为什么不打沉淀符号?
天蓝色
天蓝色
无 色
无 色
固体颜色
溶液颜色
CuSO4
CuCl2·2H2O
NaCl
K2SO4
白 色
绿 色
白 色
白 色
无色离子
天蓝色离子
Na+ Cl-
K+ SO42-
Cu2+
实验探究:
什么离子呈天蓝色?
Cu
OH2
H2O
H2O
H2O
2+
四种溶液中哪些离子呈无色?
思考交流:Cu2+与H2O是如何结合成[Cu(H2O)4]2+ ?
Cu2+
空轨道接受孤电子对
提供孤电子对
H2O
Cu
OH2
H2O
H2O
H2O
2+
电子对给予体
电子对接受体
配位键
四.配合物理论
1.配位键
定义:提供孤电子对的原子与接受孤电子对的原子之间形成的共价键
形成条件:
一方提供孤电子对
一方提供空轨道
想一想:NH4+是否含有配位键?
表示方法:
A → B
电子对给予体
电子对接受体
特征
是一种特殊的共价键
具有共价键的饱和性与方向性
键参数与一般共价键的键参数相同
2.配位化合物
定义:通常把接受孤电子对的金属离子(或原子)与某些提供孤电子对的分子或离子以配位键结合形成的化合物称为配位化合物,简称配合物。
组成:
内界
配离子
中心离子
配位体(配体)
配位数
外界
[Cu(NH3)4] SO4
A.中心原子(离子)
能够提供空轨道接受孤电子对的金属原子或离子
如:Fe、Co、Ni、Cu、Zn、Ag、Pt、Au及离子
B.配位体(配体)
提供孤电子对的分子或离子
如:X-、OH-、CN-、SCN-、H2O、NH3、CO
C.配位原子
配位体中提供孤电子对的原子,常见的配位原子有X、O、S、N、P等
D.配位数
配位体的数目,即配位键的数目
E.内界
由中心原子(离子)与配体结合而构成
F.配离子的电荷数
配离子的电荷数等于中心离子和配体电荷数的代数和
命名:
A.配离子(从右向左,配位数→配体→合→中心原子或中心离子→化合物)
B.配合物→类似于酸、碱、盐
六氰合铁酸钾
氢氧化二氨合银
三氯一氨合铂酸钾
硫酸四氨合铜
[Cu(NH3)4] SO4
K3[Fe(CN)6]
[Ag(NH3)2]OH
K[Pt(NH3)Cl3]
练习:
实验2-2 现 象
向硫酸铜水溶液中加入氨水
继续加入氨水
蓝色沉淀
深蓝色的透明溶液
离子方程式:
Cu2++2NH3·H2O==Cu(OH)2↓+2NH4+
Cu(OH)2+4NH3·H2O==[Cu(NH3)4]2++2OH-+4H2O
所得溶液为: [Cu(NH3)4]SO4
深蓝色离子: [Cu(NH3)4]2+
总反应:Cu2++ 4NH3·H2O=[ Cu(NH3)4] 2+ + 4H2O
配合物的性质:
A、配合物具有一定的稳定性,配位键越强,配合物越稳定,当遇上配合能力更强的配体时,由一种配离子可能会转变成另一种更稳定的配离子。
B、配合物一般为强电解质,外界能完全电离,而内界离子很难电离,其电离程度很小.
完全电离:[Cu(NH3)4]SO4=[Cu(NH3)4]2++SO42-
很难电离:[Cu(NH3)4]2+ Cu2++4NH3
练习:
0.01mol氯化铬(CrCl3·6H2O)在水溶液中用过量的AgNO3溶液处理,产生0.02molAgCl沉淀,此氯化铬最可能为( )
A.[Cr(H2O)6] Cl3
B.[Cr(H2O)5 Cl] Cl2·H2O
C.[Cr(H2O)4Cl2] Cl·2H2O
D.[Cr(H2O)3Cl3]·3H2O
B
配合物的形成对性质的影响:
颜色的改变
B.溶解度改变
C.稳定性增强
三价铁离子的检验
Fe3++3SCN- = Fe(SCN)3
Fig.1 血红素(含铁配合物)
Fig.2 叶绿素(含镁配合物)
Fig.3 维生素B12 (含钴配合物)
Fig.4 固氮酶中Fe—Mo中心结构
示意图
Fig.5 第二代铂类抗癌药(碳铂)
示意图
配合物的应用:
A.在生命体中的应用
B.在医药中的应用
C.配合物与生物固氮
D.在生产生活中的应用
王水溶金
叶绿素
血红蛋白
抗癌药物
酶
维生素B12
钴配合物
含锌的配合物
含锌酶有80多种
固氮酶
照相技术的定影
电解氧化铝的助熔剂 Na3[AlF6]
镀银工业
H[AuCl4]
小结:
1、配位键:定义、形成条件、表示方法、特征
2、配合物:定义、组成、命名、性质、应用
B
