化学(人教版2019)选择性必修2 2.1 化学键(共23张ppt)
文档属性
| 名称 | 化学(人教版2019)选择性必修2 2.1 化学键(共23张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-02 11:39:38 | ||
图片预览




文档简介
(共23张PPT)
§2-1
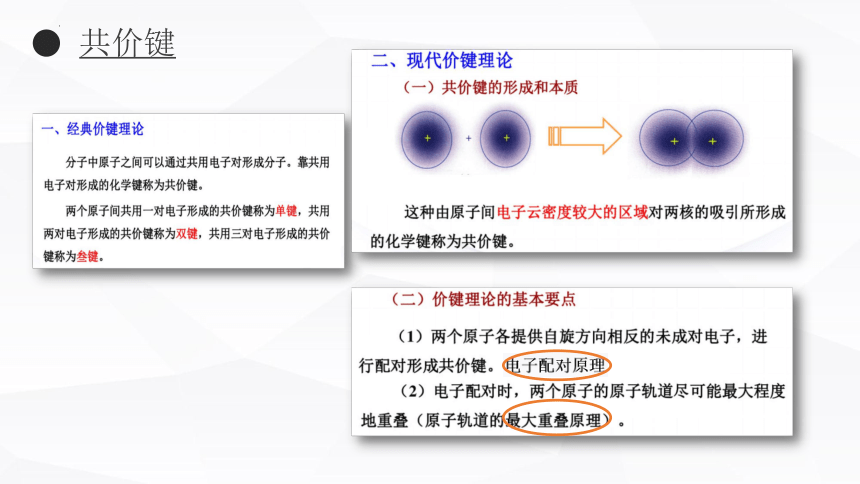
共价键
人教版高中化学选择性必修二 第二章 分子结构与性质
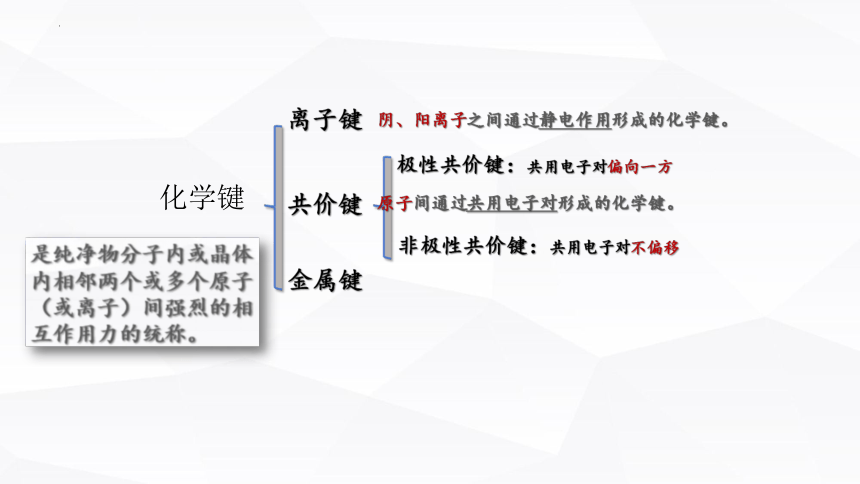
化学键
离子键
共价键
金属键
阴、阳离子之间通过静电作用形成的化学键。
原子间通过共用电子对形成的化学键。
极性共价键:共用电子对偏向一方
非极性共价键:共用电子对不偏移
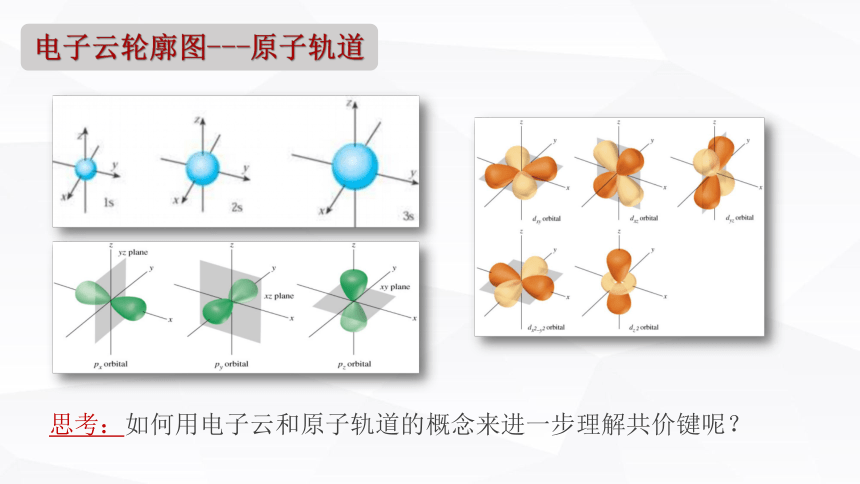
电子云轮廓图---原子轨道
思考:如何用电子云和原子轨道的概念来进一步理解共价键呢?
目录
共价键
1
键参数---(键能、键长与键角)
2
等电子原理
3
人教版高中化学选修三 第二章 分子结构与性质
共价键
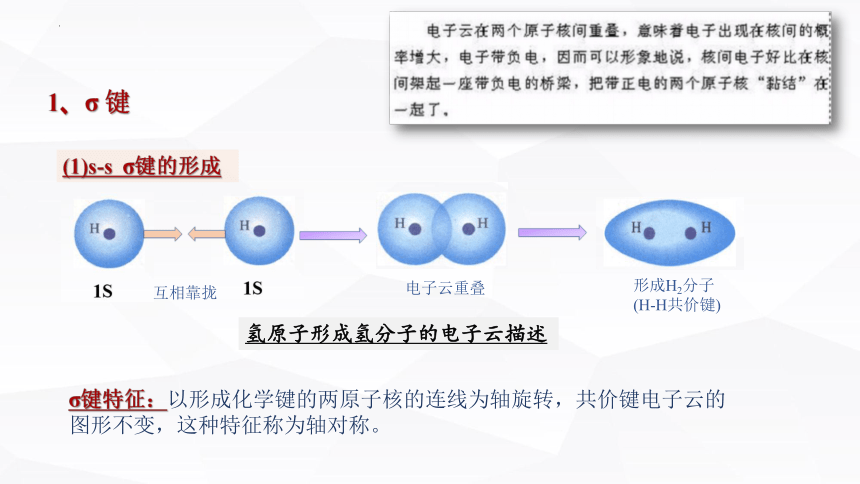
氢原子形成氢分子的电子云描述
互相靠拢
电子云重叠
形成H2分子
(H-H共价键)
(1)s-s σ键的形成
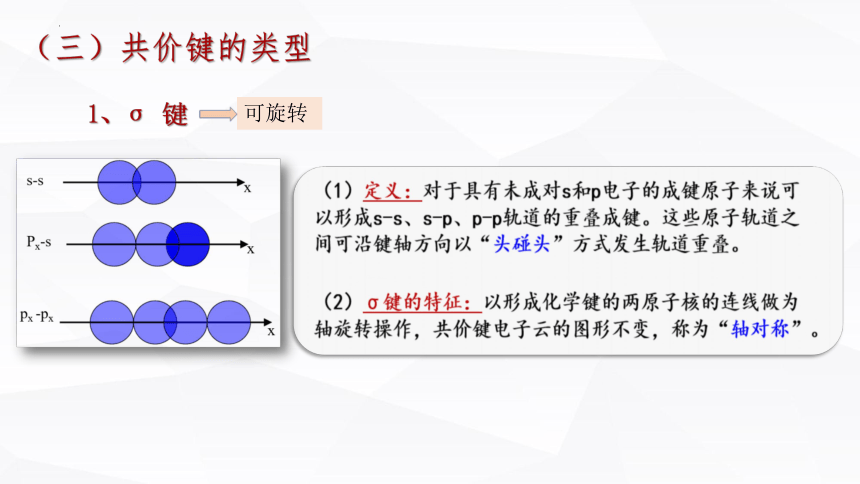
1、σ 键
σ键特征:以形成化学键的两原子核的连线为轴旋转,共价键电子云的图形不变,这种特征称为轴对称。
未成对电子的电子云相互靠拢拢
电子云相互重叠
(2)s-p σ键的形成
(3)p-p σ键的形成
形成共价单键的电子云
(三)共价键的类型
1、σ 键
可旋转
两原子相互接近
电子云重叠
双键的电子云
π键的形成
(三)共价键的类型
2、π 键
不可旋转
1、s电子和s电子、s电子和p电子只能形成σ 键;
p电子和p电子既能形成σ 键,又能形成π 键;
(p电子和p电子先形成σ 键,后能形成π 键)
2、一般规律是:
共价单价是σ 键;
共价双键中一个是σ键,另一个是π键;
共价三键中一个是σ键,另两个是π键。
(四)共价键的特征
1、饱和性
按照价键理论的电子配对原理,一个原子有几个未成对电子,便可以和几个自旋相反的电子配对成键,这就是共价键的“饱和性”。
eg. 1、分别写出下列非金属元素的原子电子配对成键数目
H 、 ⅤA 、ⅥA 、 ⅦA 。
2、为什么不可能有H3、H2Cl、Cl3分子的形成了?
1
2
3
1
(四)共价键的特征
※小结:
电子所在的原子轨道都具有一定的形状,成键原子的电子云尽可能达到最大重叠必须沿一定的方向交盖,所以共价键具有方向性,它决定了分子的空间构型。
2、方向性
N: 1s22s22p3
px1py1pz1
0.9 3.0 2.1 3.0 2.5 3.5
2.1 0.9 1.0
离子
共价
乙烷 乙烯 乙炔
σ键数目 7 5 3
π键数目 0 1 2
气态基态原子形成1mol化学键释放的最低能量这些能量就是化学键的键能,通常取正值。
2.键长:
形成共价键的两个原子之间的核间的平衡距离。
3.键角:
在原子数超过2的分子中,两个共价键之间的夹角称为键角。
常见分子的键角:
CO2:180° H2O:104.5° NH3:107.3° CH4:109°28ˊ P4: 60°
意义:决定了分子的空间构型
来历:共价键的方向性
小结:
等电子体原理
1.等电子体原理:是指原子总数相同,价电子总数相同的分子具有相似的化学键特征,它们的许多性质是相近的。
2.应用:预测分子的空间构型和性质
3.常见的等电子体:
※总结
现代价键理论的要点:2
共价键的形成、本质、分类及特征
σ键和π键
定义、规律、关系
定义、判断、应用
σ键 π键
原子轨道重叠方式 沿键轴方向 头碰头 沿键轴方向平行肩并肩
电子云形状 轴对称,可旋转 镜像对称,不可旋转
原子轨道重叠程度 较大 较小
牢固程度 σ键强度大,不易断裂,不活泼 π键强度较小,容易断裂,活泼
成键判断规律 共价单价是σ 键; 共价双键中一个是σ键,另一个是π键; 共价三键中一个是σ键,另两个是π键。
σ键和π键归纳整理:
§2-1
共价键
人教版高中化学选择性必修二 第二章 分子结构与性质
化学键
离子键
共价键
金属键
阴、阳离子之间通过静电作用形成的化学键。
原子间通过共用电子对形成的化学键。
极性共价键:共用电子对偏向一方
非极性共价键:共用电子对不偏移
电子云轮廓图---原子轨道
思考:如何用电子云和原子轨道的概念来进一步理解共价键呢?
目录
共价键
1
键参数---(键能、键长与键角)
2
等电子原理
3
人教版高中化学选修三 第二章 分子结构与性质
共价键
氢原子形成氢分子的电子云描述
互相靠拢
电子云重叠
形成H2分子
(H-H共价键)
(1)s-s σ键的形成
1、σ 键
σ键特征:以形成化学键的两原子核的连线为轴旋转,共价键电子云的图形不变,这种特征称为轴对称。
未成对电子的电子云相互靠拢拢
电子云相互重叠
(2)s-p σ键的形成
(3)p-p σ键的形成
形成共价单键的电子云
(三)共价键的类型
1、σ 键
可旋转
两原子相互接近
电子云重叠
双键的电子云
π键的形成
(三)共价键的类型
2、π 键
不可旋转
1、s电子和s电子、s电子和p电子只能形成σ 键;
p电子和p电子既能形成σ 键,又能形成π 键;
(p电子和p电子先形成σ 键,后能形成π 键)
2、一般规律是:
共价单价是σ 键;
共价双键中一个是σ键,另一个是π键;
共价三键中一个是σ键,另两个是π键。
(四)共价键的特征
1、饱和性
按照价键理论的电子配对原理,一个原子有几个未成对电子,便可以和几个自旋相反的电子配对成键,这就是共价键的“饱和性”。
eg. 1、分别写出下列非金属元素的原子电子配对成键数目
H 、 ⅤA 、ⅥA 、 ⅦA 。
2、为什么不可能有H3、H2Cl、Cl3分子的形成了?
1
2
3
1
(四)共价键的特征
※小结:
电子所在的原子轨道都具有一定的形状,成键原子的电子云尽可能达到最大重叠必须沿一定的方向交盖,所以共价键具有方向性,它决定了分子的空间构型。
2、方向性
N: 1s22s22p3
px1py1pz1
0.9 3.0 2.1 3.0 2.5 3.5
2.1 0.9 1.0
离子
共价
乙烷 乙烯 乙炔
σ键数目 7 5 3
π键数目 0 1 2
气态基态原子形成1mol化学键释放的最低能量这些能量就是化学键的键能,通常取正值。
2.键长:
形成共价键的两个原子之间的核间的平衡距离。
3.键角:
在原子数超过2的分子中,两个共价键之间的夹角称为键角。
常见分子的键角:
CO2:180° H2O:104.5° NH3:107.3° CH4:109°28ˊ P4: 60°
意义:决定了分子的空间构型
来历:共价键的方向性
小结:
等电子体原理
1.等电子体原理:是指原子总数相同,价电子总数相同的分子具有相似的化学键特征,它们的许多性质是相近的。
2.应用:预测分子的空间构型和性质
3.常见的等电子体:
※总结
现代价键理论的要点:2
共价键的形成、本质、分类及特征
σ键和π键
定义、规律、关系
定义、判断、应用
σ键 π键
原子轨道重叠方式 沿键轴方向 头碰头 沿键轴方向平行肩并肩
电子云形状 轴对称,可旋转 镜像对称,不可旋转
原子轨道重叠程度 较大 较小
牢固程度 σ键强度大,不易断裂,不活泼 π键强度较小,容易断裂,活泼
成键判断规律 共价单价是σ 键; 共价双键中一个是σ键,另一个是π键; 共价三键中一个是σ键,另两个是π键。
σ键和π键归纳整理:
