第4节 常见的碱(第1课时)(课件 19张PPT)
文档属性
| 名称 | 第4节 常见的碱(第1课时)(课件 19张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 4.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-08-02 16:07:59 | ||
图片预览





文档简介
(共19张PPT)
浙教版 九年级上
第4节 常见的碱
(第1课时)
教材解析
【核心概念】
1.物质的结构与性质 结构与功能
【学习内容与要求】
1.4 常见的化合物
认识碱的主要性质和在日常生活生产中的用途
会描述氢氧化钠、氢氧化钙常见化学反应的现象,寻找化学变化的证据
碱的化学性质由溶液中的离子决定
能通过观察和实验,归纳碱的化学性质
创设情境
碱是电离产生的阴离子只有氢氧根离子的化合物。碱有哪些性质?
NaOH = Na+ + OH–
Ca(OH)2= Ca2+ +2OH–
探究实践
1.在2支盛有氢氧化钠溶液的试管里分别滴入几滴紫色石蕊试液、无色酚酞试液。再用pH试纸检验,氢氧化钠溶液能使pH试纸呈什么颜色?记录实验现象。
酚酞试液 紫色石蕊试液 pH试纸
氢氧化钠溶液
实验中的现象说明氢氧化钠具有什么性质?
氢氧化钠溶液能使无色酚酞试液变红、紫色石蕊试液变蓝、pH试纸变蓝。
变红
变蓝
变蓝
2.在2支盛有氢氧化钙溶液的试管里分别滴入几滴紫色石蕊试液、无色酚酞试液。再用pH试纸试验,氢氧化钙溶液能使pH试纸呈什么颜色。记录实验现象。
酚酞试液 紫色石蕊试液 pH试纸
氢氧化钙溶液
实验中的现象说明氢氧化钙具有什么性质?
氢氧化钙溶液能使无色酚酞试液变红、紫色石蕊试液变蓝、pH试纸变蓝。
变红
变蓝
变蓝
探究实践
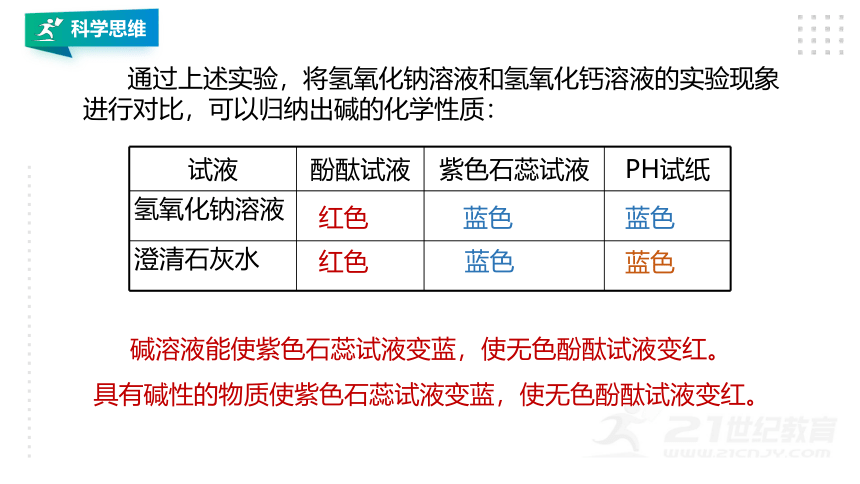
试液 酚酞试液 紫色石蕊试液 PH试纸
氢氧化钠溶液
澄清石灰水
红色
蓝色
红色
蓝色
蓝色
蓝色
通过上述实验,将氢氧化钠溶液和氢氧化钙溶液的实验现象进行对比,可以归纳出碱的化学性质:
碱溶液能使紫色石蕊试液变蓝,使无色酚酞试液变红。
科学思维
具有碱性的物质使紫色石蕊试液变蓝,使无色酚酞试液变红。
探究实践
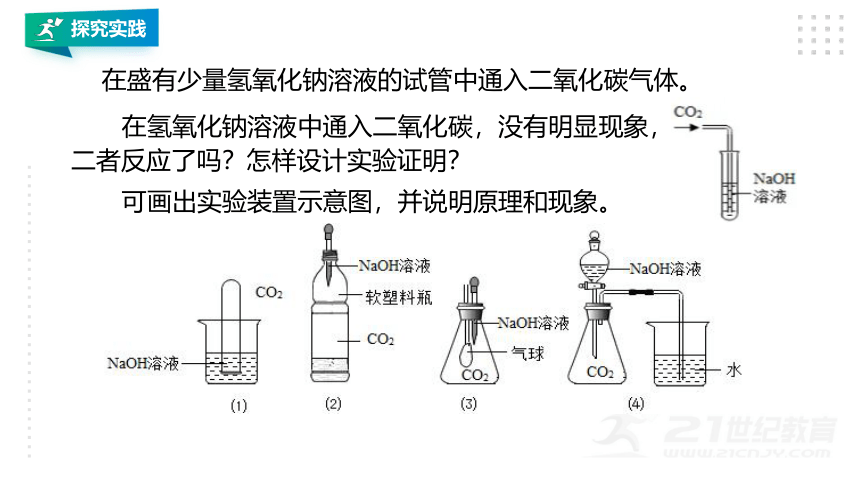
在盛有少量氢氧化钠溶液的试管中通入二氧化碳气体。
在氢氧化钠溶液中通入二氧化碳,没有明显现象,二者反应了吗?怎样设计实验证明?
可画出实验装置示意图,并说明原理和现象。
探究实践
(4)烧杯中的水进入导管。
氢氧化钠能与二氧化碳反应,2NaOH+CO2=Na2CO3+H2O,氢氧化钠溶液吸收二氧化碳使装置内外产生压强差。
原理:
现象:
(1)试管内液面上升;
(2)软塑料瓶变瘪;
(3)锥形瓶中气球胀大;
探究实践
你设计的实验有需要改进吗?并说明理由。
氢氧化钠溶液中含有水,CO2能溶于水,应排除水的干扰。
还需把上述实验中的氢氧化钠溶液换成等体积的水,做对比实验。
验证CO2与氢氧化钠反应,你可能还有实验方案,请课后再设计,并与同学交流。
科学思维
二氧化硫排入大气有何危害?如何除去二氧化硫气体呢?请写出化学方程式。
能污染大气,产生酸雨。
用NaOH溶液吸收。
SO2 + 2NaOH = Na2SO3 +H2O
工业上常用碱溶液来吸收有毒的酸性气体,如:H2S、SO2、HCl。
请写出检验二氧化碳的化学方程式:
CO2 + Ca(OH)2 = CaCO3 ↓+ H2O
CO2、SO2是非金属氧化物, 根据以上反应,归纳出碱的化学性质:
碱+非金属氧化物 → 盐+水
探究实践
1.在 2 支试管中分别注入 2~3 毫升氯化铜溶液和氯化铁溶液,它们各显什么颜色?
2.在上述 2 支试管中分别滴加 1~2 毫升氢氧化钠
溶液,试管中发生了什么变化?
盐溶液 颜色 加入氢氧化钠溶液后的现象 有关化学方程式
氯化铜溶液
氯化铁溶液
蓝色
黄色
产生蓝色絮状沉淀
产生红褐色絮状沉淀
CuCl2 +2NaOH = Cu(OH)2↓+2NaCl
FeCl3 +3NaOH = Fe(OH)3↓+3NaCl
碱 +盐 = 另一种碱 + 另一种盐
探究实践
1.在2支试管中各加入3 mL氢氧化钙溶液,然后分别滴加盐酸和硫酸,如图1-24所示,观察有什么变化发生,写出化学方程式。
实验现象 有关化学方程式
盐酸
硫酸
无明显现象
无明显现象
Ca(OH)2+2HCl=CaCl2+2H2O
Ca(OH)2+H2SO4=CaSO4+2H2O
氢氧化钙能与酸反应
实验现象 有关化学方程式
碳酸钠溶液
氯化铁溶液
2.在另2支试管中各加入3 mL氢氧化钙溶液,然后分别滴加数滴碳酸钠溶液和氯化铁溶液,如图1-24所示,观察有什么变化发生,写出化学方程式。
产生白色沉淀
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
产生红褐色沉淀
3Ca(OH)2+2FeCl3=2Fe(OH)3↓+3CaCl2
Na2CO3、FeCl3是由金属阳离子和酸根离子构成的,属于盐。
氢氧化钙能与盐反应。
碱+盐 →另一种碱 + 另一种盐
探究实践
碱有哪些相似的化学性质--碱的通性?为什么具有相似的化学性质?
1.能使指示剂变色
使紫色的石蕊试液变蓝色,使无色的酚酞试液变红色。
2.碱+非金属氧化物=盐+水。
3.碱 +盐 = 新碱 + 新盐
4.碱 +酸 = 盐 + 水
可溶性碱,
溶液都含有氢氧根离子
碱与酸的反应,碱溶液和固体都符合
科学思维
课堂反思
1.吸收CO2用氢氧化钠溶液而不用石灰水,检验CO2用澄清石灰水而不用氢氧化钠溶液?
氢氧化钠极易溶于水,氢氧化钙微溶于水,等质量的氢氧化钠溶液和氢氧化钙溶液,氢氧化钠溶液吸收CO2多。
CO2与氢氧化钙反应会产生白色沉淀,而CO2与氢氧化钠反应物明显实验现象。
2.氢氧化钠与稀盐酸反应没有明显的现象,实验时有的氢氧化钠溶液中加入过量的稀盐酸,会发现产生气泡,这是为什么?
氢氧化钠吸收了空气中的CO2而变质成了Na2CO3,Na2CO3与盐酸反应产生了CO2。
迁移应用
1.下列各溶液中能跟石灰水反应,但没有明显现象的是( )
A. 盐酸 B. 氯化铁溶液 C. 硫酸铜溶液 D. 酚酞溶液
A
2.下列关于氢氧化钡性质的描述中,不属于碱的共同性质的是( )
A.能使紫色石蕊溶液变蓝色 B.能与盐酸反应生成水
C.能与Na2CO3溶液反应生成沉淀 D.能与CO2反应生成水
C
板书设计
第4节 常见的碱
第1课时 碱的通性
碱溶液使紫色石蕊变蓝,使无色酚酞变红
碱+非金属氧化物
2NaOH+CO2 =Na2CO3+H2O
2NaOH+SO2 = Na2SO3 +H2O
Ca(OH)2 +CO2= CaCO3 ↓+ H2O
Ca(OH)2+2HCl=CaCl2+2H2O
Ca(OH)2+H2SO4=CaSO4+2H2O
碱+酸
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
3Ca(OH)2+2FeCl3=2Fe(OH)3↓+3CaCl2
碱+酸
可溶性碱,OH-决定
https://www.21cnjy.com/help/help_extract.php
浙教版 九年级上
第4节 常见的碱
(第1课时)
教材解析
【核心概念】
1.物质的结构与性质 结构与功能
【学习内容与要求】
1.4 常见的化合物
认识碱的主要性质和在日常生活生产中的用途
会描述氢氧化钠、氢氧化钙常见化学反应的现象,寻找化学变化的证据
碱的化学性质由溶液中的离子决定
能通过观察和实验,归纳碱的化学性质
创设情境
碱是电离产生的阴离子只有氢氧根离子的化合物。碱有哪些性质?
NaOH = Na+ + OH–
Ca(OH)2= Ca2+ +2OH–
探究实践
1.在2支盛有氢氧化钠溶液的试管里分别滴入几滴紫色石蕊试液、无色酚酞试液。再用pH试纸检验,氢氧化钠溶液能使pH试纸呈什么颜色?记录实验现象。
酚酞试液 紫色石蕊试液 pH试纸
氢氧化钠溶液
实验中的现象说明氢氧化钠具有什么性质?
氢氧化钠溶液能使无色酚酞试液变红、紫色石蕊试液变蓝、pH试纸变蓝。
变红
变蓝
变蓝
2.在2支盛有氢氧化钙溶液的试管里分别滴入几滴紫色石蕊试液、无色酚酞试液。再用pH试纸试验,氢氧化钙溶液能使pH试纸呈什么颜色。记录实验现象。
酚酞试液 紫色石蕊试液 pH试纸
氢氧化钙溶液
实验中的现象说明氢氧化钙具有什么性质?
氢氧化钙溶液能使无色酚酞试液变红、紫色石蕊试液变蓝、pH试纸变蓝。
变红
变蓝
变蓝
探究实践
试液 酚酞试液 紫色石蕊试液 PH试纸
氢氧化钠溶液
澄清石灰水
红色
蓝色
红色
蓝色
蓝色
蓝色
通过上述实验,将氢氧化钠溶液和氢氧化钙溶液的实验现象进行对比,可以归纳出碱的化学性质:
碱溶液能使紫色石蕊试液变蓝,使无色酚酞试液变红。
科学思维
具有碱性的物质使紫色石蕊试液变蓝,使无色酚酞试液变红。
探究实践
在盛有少量氢氧化钠溶液的试管中通入二氧化碳气体。
在氢氧化钠溶液中通入二氧化碳,没有明显现象,二者反应了吗?怎样设计实验证明?
可画出实验装置示意图,并说明原理和现象。
探究实践
(4)烧杯中的水进入导管。
氢氧化钠能与二氧化碳反应,2NaOH+CO2=Na2CO3+H2O,氢氧化钠溶液吸收二氧化碳使装置内外产生压强差。
原理:
现象:
(1)试管内液面上升;
(2)软塑料瓶变瘪;
(3)锥形瓶中气球胀大;
探究实践
你设计的实验有需要改进吗?并说明理由。
氢氧化钠溶液中含有水,CO2能溶于水,应排除水的干扰。
还需把上述实验中的氢氧化钠溶液换成等体积的水,做对比实验。
验证CO2与氢氧化钠反应,你可能还有实验方案,请课后再设计,并与同学交流。
科学思维
二氧化硫排入大气有何危害?如何除去二氧化硫气体呢?请写出化学方程式。
能污染大气,产生酸雨。
用NaOH溶液吸收。
SO2 + 2NaOH = Na2SO3 +H2O
工业上常用碱溶液来吸收有毒的酸性气体,如:H2S、SO2、HCl。
请写出检验二氧化碳的化学方程式:
CO2 + Ca(OH)2 = CaCO3 ↓+ H2O
CO2、SO2是非金属氧化物, 根据以上反应,归纳出碱的化学性质:
碱+非金属氧化物 → 盐+水
探究实践
1.在 2 支试管中分别注入 2~3 毫升氯化铜溶液和氯化铁溶液,它们各显什么颜色?
2.在上述 2 支试管中分别滴加 1~2 毫升氢氧化钠
溶液,试管中发生了什么变化?
盐溶液 颜色 加入氢氧化钠溶液后的现象 有关化学方程式
氯化铜溶液
氯化铁溶液
蓝色
黄色
产生蓝色絮状沉淀
产生红褐色絮状沉淀
CuCl2 +2NaOH = Cu(OH)2↓+2NaCl
FeCl3 +3NaOH = Fe(OH)3↓+3NaCl
碱 +盐 = 另一种碱 + 另一种盐
探究实践
1.在2支试管中各加入3 mL氢氧化钙溶液,然后分别滴加盐酸和硫酸,如图1-24所示,观察有什么变化发生,写出化学方程式。
实验现象 有关化学方程式
盐酸
硫酸
无明显现象
无明显现象
Ca(OH)2+2HCl=CaCl2+2H2O
Ca(OH)2+H2SO4=CaSO4+2H2O
氢氧化钙能与酸反应
实验现象 有关化学方程式
碳酸钠溶液
氯化铁溶液
2.在另2支试管中各加入3 mL氢氧化钙溶液,然后分别滴加数滴碳酸钠溶液和氯化铁溶液,如图1-24所示,观察有什么变化发生,写出化学方程式。
产生白色沉淀
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
产生红褐色沉淀
3Ca(OH)2+2FeCl3=2Fe(OH)3↓+3CaCl2
Na2CO3、FeCl3是由金属阳离子和酸根离子构成的,属于盐。
氢氧化钙能与盐反应。
碱+盐 →另一种碱 + 另一种盐
探究实践
碱有哪些相似的化学性质--碱的通性?为什么具有相似的化学性质?
1.能使指示剂变色
使紫色的石蕊试液变蓝色,使无色的酚酞试液变红色。
2.碱+非金属氧化物=盐+水。
3.碱 +盐 = 新碱 + 新盐
4.碱 +酸 = 盐 + 水
可溶性碱,
溶液都含有氢氧根离子
碱与酸的反应,碱溶液和固体都符合
科学思维
课堂反思
1.吸收CO2用氢氧化钠溶液而不用石灰水,检验CO2用澄清石灰水而不用氢氧化钠溶液?
氢氧化钠极易溶于水,氢氧化钙微溶于水,等质量的氢氧化钠溶液和氢氧化钙溶液,氢氧化钠溶液吸收CO2多。
CO2与氢氧化钙反应会产生白色沉淀,而CO2与氢氧化钠反应物明显实验现象。
2.氢氧化钠与稀盐酸反应没有明显的现象,实验时有的氢氧化钠溶液中加入过量的稀盐酸,会发现产生气泡,这是为什么?
氢氧化钠吸收了空气中的CO2而变质成了Na2CO3,Na2CO3与盐酸反应产生了CO2。
迁移应用
1.下列各溶液中能跟石灰水反应,但没有明显现象的是( )
A. 盐酸 B. 氯化铁溶液 C. 硫酸铜溶液 D. 酚酞溶液
A
2.下列关于氢氧化钡性质的描述中,不属于碱的共同性质的是( )
A.能使紫色石蕊溶液变蓝色 B.能与盐酸反应生成水
C.能与Na2CO3溶液反应生成沉淀 D.能与CO2反应生成水
C
板书设计
第4节 常见的碱
第1课时 碱的通性
碱溶液使紫色石蕊变蓝,使无色酚酞变红
碱+非金属氧化物
2NaOH+CO2 =Na2CO3+H2O
2NaOH+SO2 = Na2SO3 +H2O
Ca(OH)2 +CO2= CaCO3 ↓+ H2O
Ca(OH)2+2HCl=CaCl2+2H2O
Ca(OH)2+H2SO4=CaSO4+2H2O
碱+酸
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
3Ca(OH)2+2FeCl3=2Fe(OH)3↓+3CaCl2
碱+酸
可溶性碱,OH-决定
https://www.21cnjy.com/help/help_extract.php
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
