化学人教版(2019)选择性必修1 1.1.3 从家用燃料到火箭推进剂的选择 课件(共15张PPT)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 1.1.3 从家用燃料到火箭推进剂的选择 课件(共15张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-02 00:00:00 | ||
图片预览




文档简介
(共15张PPT)
第3课时 从家用燃料到火箭推进剂的选择
第一章 化学反应的热效应
第一节 反应热
学习目标
1、理解燃烧热的概念;
2、了解家用燃料和火箭推进剂燃料的选择
核心素养
学生从诸多因素出发讨论选择燃料的标准,从而能够综合分析问题
教学环节一 复习巩固,表征反应热
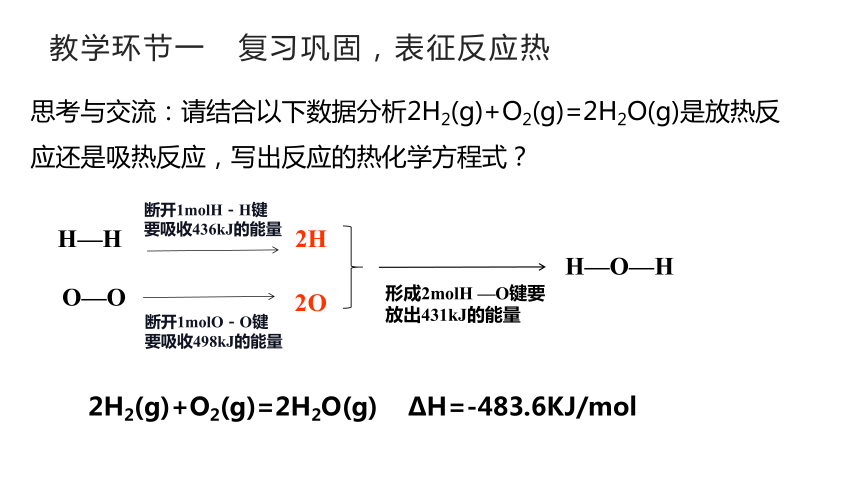
思考与交流:请结合以下数据分析2H2(g)+O2(g)=2H2O(g)是放热反应还是吸热反应,写出反应的热化学方程式?
H—H
2H
断开1molH-H键
要吸收436kJ的能量
O—O
2O
断开1molO-O键
要吸收498kJ的能量
H—O—H
形成2molH —O键要
放出431kJ的能量
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6KJ/mol
柴草
煤
液化石油气
天然气
教学环节二 学习新知,认识燃烧热
问题:你会选择哪种家用燃料,选择的依据是什么?
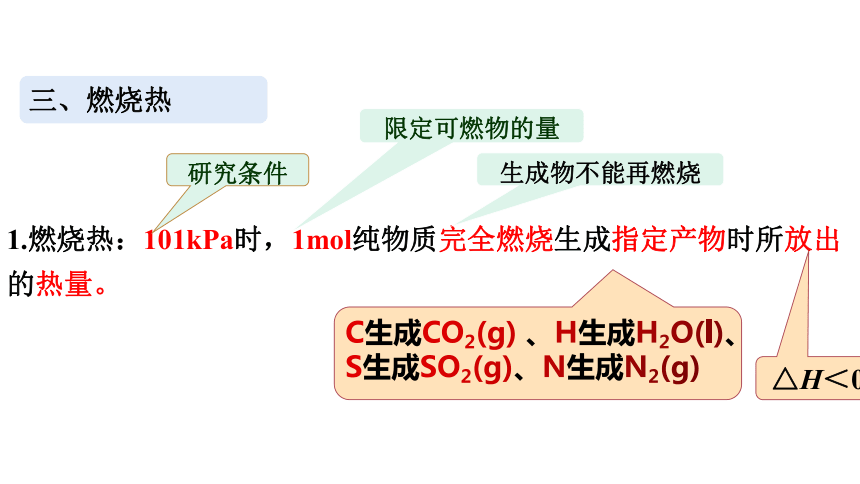
1.燃烧热:101kPa时,1mol纯物质完全燃烧生成指定产物时所放出的热量。
研究条件
限定可燃物的量
生成物不能再燃烧
C生成CO2(g) 、H生成H2O(l)、
S生成SO2(g)、N生成N2(g)
三、燃烧热
△H<0
1、分析以下几个热化学方程式,哪一个表示H2燃烧热的热化学方程式?(1)H2(g)+ O2(g)=H2O(g) H=- 241.8kJ/mol
(2)H2(g)+ O2(g)=H2O(l) H =- 285.8kJ/mol
(3)2H2(g)+O2(g)=2H2O(l) H=- 571.6kJ/mol
(2)
强调燃烧热规定了可燃物的物质的量为1mol,其热化学方程式应
以1mol可燃物为标准来配平其余物质的化学计量数(故常出现分数)
H2的燃烧热为285.8kJ/mol
文字表示: 在25℃ 101kPa时,1molH2完全燃烧生成1molH2O放出285.8kJ的热量
用符号表示为:△H =-285.8kJ/mol
(1)1 mol 甲烷在氧气中完全燃烧释放的能量为890 kJ
(2)28 g CO在氧气中燃烧生成CO2(g)释放的能量为283 kJ
CH4(g)+ 2O2(g) = CO2(g) + 2H2O(l) △H = – 890 kJ/mol
CO(g)+O2(g)= CO2(g) △H = – 283 kJ/mol
课堂练习2:书写表示下列燃料燃烧热的热化学方程式
柴草
煤
液化石油气
天然气
教学环节三 迁移应用,选择燃料
问题:你会选择哪种家用燃料?
名称 化学式 ΔH/kJ/mol 名称 化学式 ΔH/kJ/mol
石墨 C(s) 393.5 乙烷 C2H6(g) 1559.8
金刚石 C(s) 395.0 乙烯 C2H4(g) 1411.0
氢气 H2(g) 285.8 乙炔 C2H2(g) 1299.6
一氧化碳 CO(g) 283.0 乙醇 C2H5OH(l) 1366.8
甲烷 CH4(g) 890.31 丙烷 C3H8(g) 2219.9
甲醇 CH3OH(l) 726.51 苯 C6H6(l) 3267.5
某些物质的燃烧热(25 oC,101 kPa)
H2(g) + O2(g) H2O(l) H= 285.8 kJ/mol
1
2
CO(g) + O2(g) CO2 (g) H= 283 kJ/mol
CH4(g)+ 2O2(g) = CO2(g) + 2H2O(l) △H = – 890 kJ/mol
液氢-液氧
长征五号推进剂
煤油-液氧
思考与交流:长征五号火箭推进剂为什么选择液氢而不用CO呢?
火箭推进剂的发展主要着眼于能量高、排烟少、污染轻三个方面。
单位质量产生热量: ≈ 13.2 kJ/g
237.5 kJ
2 g+16 g
火箭推进剂燃料的选择
H2(l) + 1/2O2(l) === H2O(g) H= 237.5 kJ/mol
CO(g) + 1/2O2(g)===CO2 (g) H= 283 kJ/mol
单位质量产生热量: ≈ 6.4 kJ/g
283 kJ
28 g+16 g
火箭荷载的绝大部分质量来自于推进剂,产生同样推力所需要的推进剂质量越小,火箭的荷载就越低。计算每克液氢-液氧推进剂恰好完全反应释放的热量。
常见火箭推进剂
液氢-液氧 偏二甲肼- 四氧化二氮 煤油-液氧 甲烷-液氧
优点 环境友好 高能无毒 来源广泛 常温燃料 运输简单 耐冲击、耐摩擦 成本低廉 无毒无害 无毒无害
不易结焦积碳
缺点 价格较高 低温贮存较难 燃料占空间大 有毒性 有腐蚀性 污染环境 液氧需低温贮存 燃烧易结焦积碳 脱硫成本高
低温贮存
燃料占空间大
1.火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水,当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4 mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256 kJ的热量。
(1)写出该反应的热化学方程式:__________________________________
____________________。
应用体验
N2H4(l)+2H2O2(l)===N2(g)+4H2O(g)
ΔH=-640 kJ·mol-1
(2)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是______________________。
产物不会造成环境污染
2.(1)已知肼(N2H4)是一种高能燃料,将16 g气态肼在氧气中燃烧,生成氮气和水蒸气,放出267 kJ热量,试写出该反应的热化学方程式:___________________________________________________。
(2)试用化学反应能量图表示该反应过程中能量的变化。
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
答案
教学环节四 梳理总结,建构模型
反应热
特例
燃烧热
概念:①101kPa,1mol纯物质
②完全燃烧生成指定产物
应用:①选择家用燃料
②选择火箭推进剂
第3课时 从家用燃料到火箭推进剂的选择
第一章 化学反应的热效应
第一节 反应热
学习目标
1、理解燃烧热的概念;
2、了解家用燃料和火箭推进剂燃料的选择
核心素养
学生从诸多因素出发讨论选择燃料的标准,从而能够综合分析问题
教学环节一 复习巩固,表征反应热
思考与交流:请结合以下数据分析2H2(g)+O2(g)=2H2O(g)是放热反应还是吸热反应,写出反应的热化学方程式?
H—H
2H
断开1molH-H键
要吸收436kJ的能量
O—O
2O
断开1molO-O键
要吸收498kJ的能量
H—O—H
形成2molH —O键要
放出431kJ的能量
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6KJ/mol
柴草
煤
液化石油气
天然气
教学环节二 学习新知,认识燃烧热
问题:你会选择哪种家用燃料,选择的依据是什么?
1.燃烧热:101kPa时,1mol纯物质完全燃烧生成指定产物时所放出的热量。
研究条件
限定可燃物的量
生成物不能再燃烧
C生成CO2(g) 、H生成H2O(l)、
S生成SO2(g)、N生成N2(g)
三、燃烧热
△H<0
1、分析以下几个热化学方程式,哪一个表示H2燃烧热的热化学方程式?(1)H2(g)+ O2(g)=H2O(g) H=- 241.8kJ/mol
(2)H2(g)+ O2(g)=H2O(l) H =- 285.8kJ/mol
(3)2H2(g)+O2(g)=2H2O(l) H=- 571.6kJ/mol
(2)
强调燃烧热规定了可燃物的物质的量为1mol,其热化学方程式应
以1mol可燃物为标准来配平其余物质的化学计量数(故常出现分数)
H2的燃烧热为285.8kJ/mol
文字表示: 在25℃ 101kPa时,1molH2完全燃烧生成1molH2O放出285.8kJ的热量
用符号表示为:△H =-285.8kJ/mol
(1)1 mol 甲烷在氧气中完全燃烧释放的能量为890 kJ
(2)28 g CO在氧气中燃烧生成CO2(g)释放的能量为283 kJ
CH4(g)+ 2O2(g) = CO2(g) + 2H2O(l) △H = – 890 kJ/mol
CO(g)+O2(g)= CO2(g) △H = – 283 kJ/mol
课堂练习2:书写表示下列燃料燃烧热的热化学方程式
柴草
煤
液化石油气
天然气
教学环节三 迁移应用,选择燃料
问题:你会选择哪种家用燃料?
名称 化学式 ΔH/kJ/mol 名称 化学式 ΔH/kJ/mol
石墨 C(s) 393.5 乙烷 C2H6(g) 1559.8
金刚石 C(s) 395.0 乙烯 C2H4(g) 1411.0
氢气 H2(g) 285.8 乙炔 C2H2(g) 1299.6
一氧化碳 CO(g) 283.0 乙醇 C2H5OH(l) 1366.8
甲烷 CH4(g) 890.31 丙烷 C3H8(g) 2219.9
甲醇 CH3OH(l) 726.51 苯 C6H6(l) 3267.5
某些物质的燃烧热(25 oC,101 kPa)
H2(g) + O2(g) H2O(l) H= 285.8 kJ/mol
1
2
CO(g) + O2(g) CO2 (g) H= 283 kJ/mol
CH4(g)+ 2O2(g) = CO2(g) + 2H2O(l) △H = – 890 kJ/mol
液氢-液氧
长征五号推进剂
煤油-液氧
思考与交流:长征五号火箭推进剂为什么选择液氢而不用CO呢?
火箭推进剂的发展主要着眼于能量高、排烟少、污染轻三个方面。
单位质量产生热量: ≈ 13.2 kJ/g
237.5 kJ
2 g+16 g
火箭推进剂燃料的选择
H2(l) + 1/2O2(l) === H2O(g) H= 237.5 kJ/mol
CO(g) + 1/2O2(g)===CO2 (g) H= 283 kJ/mol
单位质量产生热量: ≈ 6.4 kJ/g
283 kJ
28 g+16 g
火箭荷载的绝大部分质量来自于推进剂,产生同样推力所需要的推进剂质量越小,火箭的荷载就越低。计算每克液氢-液氧推进剂恰好完全反应释放的热量。
常见火箭推进剂
液氢-液氧 偏二甲肼- 四氧化二氮 煤油-液氧 甲烷-液氧
优点 环境友好 高能无毒 来源广泛 常温燃料 运输简单 耐冲击、耐摩擦 成本低廉 无毒无害 无毒无害
不易结焦积碳
缺点 价格较高 低温贮存较难 燃料占空间大 有毒性 有腐蚀性 污染环境 液氧需低温贮存 燃烧易结焦积碳 脱硫成本高
低温贮存
燃料占空间大
1.火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水,当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4 mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256 kJ的热量。
(1)写出该反应的热化学方程式:__________________________________
____________________。
应用体验
N2H4(l)+2H2O2(l)===N2(g)+4H2O(g)
ΔH=-640 kJ·mol-1
(2)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是______________________。
产物不会造成环境污染
2.(1)已知肼(N2H4)是一种高能燃料,将16 g气态肼在氧气中燃烧,生成氮气和水蒸气,放出267 kJ热量,试写出该反应的热化学方程式:___________________________________________________。
(2)试用化学反应能量图表示该反应过程中能量的变化。
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
答案
教学环节四 梳理总结,建构模型
反应热
特例
燃烧热
概念:①101kPa,1mol纯物质
②完全燃烧生成指定产物
应用:①选择家用燃料
②选择火箭推进剂
