化学人教版(2019)必修第一册2.3物质的量 (共23张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.3物质的量 (共23张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-02 21:04:49 | ||
图片预览





文档简介
(共23张PPT)
第三节 物质的量
第二章海水中的重要元素——钠和氯
第一课时物质的量、阿伏加德罗常数
目录
CONTENT
一、物质的量、阿伏加德罗常数
二、摩尔质量
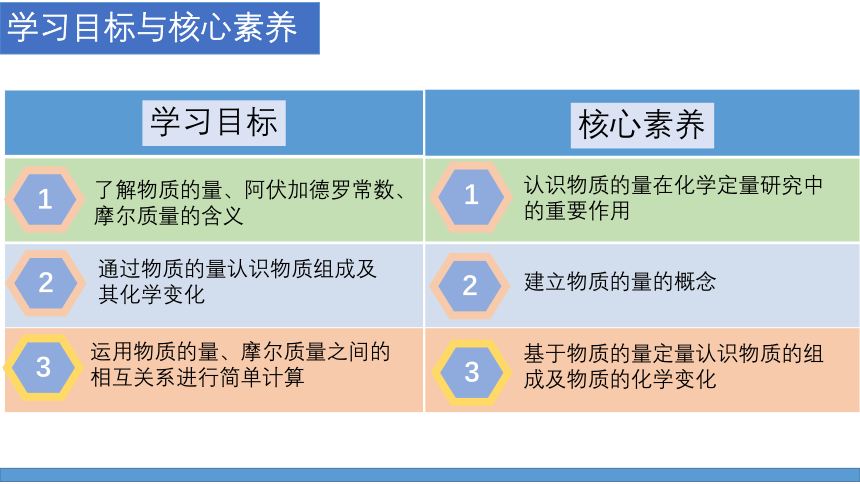
学习目标与核心素养
学习目标
核心素养
1
1
2
2
3
3
了解物质的量、阿伏加德罗常数、摩尔质量的含义
通过物质的量认识物质组成及其化学变化
运用物质的量、摩尔质量之间的相互关系进行简单计算
认识物质的量在化学定量研究中的重要作用
建立物质的量的概念
基于物质的量定量认识物质的组成及物质的化学变化
质 量: 4 g 32 g 36g
宏观质量
微观个数
分子数: 2个 1个 2个
物质可以称量,微观粒子是难以称量的,那么,对反应进行定量研究时,可称量的物质与难以称量的物质之间有什么联系呢?一杯水(180g)的水中含有水分子数目是多少?
【提出问题】
化学反应中各物质之间的关系:
课前导入
数大米
思考与交流:现有一大包大米,如何可以快速估测这包大米中米粒的数目?
米粒数目(N)= (大包米的总质量÷100颗大米的质量)×10
方案:先称取100颗大米的质量,再称取大包米的总质量。
打开袋子核查米粒数目,与你的计算是否相符合?解释原因。
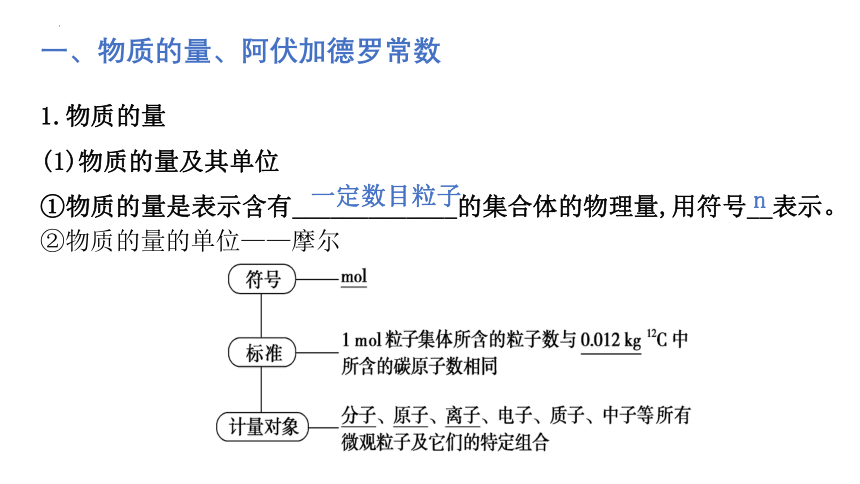
1.物质的量
(1)物质的量及其单位
①物质的量是表示含有_____________的集合体的物理量,用符号__表示。
一、物质的量、阿伏加德罗常数
一定数目粒子
n
②物质的量的单位——摩尔
【想一想】
1 mol H、1 mol H+、1 mol H2的含义一样吗 为什么 能说1 mol大米吗
提示:意义不同;尽管都是1摩尔微粒,但微粒种类不同,它们分别表示1摩尔氢原子、1摩尔氢离子和1摩尔氢分子;mol后面只能是分子、原子等微观粒子,不能是大米、桌子等宏观物质。
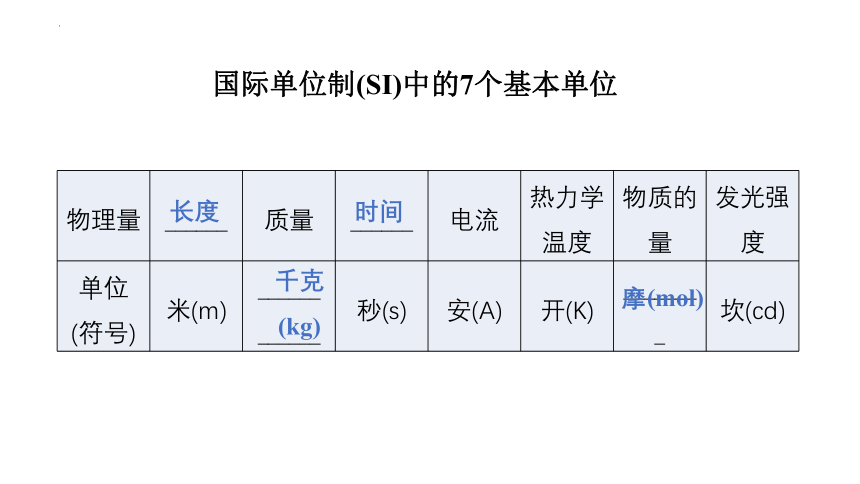
物理量 ______ 质量 ______ 电流 热力学温度 物质的量 发光强度
单位 (符号) 米(m) ______ ______ 秒(s) 安(A) 开(K) ________ 坎(cd)
国际单位制(SI)中的7个基本单位
千克
(kg)
长度
时间
摩(mol)
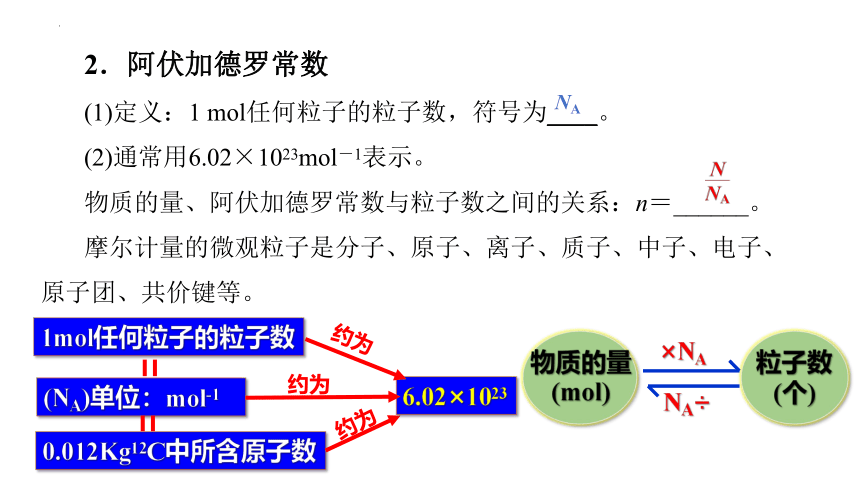
2.阿伏加德罗常数
(1)定义:1 mol任何粒子的粒子数,符号为____。
(2)通常用6.02×1023mol-1表示。
物质的量、阿伏加德罗常数与粒子数之间的关系:n=______。
摩尔计量的微观粒子是分子、原子、离子、质子、中子、电子、原子团、共价键等。
NA
1mol任何粒子的粒子数
0.012Kg12C中所含原子数
(NA)单位:mol-1
6.02×1023
约为
约为
约为
粒子数
(个)
物质的量
(mol)
×NA
NA÷
填空
①1molH2SO4中含有———个硫酸分子,约含有__________个硫酸分子
②2molH2O中含有水分子———————————— 个
③0.5molO2中含有氧分子————————————个
④1molC2H5OH中含有———个酒精分子,—个氢原子,——个氧原子
粒子数(N)、阿伏加德罗常数(NA)、物质的量(n)之间的关系:
n=
N
NA
变式:
N=n×NA
符号: M 单位:g· mol-1 或 kg· mol-1
二、摩尔质量
1、概念:单位物质的量的物质所具有的质量。
2、数值:等于该物质的式量或相对原子质量
3、公式:
m = M × n
g g/mol mol
1mol O2的质量是( )
O2的摩尔质量是( )
O2的相对分子质量是( )
32 g
32
32 g/mol
质量
(g)
物质的量
(mol)
×M
M÷
思考:1)微粒的摩尔质量就是1 mol 该微粒的质量,这种说法对吗 为什么
提示:不对。摩尔质量的单位是g·mol-1,物质的质量单位是g,二者的意义不同。
结论:两者含义、单位不相同。
如:镁的相对原子质量为24,摩尔质量为24g/mol。
已知条件 公式
任意状态的任意物质 M=(定义式)
已知一个分子或原子的质量 M=m(分子或原子)×NA
摩尔质量的计算方法
n=
m
M
m=n×M
变式:
物质的量(n)、质量(m)、摩尔质量(M)之间的关系
1.物质的量是表示微粒数目多少的物理量( )
2.2 mol H2O的摩尔质量是1 mol H2O的摩尔质量的2倍( )
3.1 mol O2的质量与它的相对分子质量相等( )
4.12 g 12C中所含碳原子的数目约为6.02×1023( )
5.1 mol OH-的质量为17 g·mol-1( )
小组讨论
概念 应用注意事项
物质的量 “物质的量”四个字是一个整体,不能拆开,也不能添字,如不能说成“物质量”或“物质的数量”等
摩尔 只用来描述微观粒子,如原子、分子、离子、中子、质子、电子等,也可以是特定组合,如1 mol NaCl
注意事项
阿伏加德罗常数 (1)NA的标准是0.012 kg 12C中的碳原子个数。
(2)NA是一个实验值,现阶段常取6.02×1023作计算
摩尔质量 (1)适用于任何一种微观粒子。
(2)纯净物和混合物都有摩尔质量,混合物的摩尔质量一般称为平均摩尔质量
1.基本关系式
(1)n= (n表示物质的量,N表示粒子数)。关系式中NA的单位是mol-1。
(2)M= (M为摩尔质量,m为物质的质量)。在M、n和m中,已知任意两项求第三项;若M的单位是g·mol-1时,则m的单位是g。
物质的量、物质的质量、粒子数目之间的关系
2.恒等关系式
由n= 和n= 。可得恒等关系式: =n= 。
在N、NA、m、M中,已知任意三项可求第四项。一般情况下,NA、M是已知的,则N与m可互求。
3.摩尔质量的计算方法
(1)已知任意状态物质的质量时:M= (定义式)。
(2)已知一个分子的质量时:M=m(分子)×NA。
(3)已知一个分子的质量和一个12C原子的质量时:
M= ×12 g·mol-1
注意:在数值上,摩尔质量=相对原子质量(相对分子质量)=1 mol 该物质的质量(摩尔质量以g/mol,质量以g为单位时)。
1.204×1024个CH4的质量是多少?
【分析】依据物质的量计算宏观质量和微观粒子,已知粒子数,求质量,应先求物质的量。
n(CH4)=
N(CH4)
NA
=2mol
=
1.204×1024
6.02×1023mol-1
m(CH4)=2mol×16g/mol=32g
课堂总结
一.物质的量
符号:n
单位:摩尔,简称摩,符号为 mol
描述对象:分子、原子、质子等微观粒子,不能用于宏观颗粒
表示微观粒子个数多少的物理量,是国际单位制基本物理量之一
二.阿伏加德罗常数
NA近似值:6.02×1023mol-1
1mol任何粒子集体含有NA个粒子;
n =
N
NA
N =
n×
NA
或
三.摩尔质量:单位物质的量的物质所具有的质量。
数值上等于其相对分子质量(式量)
n =
m
M
m =
n×
M
或
1.下列说法正确的是( )
A.氧气的摩尔质量是32g B.1molCO2的质量为44g·mol-1
C.O2的摩尔质量(单位是g·mol-1)在数值上等于其相对分子质量
D.不同物质的摩尔质量一定不同
2.下列说法正确的是( )
A.16gO2所含的分子数约为6.02×1023
B.0.5molHNO3含有的原子数目为2.5NA
C.18gH2O中原子的物质的量为1mol
D.22g物质A中含有的分子数约为3.01×1023,则A的摩尔质量为44g
当堂训练
3.下列各组物质中所含氧原子的物质的量相同的是( )
A.0.3 mol O2和0.3 mol H2O
B.6.02×1023个CO2与0.1 mol KMnO4
C.0.1 mol CuSO4·5H2O和0.1 mol C6H12O6
D.0.1 mol H2SO4和0.4NA个H2O
4.在下面的横线上填上适当的内容。
(1)6.02×1024个Na+约含_________ mol Na+,其质量为_________ g。
(2)4.5 mol CH4约含有_________个CH4分子,其质量为_________ g。
(3)3.01×1023个SO 约含__________ mol SO ,其质量为_________ g;49 g H2SO4约含有__________个H原子,共含有__________个原子。
谢谢
第三节 物质的量
第二章海水中的重要元素——钠和氯
第一课时物质的量、阿伏加德罗常数
目录
CONTENT
一、物质的量、阿伏加德罗常数
二、摩尔质量
学习目标与核心素养
学习目标
核心素养
1
1
2
2
3
3
了解物质的量、阿伏加德罗常数、摩尔质量的含义
通过物质的量认识物质组成及其化学变化
运用物质的量、摩尔质量之间的相互关系进行简单计算
认识物质的量在化学定量研究中的重要作用
建立物质的量的概念
基于物质的量定量认识物质的组成及物质的化学变化
质 量: 4 g 32 g 36g
宏观质量
微观个数
分子数: 2个 1个 2个
物质可以称量,微观粒子是难以称量的,那么,对反应进行定量研究时,可称量的物质与难以称量的物质之间有什么联系呢?一杯水(180g)的水中含有水分子数目是多少?
【提出问题】
化学反应中各物质之间的关系:
课前导入
数大米
思考与交流:现有一大包大米,如何可以快速估测这包大米中米粒的数目?
米粒数目(N)= (大包米的总质量÷100颗大米的质量)×10
方案:先称取100颗大米的质量,再称取大包米的总质量。
打开袋子核查米粒数目,与你的计算是否相符合?解释原因。
1.物质的量
(1)物质的量及其单位
①物质的量是表示含有_____________的集合体的物理量,用符号__表示。
一、物质的量、阿伏加德罗常数
一定数目粒子
n
②物质的量的单位——摩尔
【想一想】
1 mol H、1 mol H+、1 mol H2的含义一样吗 为什么 能说1 mol大米吗
提示:意义不同;尽管都是1摩尔微粒,但微粒种类不同,它们分别表示1摩尔氢原子、1摩尔氢离子和1摩尔氢分子;mol后面只能是分子、原子等微观粒子,不能是大米、桌子等宏观物质。
物理量 ______ 质量 ______ 电流 热力学温度 物质的量 发光强度
单位 (符号) 米(m) ______ ______ 秒(s) 安(A) 开(K) ________ 坎(cd)
国际单位制(SI)中的7个基本单位
千克
(kg)
长度
时间
摩(mol)
2.阿伏加德罗常数
(1)定义:1 mol任何粒子的粒子数,符号为____。
(2)通常用6.02×1023mol-1表示。
物质的量、阿伏加德罗常数与粒子数之间的关系:n=______。
摩尔计量的微观粒子是分子、原子、离子、质子、中子、电子、原子团、共价键等。
NA
1mol任何粒子的粒子数
0.012Kg12C中所含原子数
(NA)单位:mol-1
6.02×1023
约为
约为
约为
粒子数
(个)
物质的量
(mol)
×NA
NA÷
填空
①1molH2SO4中含有———个硫酸分子,约含有__________个硫酸分子
②2molH2O中含有水分子———————————— 个
③0.5molO2中含有氧分子————————————个
④1molC2H5OH中含有———个酒精分子,—个氢原子,——个氧原子
粒子数(N)、阿伏加德罗常数(NA)、物质的量(n)之间的关系:
n=
N
NA
变式:
N=n×NA
符号: M 单位:g· mol-1 或 kg· mol-1
二、摩尔质量
1、概念:单位物质的量的物质所具有的质量。
2、数值:等于该物质的式量或相对原子质量
3、公式:
m = M × n
g g/mol mol
1mol O2的质量是( )
O2的摩尔质量是( )
O2的相对分子质量是( )
32 g
32
32 g/mol
质量
(g)
物质的量
(mol)
×M
M÷
思考:1)微粒的摩尔质量就是1 mol 该微粒的质量,这种说法对吗 为什么
提示:不对。摩尔质量的单位是g·mol-1,物质的质量单位是g,二者的意义不同。
结论:两者含义、单位不相同。
如:镁的相对原子质量为24,摩尔质量为24g/mol。
已知条件 公式
任意状态的任意物质 M=(定义式)
已知一个分子或原子的质量 M=m(分子或原子)×NA
摩尔质量的计算方法
n=
m
M
m=n×M
变式:
物质的量(n)、质量(m)、摩尔质量(M)之间的关系
1.物质的量是表示微粒数目多少的物理量( )
2.2 mol H2O的摩尔质量是1 mol H2O的摩尔质量的2倍( )
3.1 mol O2的质量与它的相对分子质量相等( )
4.12 g 12C中所含碳原子的数目约为6.02×1023( )
5.1 mol OH-的质量为17 g·mol-1( )
小组讨论
概念 应用注意事项
物质的量 “物质的量”四个字是一个整体,不能拆开,也不能添字,如不能说成“物质量”或“物质的数量”等
摩尔 只用来描述微观粒子,如原子、分子、离子、中子、质子、电子等,也可以是特定组合,如1 mol NaCl
注意事项
阿伏加德罗常数 (1)NA的标准是0.012 kg 12C中的碳原子个数。
(2)NA是一个实验值,现阶段常取6.02×1023作计算
摩尔质量 (1)适用于任何一种微观粒子。
(2)纯净物和混合物都有摩尔质量,混合物的摩尔质量一般称为平均摩尔质量
1.基本关系式
(1)n= (n表示物质的量,N表示粒子数)。关系式中NA的单位是mol-1。
(2)M= (M为摩尔质量,m为物质的质量)。在M、n和m中,已知任意两项求第三项;若M的单位是g·mol-1时,则m的单位是g。
物质的量、物质的质量、粒子数目之间的关系
2.恒等关系式
由n= 和n= 。可得恒等关系式: =n= 。
在N、NA、m、M中,已知任意三项可求第四项。一般情况下,NA、M是已知的,则N与m可互求。
3.摩尔质量的计算方法
(1)已知任意状态物质的质量时:M= (定义式)。
(2)已知一个分子的质量时:M=m(分子)×NA。
(3)已知一个分子的质量和一个12C原子的质量时:
M= ×12 g·mol-1
注意:在数值上,摩尔质量=相对原子质量(相对分子质量)=1 mol 该物质的质量(摩尔质量以g/mol,质量以g为单位时)。
1.204×1024个CH4的质量是多少?
【分析】依据物质的量计算宏观质量和微观粒子,已知粒子数,求质量,应先求物质的量。
n(CH4)=
N(CH4)
NA
=2mol
=
1.204×1024
6.02×1023mol-1
m(CH4)=2mol×16g/mol=32g
课堂总结
一.物质的量
符号:n
单位:摩尔,简称摩,符号为 mol
描述对象:分子、原子、质子等微观粒子,不能用于宏观颗粒
表示微观粒子个数多少的物理量,是国际单位制基本物理量之一
二.阿伏加德罗常数
NA近似值:6.02×1023mol-1
1mol任何粒子集体含有NA个粒子;
n =
N
NA
N =
n×
NA
或
三.摩尔质量:单位物质的量的物质所具有的质量。
数值上等于其相对分子质量(式量)
n =
m
M
m =
n×
M
或
1.下列说法正确的是( )
A.氧气的摩尔质量是32g B.1molCO2的质量为44g·mol-1
C.O2的摩尔质量(单位是g·mol-1)在数值上等于其相对分子质量
D.不同物质的摩尔质量一定不同
2.下列说法正确的是( )
A.16gO2所含的分子数约为6.02×1023
B.0.5molHNO3含有的原子数目为2.5NA
C.18gH2O中原子的物质的量为1mol
D.22g物质A中含有的分子数约为3.01×1023,则A的摩尔质量为44g
当堂训练
3.下列各组物质中所含氧原子的物质的量相同的是( )
A.0.3 mol O2和0.3 mol H2O
B.6.02×1023个CO2与0.1 mol KMnO4
C.0.1 mol CuSO4·5H2O和0.1 mol C6H12O6
D.0.1 mol H2SO4和0.4NA个H2O
4.在下面的横线上填上适当的内容。
(1)6.02×1024个Na+约含_________ mol Na+,其质量为_________ g。
(2)4.5 mol CH4约含有_________个CH4分子,其质量为_________ g。
(3)3.01×1023个SO 约含__________ mol SO ,其质量为_________ g;49 g H2SO4约含有__________个H原子,共含有__________个原子。
谢谢
