化学人教版2019选择性必修1 1.1 反应热与焓变(共31张ppt)
文档属性
| 名称 | 化学人教版2019选择性必修1 1.1 反应热与焓变(共31张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 126.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-02 21:11:12 | ||
图片预览






文档简介
(共31张PPT)
第1节 反应热
第1课时:反应热 焓变
第一章
反应热
01
中和反应反应热的测定
02
焓变
03
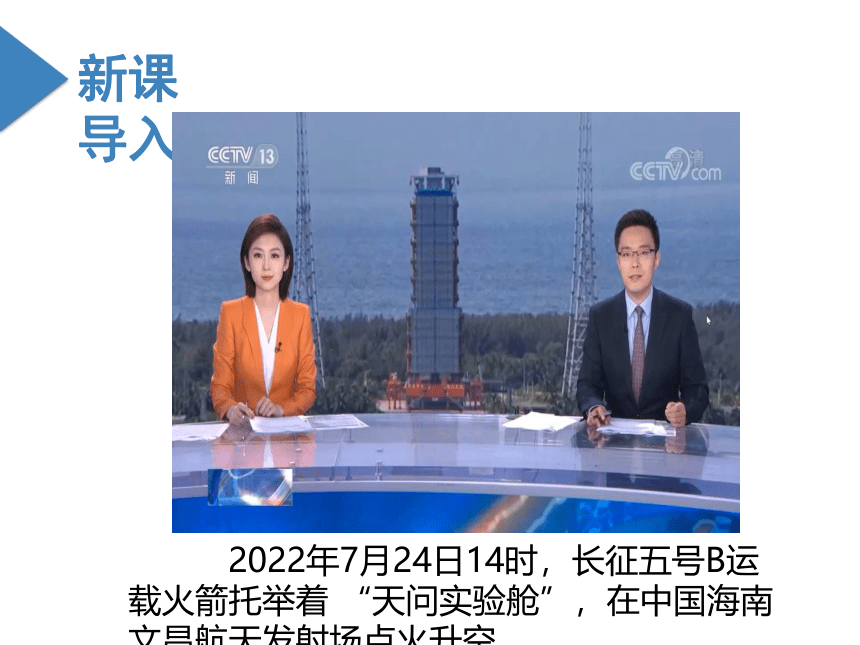
2022年7月24日14时,长征五号B运载火箭托举着 “天问实验舱”,在中国海南文昌航天发射场点火升空。
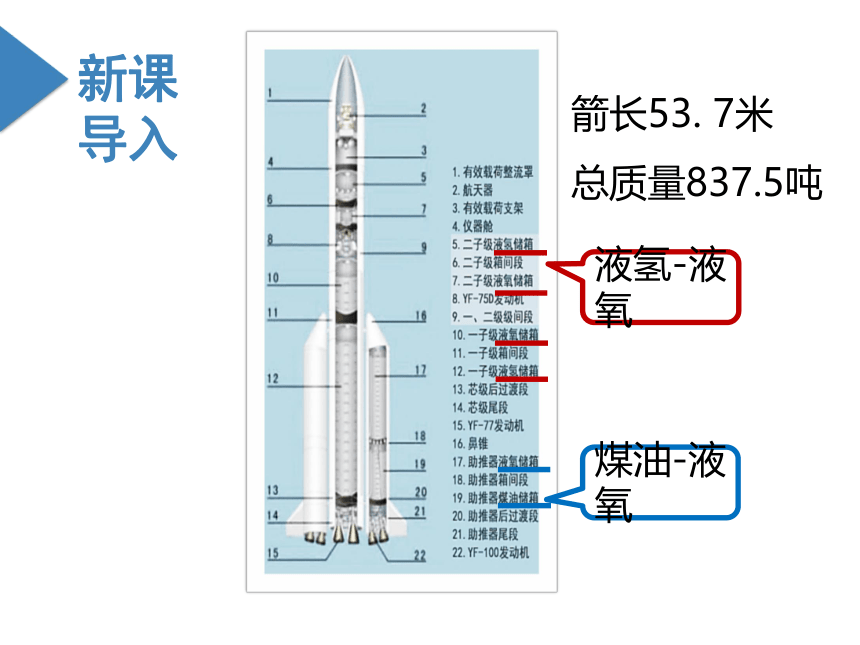
液氢-液氧
煤油-液氧
箭长53. 7米
总质量837.5吨
【旧知回顾】
常见放热反应
③ 酸碱
中和反应
①燃烧
④ 大部分
化合反应
②金属与水
/酸反应
⑤ 铝热
反应
常见吸热反应
① Ba(OH)2·8H2O
和NH4Cl
② C/CO/H2 还原
金属氧化物
③ 大多分解反应
如何定量描述反应释放或吸收的能量呢?
【旧知回顾】
KMnO4
反应热
反应热
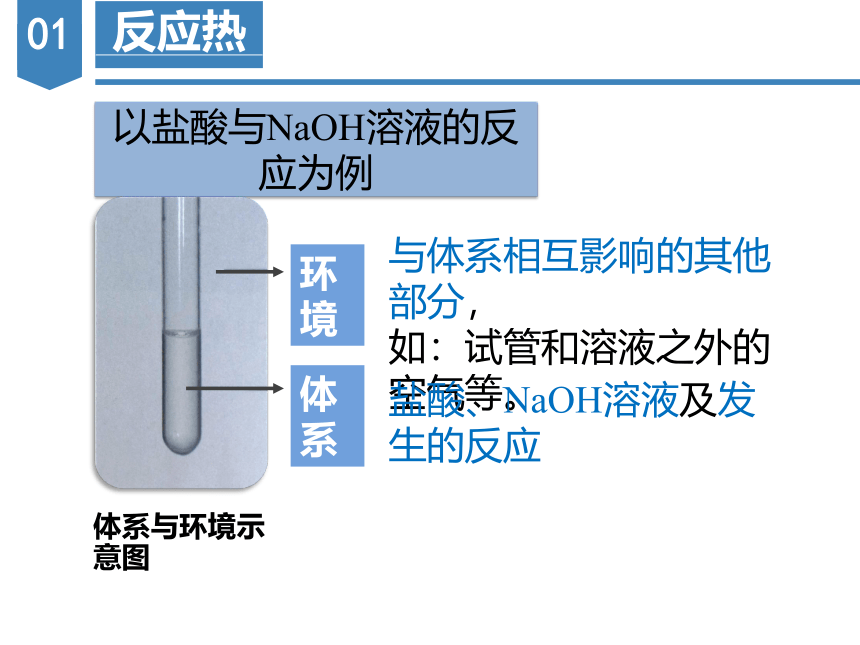
与体系相互影响的其他部分,
如:试管和溶液之外的空气等。
盐酸、NaOH溶液及发生的反应
以盐酸与NaOH溶液的反应为例
环境
体系
体系与环境示意图
反应热
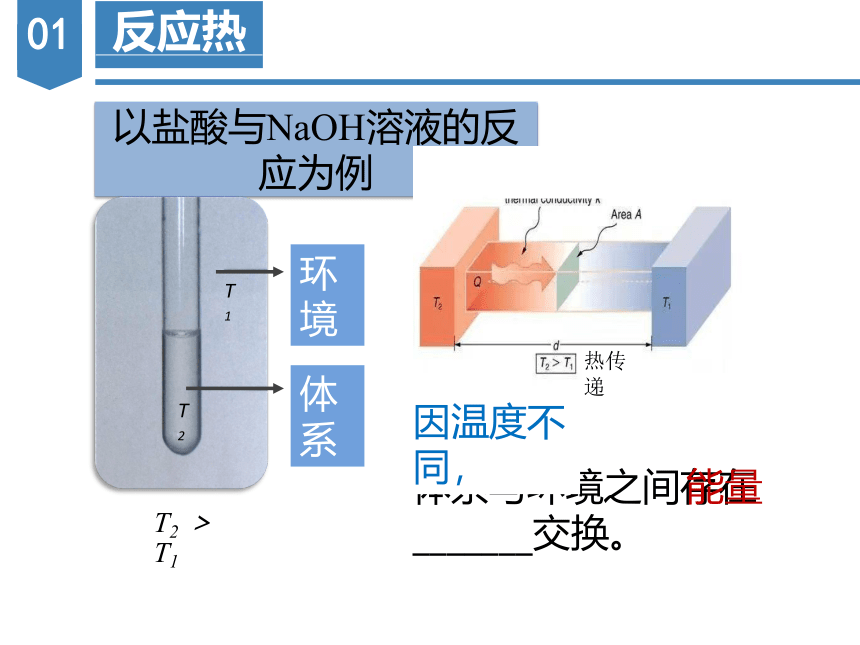
以盐酸与NaOH溶液的反应为例
环境
体系
T2 > T1
T2
T1
体系与环境之间存在_______交换。
能量
因温度不同,
热传递
反应热
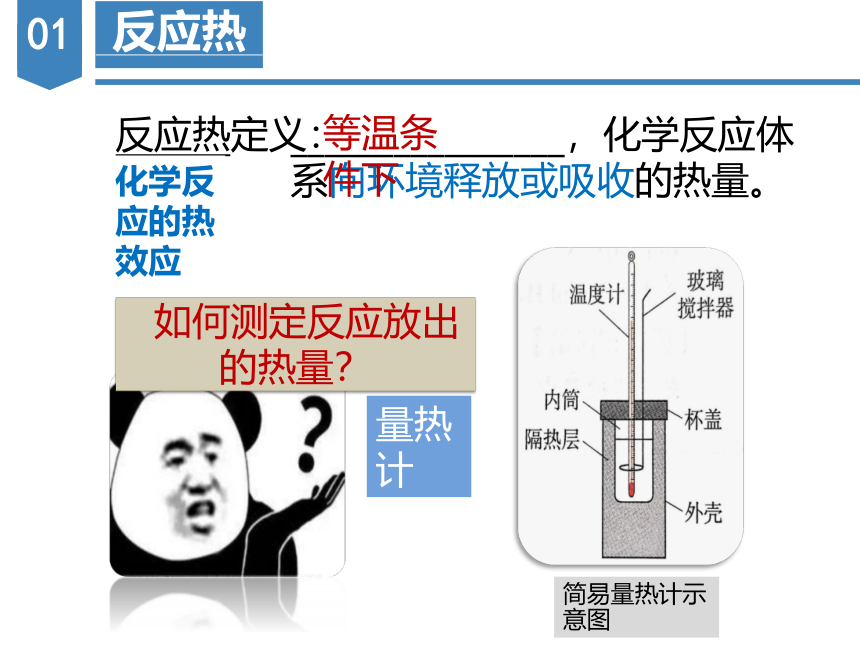
反应热定义:
________________,化学反应体系向环境释放或吸收的热量。
化学反应的热效应
量热计
简易量热计示意图
如何测定反应放出的热量?
等温条件下
中和反应
反应热的测定
XXXXX
中和反应反应热的测定
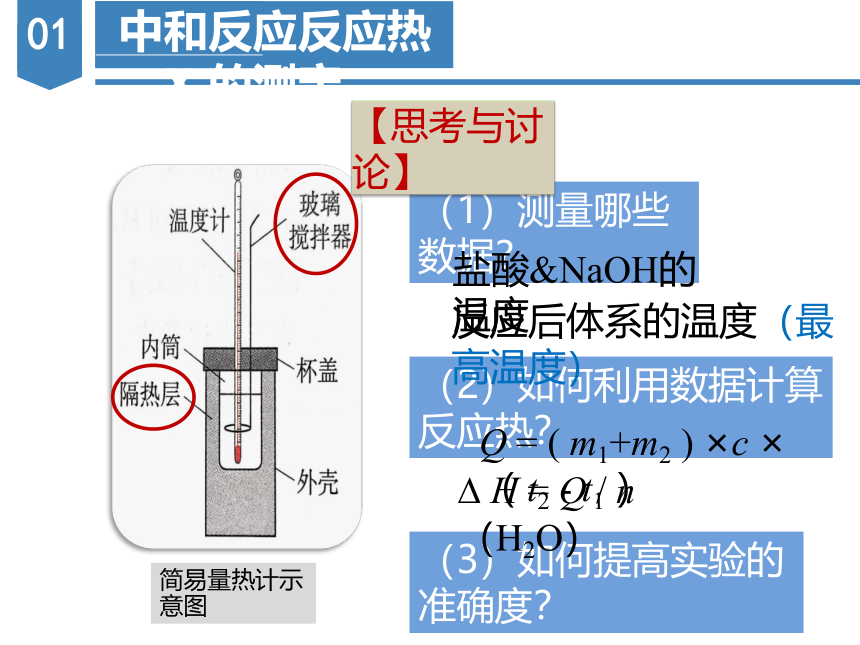
(1)测量哪些数据?
简易量热计示意图
【思考与讨论】
(2)如何利用数据计算反应热?
(3)如何提高实验的准确度?
盐酸&NaOH的温度
反应后体系的温度(最高温度)
Q = ( m1+m2 ) ×c ×( t2 - t1 )
H = Q / n(H2O)
XXXXX
中和反应反应热的测定
【实验测量】
a. 量取50 mL 0.5mol/L盐酸,用温度计测量盐酸的温度t1
用水冲洗干净温度计上的酸。
反应物温度的测量
b. 量取50 mL 0.55mol/L NaOH溶液,用温度计测量其温度t2
防止残留的酸与碱反应,
导致测量的t2数据不准。
NaOH稍过量,确保盐酸完全反应
XXXXX
中和反应反应热的测定
【数据处理】
实验
次数
反应物的温度/℃
盐酸
NaOH溶液
反应物前
体系的温度
t1/℃
反应物后
体系的温度
t2/℃
温度差
(t2 - t1 )/℃
取三次温度差的平均值作为计算依据:
1
2
3
Q = ( m1+m2 ) × c ×( t2 - t1 )
= (50+50)×4.18×3
= 1254 J
H = Q / n(H2O)
= 1254 ÷ 0.025
= 50160 J
= 50.160 kJ
XXXXX
中和反应反应热的测定
50.16
kJ
57.3
kJ
VS
你测的数据
资料上的数据
为什么误差这么大?
×
数据
XXXXX
中和反应反应热的测定
实验过程中有哪些因素会造成实验误差?
①装置本身缺陷:
②实验操作:
③数据处理:
如 动作慢,造成热量损失
保温性能差
酸碱溶液的比热容和密度均大于水
采用近似值计算,
【误差分析】
XXXXX
中和反应反应热的测定
【问题与讨论】
提高测定反应热准确度的措施有哪些?
①装置:
②实验操作:
精确的温度计
动作迅速,减小热量损失
搅拌均匀
提高装置的保温效果
XXXXX
中和反应反应热的测定
中和热
在25℃和101kPa下,
_________跟_______的______溶液发生中和反应生成_____________时所释放的热量为 57.3 kJ。
强酸
强碱
稀
1mol水
HCl
NaOH
HNO3
Ba(OH)2
H2SO4
HNO3
NH3·H2O
Ba(OH)2
CH3COOH
NaOH
×
×
×
1、采用50mL 0.55mol/L NaOH溶液和50mL 0.5mol/L稀盐酸进行中和反应反应热的测定实验,装置如图所示,下列说法错误的是( )
A.仪器M的名称为玻璃搅拌器
B.碎泡沫塑料能减少热量的散失
C.加入试剂时,应缓慢加入,防止液体飞溅
D.可用50mL 0.26mol/L稀硫酸代替稀盐酸进行实验
C
2.用如图所示的装置进行中和反应反应热的测定。下列说法正
确的是( )
A.如图条件下实验过程中没有热量损失
B.玻璃搅拌器可用铜质材料代替
C.为了使反应均匀进行,药品可以分几次
加入
D.分别测量NaOH与醋酸和硫酸中和反应
的反应热,数值不同
D
焓变
焓变
与________有关的物理量,描述物质所具有的______
能量
受温度、压强、物质的聚集状态等影响。
内能
焓
焓变
反应热在______________等于焓变,用______表示。
产生
反应热
体系
内能改变
等压
反应热
焓变
等压条件下
ΔH
单位为_______
kJ·mol-1
焓变
当体系吸热时其焓增大,ΔH 为________,即ΔH_______。
1) 放热反应
当体系放热时其焓减小,ΔH 为________,即ΔH_______。
负值
<0
正值
>0
2) 吸热反应
(ΔH<0)
(ΔH>0)
焓变
反应热的微观实质
化学反应的本质:___________________________________
旧化学键的断裂 和 新化学键的形成
吸收能量
放出能量
1 mol H2与1 mol Cl2反应生成2 mol HCl分子的过程中:
_____了_____ kJ的能量。
释放
183
计算:ΔH = ________________________________
反应物的总键能-生成物的总键能
3.某化学反应的能量变化如图所示,下列说法错误的是( )
A.断开化学键需要吸收能量
B.该化学反应放出的热量为E2-E3
C.锌和稀硫酸反应的能量变化趋势与
图示一致
D.该反应过程中反应物的总能量大
于生成物的总能量
B
4、(双选) Na2CO3溶液与盐酸反应过程中的能量变化如图所示,
下列叙述正确的是( )
BD
5.某同学设计如图所示实验,探究反应中的能量变化。下列判
断正确的是( )
A.由实验可知,(a)、(b)、(c)所涉及的反应都是放热反应
B.若用NaOH固体测定中和热,则测定中和热(ΔH)偏高
C.实验(c)设计存在缺陷
D.将实验(a)中的铝片更换为等质量的铝粉后释放出的热量有所增加
C
研究反应热的意义
(1)热能综合利用
(2)工艺条件优化
(3)理论分析
…………
反应热
反应热
中和反应的反应热
焓变 H
等温下,化学反应释放或吸收的热量
强酸、强碱;
稀溶液;
生成1mol水
等压条件下的反应热
放热反应ΔH<0;吸热反应ΔH>0
第1课 反应热 焓变
第1节 反应热
第1课时:反应热 焓变
第一章
反应热
01
中和反应反应热的测定
02
焓变
03
2022年7月24日14时,长征五号B运载火箭托举着 “天问实验舱”,在中国海南文昌航天发射场点火升空。
液氢-液氧
煤油-液氧
箭长53. 7米
总质量837.5吨
【旧知回顾】
常见放热反应
③ 酸碱
中和反应
①燃烧
④ 大部分
化合反应
②金属与水
/酸反应
⑤ 铝热
反应
常见吸热反应
① Ba(OH)2·8H2O
和NH4Cl
② C/CO/H2 还原
金属氧化物
③ 大多分解反应
如何定量描述反应释放或吸收的能量呢?
【旧知回顾】
KMnO4
反应热
反应热
与体系相互影响的其他部分,
如:试管和溶液之外的空气等。
盐酸、NaOH溶液及发生的反应
以盐酸与NaOH溶液的反应为例
环境
体系
体系与环境示意图
反应热
以盐酸与NaOH溶液的反应为例
环境
体系
T2 > T1
T2
T1
体系与环境之间存在_______交换。
能量
因温度不同,
热传递
反应热
反应热定义:
________________,化学反应体系向环境释放或吸收的热量。
化学反应的热效应
量热计
简易量热计示意图
如何测定反应放出的热量?
等温条件下
中和反应
反应热的测定
XXXXX
中和反应反应热的测定
(1)测量哪些数据?
简易量热计示意图
【思考与讨论】
(2)如何利用数据计算反应热?
(3)如何提高实验的准确度?
盐酸&NaOH的温度
反应后体系的温度(最高温度)
Q = ( m1+m2 ) ×c ×( t2 - t1 )
H = Q / n(H2O)
XXXXX
中和反应反应热的测定
【实验测量】
a. 量取50 mL 0.5mol/L盐酸,用温度计测量盐酸的温度t1
用水冲洗干净温度计上的酸。
反应物温度的测量
b. 量取50 mL 0.55mol/L NaOH溶液,用温度计测量其温度t2
防止残留的酸与碱反应,
导致测量的t2数据不准。
NaOH稍过量,确保盐酸完全反应
XXXXX
中和反应反应热的测定
【数据处理】
实验
次数
反应物的温度/℃
盐酸
NaOH溶液
反应物前
体系的温度
t1/℃
反应物后
体系的温度
t2/℃
温度差
(t2 - t1 )/℃
取三次温度差的平均值作为计算依据:
1
2
3
Q = ( m1+m2 ) × c ×( t2 - t1 )
= (50+50)×4.18×3
= 1254 J
H = Q / n(H2O)
= 1254 ÷ 0.025
= 50160 J
= 50.160 kJ
XXXXX
中和反应反应热的测定
50.16
kJ
57.3
kJ
VS
你测的数据
资料上的数据
为什么误差这么大?
×
数据
XXXXX
中和反应反应热的测定
实验过程中有哪些因素会造成实验误差?
①装置本身缺陷:
②实验操作:
③数据处理:
如 动作慢,造成热量损失
保温性能差
酸碱溶液的比热容和密度均大于水
采用近似值计算,
【误差分析】
XXXXX
中和反应反应热的测定
【问题与讨论】
提高测定反应热准确度的措施有哪些?
①装置:
②实验操作:
精确的温度计
动作迅速,减小热量损失
搅拌均匀
提高装置的保温效果
XXXXX
中和反应反应热的测定
中和热
在25℃和101kPa下,
_________跟_______的______溶液发生中和反应生成_____________时所释放的热量为 57.3 kJ。
强酸
强碱
稀
1mol水
HCl
NaOH
HNO3
Ba(OH)2
H2SO4
HNO3
NH3·H2O
Ba(OH)2
CH3COOH
NaOH
×
×
×
1、采用50mL 0.55mol/L NaOH溶液和50mL 0.5mol/L稀盐酸进行中和反应反应热的测定实验,装置如图所示,下列说法错误的是( )
A.仪器M的名称为玻璃搅拌器
B.碎泡沫塑料能减少热量的散失
C.加入试剂时,应缓慢加入,防止液体飞溅
D.可用50mL 0.26mol/L稀硫酸代替稀盐酸进行实验
C
2.用如图所示的装置进行中和反应反应热的测定。下列说法正
确的是( )
A.如图条件下实验过程中没有热量损失
B.玻璃搅拌器可用铜质材料代替
C.为了使反应均匀进行,药品可以分几次
加入
D.分别测量NaOH与醋酸和硫酸中和反应
的反应热,数值不同
D
焓变
焓变
与________有关的物理量,描述物质所具有的______
能量
受温度、压强、物质的聚集状态等影响。
内能
焓
焓变
反应热在______________等于焓变,用______表示。
产生
反应热
体系
内能改变
等压
反应热
焓变
等压条件下
ΔH
单位为_______
kJ·mol-1
焓变
当体系吸热时其焓增大,ΔH 为________,即ΔH_______。
1) 放热反应
当体系放热时其焓减小,ΔH 为________,即ΔH_______。
负值
<0
正值
>0
2) 吸热反应
(ΔH<0)
(ΔH>0)
焓变
反应热的微观实质
化学反应的本质:___________________________________
旧化学键的断裂 和 新化学键的形成
吸收能量
放出能量
1 mol H2与1 mol Cl2反应生成2 mol HCl分子的过程中:
_____了_____ kJ的能量。
释放
183
计算:ΔH = ________________________________
反应物的总键能-生成物的总键能
3.某化学反应的能量变化如图所示,下列说法错误的是( )
A.断开化学键需要吸收能量
B.该化学反应放出的热量为E2-E3
C.锌和稀硫酸反应的能量变化趋势与
图示一致
D.该反应过程中反应物的总能量大
于生成物的总能量
B
4、(双选) Na2CO3溶液与盐酸反应过程中的能量变化如图所示,
下列叙述正确的是( )
BD
5.某同学设计如图所示实验,探究反应中的能量变化。下列判
断正确的是( )
A.由实验可知,(a)、(b)、(c)所涉及的反应都是放热反应
B.若用NaOH固体测定中和热,则测定中和热(ΔH)偏高
C.实验(c)设计存在缺陷
D.将实验(a)中的铝片更换为等质量的铝粉后释放出的热量有所增加
C
研究反应热的意义
(1)热能综合利用
(2)工艺条件优化
(3)理论分析
…………
反应热
反应热
中和反应的反应热
焓变 H
等温下,化学反应释放或吸收的热量
强酸、强碱;
稀溶液;
生成1mol水
等压条件下的反应热
放热反应ΔH<0;吸热反应ΔH>0
第1课 反应热 焓变
