化学人教版2019必修第一册2.3.1 物质的量及其单位——摩尔(共32张ppt)
文档属性
| 名称 | 化学人教版2019必修第一册2.3.1 物质的量及其单位——摩尔(共32张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 7.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-03 12:24:56 | ||
图片预览





文档简介
(共32张PPT)
走进奇妙的化学世界
必修第一册
第二章 海水中的重要
元素——钠和氯
第三节 物质的量
第1课时 物质的量及其单位
——摩尔
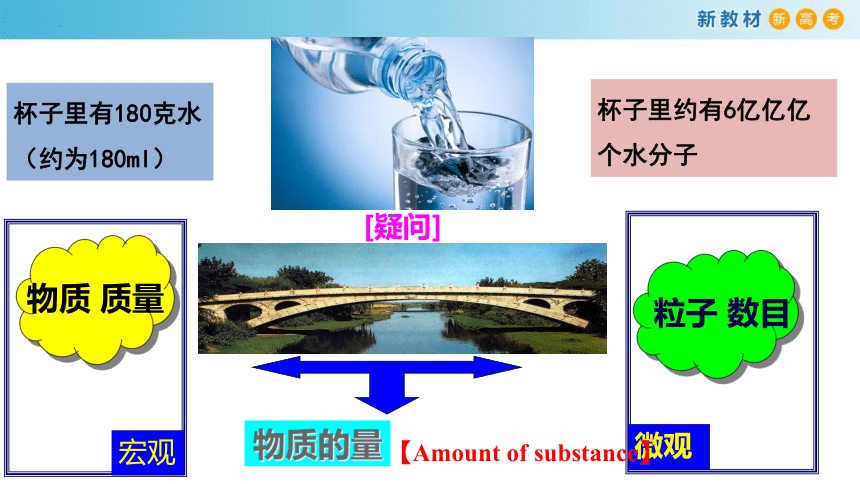
[疑问]
杯子里有180克水(约为180ml)
杯子里约有6亿亿亿个水分子
宏观
物质 质量
微观
粒子 数目
物质的量
【Amount of substance】
学习
目标
PART
01
PART
02
了解“物质的量”是一个基本物理量,“摩尔”是物质的量的单位;
理解物质的量与微粒个数、物质质量的关系
PART
03
了解阿伏加德罗常数的含义
第1课时
物质的量及其单位-摩尔
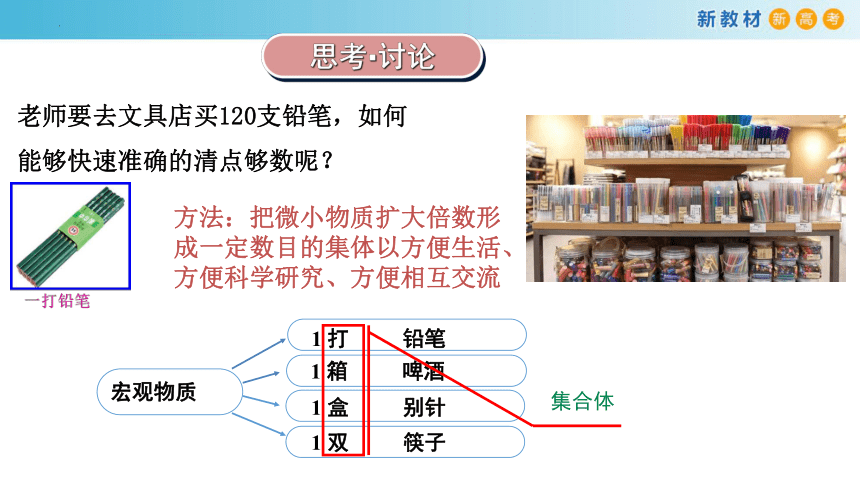
思考·讨论
老师要去文具店买120支铅笔,如何
能够快速准确的清点够数呢?
方法:把微小物质扩大倍数形成一定数目的集体以方便生活、方便科学研究、方便相互交流
1 打 铅笔
1 双 筷子
1 箱 啤酒
1 盒 别针
宏观物质
集合体
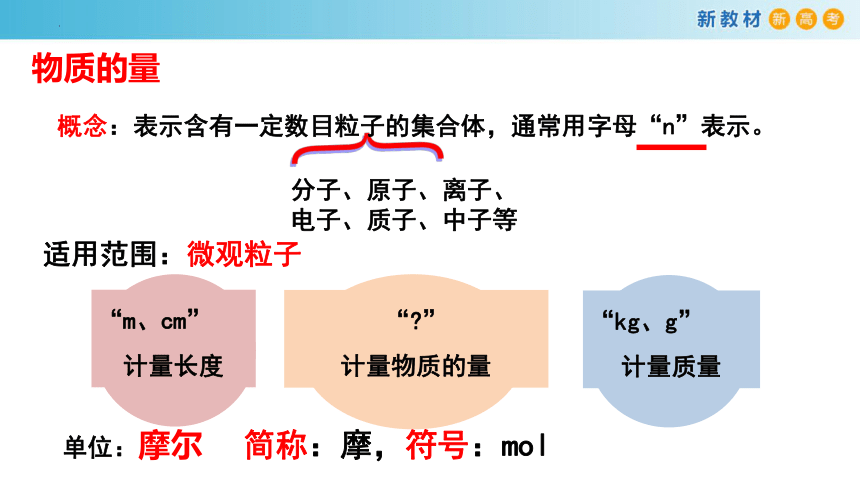
物质的量
单位:摩尔 简称:摩,符号:mol
{
分子、原子、离子、电子、质子、中子等
适用范围:微观粒子
概念:表示含有一定数目粒子的集合体,通常用字母“n”表示。
“m、cm”
计量长度
“kg、g”
计量质量
“ ”
计量物质的量
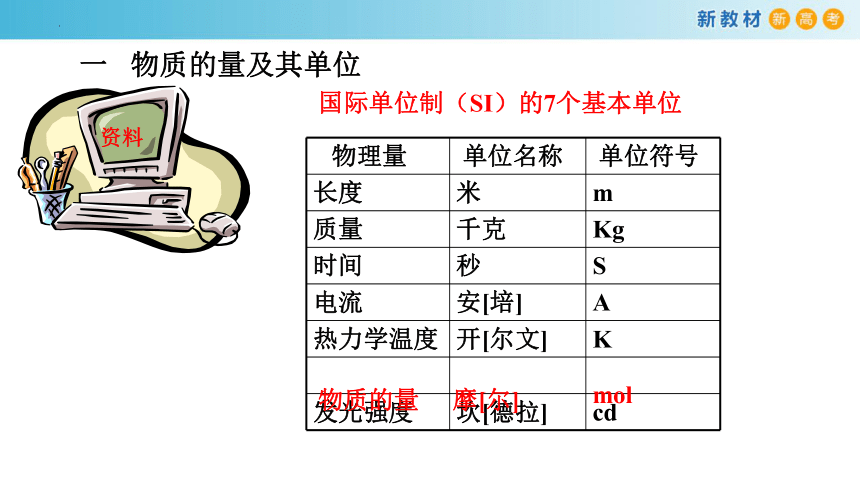
国际单位制(SI)的7个基本单位
物理量 单位名称 单位符号
长度 米 m
质量 千克 Kg
时间 秒 S
电流 安[培] A
热力学温度 开[尔文] K
发光强度 坎[德拉] cd
物质的量
摩[尔]
mol
资料
一 物质的量及其单位
【课堂练习1】
1.判断正误,并说明理由。
A.1mol氢
B. 1mol CO2
C. 1mol大米
错误。没有指出是分子、原子或离子
正确。
错误。大米不是微观粒子
必须指明微粒的种类,如原子、分子、离子等。
可用化学式指明种类。
注意
2、说出下列符号的意义:
①2H 、
②2molH 、
③2molH+ 、
④2molH2 、
2个氢原子
2mol氢原子
2mol氢离子
2mol氢气分子
使用物质的量时要注意以下四点。
(1)专有化:物质的量是一个专用名词,在表述时不可增减,不能说成“物质量”“物质的质量”或“物质的数量”等。
(2)微观化:物质的量的单位是摩尔,只用于表示分子、原子、离子、质子、中子、电子等微观粒子的多少,不能表示宏观物质的数量。
(3)具体化:在使用物质的量表示物质时,必须具体指明粒子的种类。如1 mol氢的表述是错误的,没有指明氢元素微观粒子的名称,可以写成1 mol H或1 mol H2,明确微观粒子。
(4)集体化:微粒个数的数值只能是正整数,而物质的量表示的是很多个微粒的集合体,其数值可以是整数,也可以是小数。例:5 mol H2O、0.5 mol H2O。
注意事项:
(1)“物质的量”是一个整体,是个专有名词。
(2)只适用于微观的粒子——分子、原子、离子、电子、质子等
(3)使用摩尔作单位时必须指明粒子的种类。
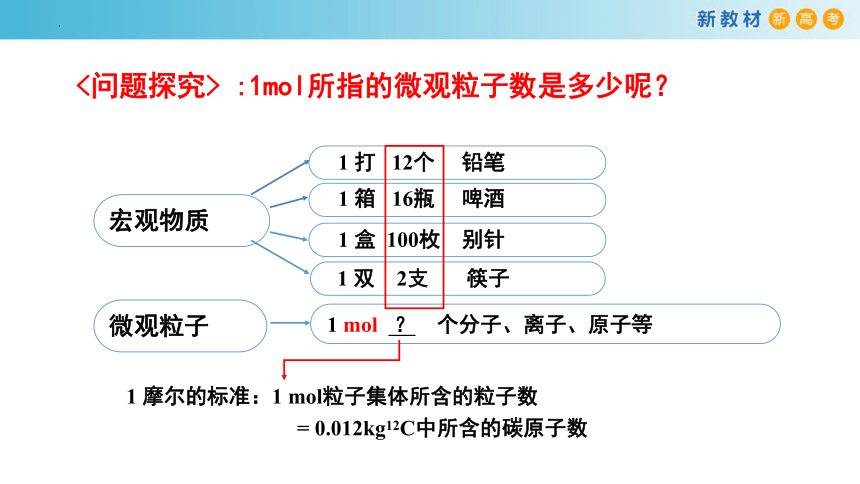
1 打 12个 铅笔
1 双 2支 筷子
1 箱 16瓶 啤酒
1 盒 100枚 别针
宏观物质
微观粒子
1 mol ? 个分子、离子、原子等
1 摩尔的标准:1 mol粒子集体所含的粒子数
= 0.012kg12C中所含的碳原子数
物质的量的单位-摩尔
<问题探究> :1mol所指的微观粒子数是多少呢?
??
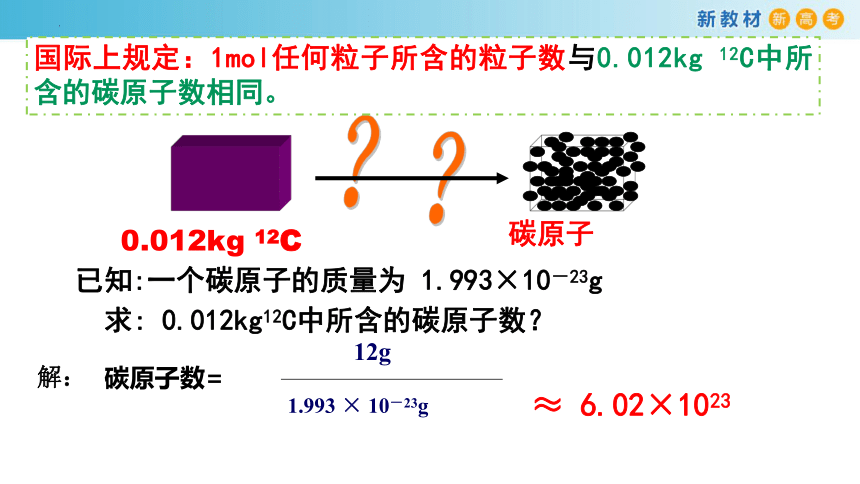
0.012kg 12C
碳原子
已知:一个碳原子的质量为 1.993×10-23g
求: 0.012kg12C中所含的碳原子数?
解:
≈ 6.02×1023
12g
1.993 × 10-23g
碳原子数=
国际上规定:1mol任何粒子所含的粒子数与0.012kg 12C中所含的碳原子数相同。
2.衡量标准:
思考·讨论
国际规定,1mol粒子集合体所含的粒子数约为6.02×1023。
1mol粒子
如果把6.02×1023个硬币排成一行,可以来回于地球与太阳之间多少次?
240亿次
如果有 6.02×1023 粒米让全球60亿人吃,每人每天吃10斤,可吃多少时间?
1万4千年!
集合体
科学上规定为: 0.012kg12C中含有的碳原子数
意大利物理学家
是一个数值
是一个衡量标准
规定:
每摩尔微粒集合体含有阿佛加德罗常数个微粒。
1mol某种微粒集合体中所含的微粒数
0.012kg12C中所含的原子数
=
2.衡量标准:
3. 阿伏加德罗常数: 1mol任何粒子的粒子数,符号为NA 。单位mol-1
数值:约为6.02×1023
[注意]
不能认为 6.02×1023就是阿伏加德罗常数
也不能认为1mol粒子=6.02×1023个
1mol任何粒子的粒子数
0.012kg12C中所含原子数
阿伏加德罗常数(NA)单位:mol-1
6.02×1023
约为
约为
约为
=
=
物质的量的单位-摩尔
阿伏加德罗常数
[思考]
在12克12C中所含的碳原子的个数为阿佛加德罗常数个,约为____ __ 个碳原子。
在12克12C中所含的碳原子的物质的量为多少摩尔呢?
摩尔
个
1mol微粒
阿佛加德罗常数个微粒
(约为6.02× 1023个)
6.02 × 1023
思考·讨论
(1)1 molCO2有 NA 个CO2分子,约为 个CO2分子。
(2)2 molCO2有 NA 个CO2分子,约为 个CO2分子。
(3)3 molCO2有 NA 个CO2分子,约为 个CO2分子。
1
6.02×1023
2
2×6.02×1023
3
3×6.02×1023
根据上述过程,物质的量(n)、阿伏加德罗常数(NA)
与粒子的粒子数(N)之间存在什么关系呢?
阿佛加德罗常数
物质的量
微粒个数
(约6.02 × 1023)
N
=
NA
×
n
物质的量表示含有一定数目的微粒的集体,单位为摩尔,
1 mol微粒集体中含有阿伏加德罗常数个粒子。
4.物质的量、阿伏加德罗常数与粒子数之间的关系:
微判断1
(1)物质的量就是物质的质量。( )
(2)设NA代表阿伏加德罗常数的值。2 mol氧中所含氧原子的个数为2NA。( )
(3)1 mol NH3所含原子数约是2.408×1024。( )
(4)物质的量是指物质所含粒子的数目。( )
(5)物质的量的单位——摩尔只适用于分子、原子和离子。( )
×
×
×
×
√
【例题】
1. 1mol H2所含氢气分子的个数是多少
N(微粒)=n(微粒) ×NA
N(H2)=n(H2)×NA
2.约为 1.204×1024个 SO42- 的物质的量是多少?
N(H2)=1mol×6.02×1023mol-1
=6.02×1023
答: 1mol H2所含氢气分子数约为 6.02×1023个
N(SO42-)=n(SO42-)×NA
=
1.204×1024
6.02×1023mol-1
=2mol
n(SO42-)=
N(SO42-)
NA
答:约为 1.204×1024个 SO42- 的物质的量是2mol
3. 1 mol 氧气分子中含有多少个氧原子
先依据组成找关系后计算
O2 ~ 2 O
1mol 2mol
N(O)=n(O)×NA
N(O)=2mol×6.02×1023mol-1
=1.204×1024
答: 1mol 氧气分子中所含氧原子数约为 1.204×1024个
1.下列有关说法正确的是( )。
A.摩尔是国际单位制中7个物理量之一
B.1摩尔氯含有6.02×1023 个氯分子
C.阿伏加德罗常数就是6.02×1023
D.0.5 mol O2含有6.02×1023 个氧原子
答案:D
解析:摩尔是单位,不是物理量,故A项错误。“1摩尔氯”指代不明,没有指出是氯原子还是氯气分子,故B项错误。阿伏加德罗常数指的是1 mol任何粒子含有的粒子数,是一个物理量,其单位是mol-1,故C项错误。0.5 mol O2含有氧原子的物质的量n(O)=0.5 mol×2=1 mol,故氧原子数N(O)=n·NA=6.02×1023 ,故D项正确。
1.通过下图可进一步认识水的组成,请完成图中空格。
H2O
2H
O
1个水分子
2个氢原子
1个氧原子
约有
6.02×1023
1.204×1024
6.02×1023
1 mol H2O
2 mol H
1 mol O
2 mol H2O
4 mol H
2 mol O
深度思考
2.(1)1 mol CO2中有___ mol C和__ mol O,0.5 mol CO2中有____ mol C和__ mol O。含有0.5 mol O的CO2的物质的量为_____ mol。
(2)1 mol H2中含 mol电子
(3)1 mol Na2SO4中含有Na+的数目约为___________,与其含有相同Na+数目的NaCl的物质的量为______。
(4)若测得某Na2SO4溶液中含有0.5 mol ,则溶液中含有__ mol Na+。
(5)____ mol NH3与0.3 mol H2O中所含H原子一样多。
(6)0.3 mol H2O中含____ mol原子,约含___________个电子。
1
2
0.5
1
0.25
2
1.204×1024
2 mol
1
0.2
0.9
1.806×1024
【课堂练习2】
1、1.204×1024个H2的物质的量是多少?
2、5mol O2含有 ---------------个氧气分子
3、1molNa2CO3中含有_____molNa+、______molCO32-离子,共含有离子的个数约为______________个。
2mol
约3.01 × 1024
2
1
1.806 × 1024
N(微粒)=n(微粒) ×NA
【课堂练习3】
1、某硫酸钠溶液中含有3.01×1022个Na+则该溶液中SO42-的物质的量是( )
2、0.5molNH3中所含的原子数为( )
所含的质子数为( )
3、已知amolClO2分子中含有b个e-(电子)则阿伏加德罗常数可表示为( )
【课后思考】1molC-12的质量是0.012kg,那么1mol其他物质的质量又是多少呢?
0.025mol
1.204 × 1024
3.01 × 1024
b/33amol-1
3、1mol H2SO4中含有 mol H, mol O,
mol SO42-,共有 个原子。
4、有2molH2O,则其中n(H)= ,
所含的分子个数约为 个。
2
4
1
7NA
1.204×1024
4 mol
1:1:1
1:2:3
5、相同物质的量的Ar、H2和O3中所含分子数之比为 ,所含原子数之比为 。
7.某校在国际禁毒日的宣传板报有这样一则内容:“摇头丸”是一种人工合成毒品,具有兴奋和致幻作用,会严重破坏人体的中枢神经,具有很强的精神依赖性,上瘾后难以戒断。合成“摇头丸”的一种重要物质为苯丙胺。
分子式:C9H13N
(1)“苯丙胺”的摩尔质量为 。
(2)0.5 mol苯丙胺中约含有 个氢原子。
(3)270 g苯丙胺的物质的量是 ,其中含有碳元素的质量是 。
(4)苯丙胺中碳、氢、氮原子的物质的量之比为 ,质量之比为 。
135 g·mol-1
3.913×1024或6.5NA
2mol
216 g
9∶13∶1
108∶13∶14
生平简介
意大利化学家。1776年8月9日生于都灵市一个律师家庭,1856年7月9日卒于都灵市。1792年进都灵大学法律系学习,取得法学博士学位后,曾开业当律师。1800年弃法从理,十分勤奋,1820年被聘任都灵大学理科教授。自 18年被选为都灵科学院院士后,还担任过意大利教育委员和度量衡学会会长.
Amedeo Avogadro
1776~1856
阿佛加德罗
贡献与成就
阿佛加德罗在化学上的重大贡献是建立分子学说自从1809年盖·吕萨克发表了当气体进行化学反应时,其体积成简单整数比的定律后,这给道尔顿的原子论出了一道不能解决的难题。为了使道尔顿原子论走出困境,阿伏伽德罗提出分子学说,基本论点是:(1)许多气体分子是由两个原子组成的,如氧气、氮气,它们决非是单原子的。(2)在同温、同压下,同体积的气体有同数个分子。虽然,阿伏伽德罗的分子学说是正确的,解决了道尔顿原子论与盖·吕萨克定律的矛盾,但是,当时的化学界受柏济力阿斯的二元说影响很深,认为同一种原子不可能结合在一起。于是,阿伏加德罗的分子说,遭到泊济力阿斯为首的,也包括道尔顿在内的化学家的反对,致使这一光辉成就埋没达十年之久,在他生前未能使该学说取得化学界的公认。直到1860年,阿伏加德罗的学生康尼查罗把老师的学说写成《化学哲学教程概要》小册子,并在德国卡尔斯鲁厄欧洲化学家学术讨论会上散发,才引起著名化学家迈尔等的注意和承认,之后,阿伏伽德罗学说才被化学界所接受。如今,阿伏加德罗的同温同压下同体积气体有同数个分子已被实验证明,故这一假说已成为阿伏加德罗定律。现在, 一摩尔物质所含的分子数已被测定为6.02×1023,为了纪念阿伏加德罗的伟大功绩,被命名为阿佛加德罗常数。它是自然科学中的基本常数之一。
归纳总结
物质的量的理解
1、 物质的量是表示一定数目粒子集合体的物理量,属于七个基本物理量之一,符号为n;摩尔是它的单位,每摩尔物质含有阿伏加德罗常数个微粒,约为6.02×1023。
2、物质的量
3、“四化”理解物质的量:
专有化、微观化、具体化、集体化。
谢谢欣赏
走进奇妙的化学世界
必修第一册
第二章 海水中的重要
元素——钠和氯
第三节 物质的量
第1课时 物质的量及其单位
——摩尔
[疑问]
杯子里有180克水(约为180ml)
杯子里约有6亿亿亿个水分子
宏观
物质 质量
微观
粒子 数目
物质的量
【Amount of substance】
学习
目标
PART
01
PART
02
了解“物质的量”是一个基本物理量,“摩尔”是物质的量的单位;
理解物质的量与微粒个数、物质质量的关系
PART
03
了解阿伏加德罗常数的含义
第1课时
物质的量及其单位-摩尔
思考·讨论
老师要去文具店买120支铅笔,如何
能够快速准确的清点够数呢?
方法:把微小物质扩大倍数形成一定数目的集体以方便生活、方便科学研究、方便相互交流
1 打 铅笔
1 双 筷子
1 箱 啤酒
1 盒 别针
宏观物质
集合体
物质的量
单位:摩尔 简称:摩,符号:mol
{
分子、原子、离子、电子、质子、中子等
适用范围:微观粒子
概念:表示含有一定数目粒子的集合体,通常用字母“n”表示。
“m、cm”
计量长度
“kg、g”
计量质量
“ ”
计量物质的量
国际单位制(SI)的7个基本单位
物理量 单位名称 单位符号
长度 米 m
质量 千克 Kg
时间 秒 S
电流 安[培] A
热力学温度 开[尔文] K
发光强度 坎[德拉] cd
物质的量
摩[尔]
mol
资料
一 物质的量及其单位
【课堂练习1】
1.判断正误,并说明理由。
A.1mol氢
B. 1mol CO2
C. 1mol大米
错误。没有指出是分子、原子或离子
正确。
错误。大米不是微观粒子
必须指明微粒的种类,如原子、分子、离子等。
可用化学式指明种类。
注意
2、说出下列符号的意义:
①2H 、
②2molH 、
③2molH+ 、
④2molH2 、
2个氢原子
2mol氢原子
2mol氢离子
2mol氢气分子
使用物质的量时要注意以下四点。
(1)专有化:物质的量是一个专用名词,在表述时不可增减,不能说成“物质量”“物质的质量”或“物质的数量”等。
(2)微观化:物质的量的单位是摩尔,只用于表示分子、原子、离子、质子、中子、电子等微观粒子的多少,不能表示宏观物质的数量。
(3)具体化:在使用物质的量表示物质时,必须具体指明粒子的种类。如1 mol氢的表述是错误的,没有指明氢元素微观粒子的名称,可以写成1 mol H或1 mol H2,明确微观粒子。
(4)集体化:微粒个数的数值只能是正整数,而物质的量表示的是很多个微粒的集合体,其数值可以是整数,也可以是小数。例:5 mol H2O、0.5 mol H2O。
注意事项:
(1)“物质的量”是一个整体,是个专有名词。
(2)只适用于微观的粒子——分子、原子、离子、电子、质子等
(3)使用摩尔作单位时必须指明粒子的种类。
1 打 12个 铅笔
1 双 2支 筷子
1 箱 16瓶 啤酒
1 盒 100枚 别针
宏观物质
微观粒子
1 mol ? 个分子、离子、原子等
1 摩尔的标准:1 mol粒子集体所含的粒子数
= 0.012kg12C中所含的碳原子数
物质的量的单位-摩尔
<问题探究> :1mol所指的微观粒子数是多少呢?
??
0.012kg 12C
碳原子
已知:一个碳原子的质量为 1.993×10-23g
求: 0.012kg12C中所含的碳原子数?
解:
≈ 6.02×1023
12g
1.993 × 10-23g
碳原子数=
国际上规定:1mol任何粒子所含的粒子数与0.012kg 12C中所含的碳原子数相同。
2.衡量标准:
思考·讨论
国际规定,1mol粒子集合体所含的粒子数约为6.02×1023。
1mol粒子
如果把6.02×1023个硬币排成一行,可以来回于地球与太阳之间多少次?
240亿次
如果有 6.02×1023 粒米让全球60亿人吃,每人每天吃10斤,可吃多少时间?
1万4千年!
集合体
科学上规定为: 0.012kg12C中含有的碳原子数
意大利物理学家
是一个数值
是一个衡量标准
规定:
每摩尔微粒集合体含有阿佛加德罗常数个微粒。
1mol某种微粒集合体中所含的微粒数
0.012kg12C中所含的原子数
=
2.衡量标准:
3. 阿伏加德罗常数: 1mol任何粒子的粒子数,符号为NA 。单位mol-1
数值:约为6.02×1023
[注意]
不能认为 6.02×1023就是阿伏加德罗常数
也不能认为1mol粒子=6.02×1023个
1mol任何粒子的粒子数
0.012kg12C中所含原子数
阿伏加德罗常数(NA)单位:mol-1
6.02×1023
约为
约为
约为
=
=
物质的量的单位-摩尔
阿伏加德罗常数
[思考]
在12克12C中所含的碳原子的个数为阿佛加德罗常数个,约为____ __ 个碳原子。
在12克12C中所含的碳原子的物质的量为多少摩尔呢?
摩尔
个
1mol微粒
阿佛加德罗常数个微粒
(约为6.02× 1023个)
6.02 × 1023
思考·讨论
(1)1 molCO2有 NA 个CO2分子,约为 个CO2分子。
(2)2 molCO2有 NA 个CO2分子,约为 个CO2分子。
(3)3 molCO2有 NA 个CO2分子,约为 个CO2分子。
1
6.02×1023
2
2×6.02×1023
3
3×6.02×1023
根据上述过程,物质的量(n)、阿伏加德罗常数(NA)
与粒子的粒子数(N)之间存在什么关系呢?
阿佛加德罗常数
物质的量
微粒个数
(约6.02 × 1023)
N
=
NA
×
n
物质的量表示含有一定数目的微粒的集体,单位为摩尔,
1 mol微粒集体中含有阿伏加德罗常数个粒子。
4.物质的量、阿伏加德罗常数与粒子数之间的关系:
微判断1
(1)物质的量就是物质的质量。( )
(2)设NA代表阿伏加德罗常数的值。2 mol氧中所含氧原子的个数为2NA。( )
(3)1 mol NH3所含原子数约是2.408×1024。( )
(4)物质的量是指物质所含粒子的数目。( )
(5)物质的量的单位——摩尔只适用于分子、原子和离子。( )
×
×
×
×
√
【例题】
1. 1mol H2所含氢气分子的个数是多少
N(微粒)=n(微粒) ×NA
N(H2)=n(H2)×NA
2.约为 1.204×1024个 SO42- 的物质的量是多少?
N(H2)=1mol×6.02×1023mol-1
=6.02×1023
答: 1mol H2所含氢气分子数约为 6.02×1023个
N(SO42-)=n(SO42-)×NA
=
1.204×1024
6.02×1023mol-1
=2mol
n(SO42-)=
N(SO42-)
NA
答:约为 1.204×1024个 SO42- 的物质的量是2mol
3. 1 mol 氧气分子中含有多少个氧原子
先依据组成找关系后计算
O2 ~ 2 O
1mol 2mol
N(O)=n(O)×NA
N(O)=2mol×6.02×1023mol-1
=1.204×1024
答: 1mol 氧气分子中所含氧原子数约为 1.204×1024个
1.下列有关说法正确的是( )。
A.摩尔是国际单位制中7个物理量之一
B.1摩尔氯含有6.02×1023 个氯分子
C.阿伏加德罗常数就是6.02×1023
D.0.5 mol O2含有6.02×1023 个氧原子
答案:D
解析:摩尔是单位,不是物理量,故A项错误。“1摩尔氯”指代不明,没有指出是氯原子还是氯气分子,故B项错误。阿伏加德罗常数指的是1 mol任何粒子含有的粒子数,是一个物理量,其单位是mol-1,故C项错误。0.5 mol O2含有氧原子的物质的量n(O)=0.5 mol×2=1 mol,故氧原子数N(O)=n·NA=6.02×1023 ,故D项正确。
1.通过下图可进一步认识水的组成,请完成图中空格。
H2O
2H
O
1个水分子
2个氢原子
1个氧原子
约有
6.02×1023
1.204×1024
6.02×1023
1 mol H2O
2 mol H
1 mol O
2 mol H2O
4 mol H
2 mol O
深度思考
2.(1)1 mol CO2中有___ mol C和__ mol O,0.5 mol CO2中有____ mol C和__ mol O。含有0.5 mol O的CO2的物质的量为_____ mol。
(2)1 mol H2中含 mol电子
(3)1 mol Na2SO4中含有Na+的数目约为___________,与其含有相同Na+数目的NaCl的物质的量为______。
(4)若测得某Na2SO4溶液中含有0.5 mol ,则溶液中含有__ mol Na+。
(5)____ mol NH3与0.3 mol H2O中所含H原子一样多。
(6)0.3 mol H2O中含____ mol原子,约含___________个电子。
1
2
0.5
1
0.25
2
1.204×1024
2 mol
1
0.2
0.9
1.806×1024
【课堂练习2】
1、1.204×1024个H2的物质的量是多少?
2、5mol O2含有 ---------------个氧气分子
3、1molNa2CO3中含有_____molNa+、______molCO32-离子,共含有离子的个数约为______________个。
2mol
约3.01 × 1024
2
1
1.806 × 1024
N(微粒)=n(微粒) ×NA
【课堂练习3】
1、某硫酸钠溶液中含有3.01×1022个Na+则该溶液中SO42-的物质的量是( )
2、0.5molNH3中所含的原子数为( )
所含的质子数为( )
3、已知amolClO2分子中含有b个e-(电子)则阿伏加德罗常数可表示为( )
【课后思考】1molC-12的质量是0.012kg,那么1mol其他物质的质量又是多少呢?
0.025mol
1.204 × 1024
3.01 × 1024
b/33amol-1
3、1mol H2SO4中含有 mol H, mol O,
mol SO42-,共有 个原子。
4、有2molH2O,则其中n(H)= ,
所含的分子个数约为 个。
2
4
1
7NA
1.204×1024
4 mol
1:1:1
1:2:3
5、相同物质的量的Ar、H2和O3中所含分子数之比为 ,所含原子数之比为 。
7.某校在国际禁毒日的宣传板报有这样一则内容:“摇头丸”是一种人工合成毒品,具有兴奋和致幻作用,会严重破坏人体的中枢神经,具有很强的精神依赖性,上瘾后难以戒断。合成“摇头丸”的一种重要物质为苯丙胺。
分子式:C9H13N
(1)“苯丙胺”的摩尔质量为 。
(2)0.5 mol苯丙胺中约含有 个氢原子。
(3)270 g苯丙胺的物质的量是 ,其中含有碳元素的质量是 。
(4)苯丙胺中碳、氢、氮原子的物质的量之比为 ,质量之比为 。
135 g·mol-1
3.913×1024或6.5NA
2mol
216 g
9∶13∶1
108∶13∶14
生平简介
意大利化学家。1776年8月9日生于都灵市一个律师家庭,1856年7月9日卒于都灵市。1792年进都灵大学法律系学习,取得法学博士学位后,曾开业当律师。1800年弃法从理,十分勤奋,1820年被聘任都灵大学理科教授。自 18年被选为都灵科学院院士后,还担任过意大利教育委员和度量衡学会会长.
Amedeo Avogadro
1776~1856
阿佛加德罗
贡献与成就
阿佛加德罗在化学上的重大贡献是建立分子学说自从1809年盖·吕萨克发表了当气体进行化学反应时,其体积成简单整数比的定律后,这给道尔顿的原子论出了一道不能解决的难题。为了使道尔顿原子论走出困境,阿伏伽德罗提出分子学说,基本论点是:(1)许多气体分子是由两个原子组成的,如氧气、氮气,它们决非是单原子的。(2)在同温、同压下,同体积的气体有同数个分子。虽然,阿伏伽德罗的分子学说是正确的,解决了道尔顿原子论与盖·吕萨克定律的矛盾,但是,当时的化学界受柏济力阿斯的二元说影响很深,认为同一种原子不可能结合在一起。于是,阿伏加德罗的分子说,遭到泊济力阿斯为首的,也包括道尔顿在内的化学家的反对,致使这一光辉成就埋没达十年之久,在他生前未能使该学说取得化学界的公认。直到1860年,阿伏加德罗的学生康尼查罗把老师的学说写成《化学哲学教程概要》小册子,并在德国卡尔斯鲁厄欧洲化学家学术讨论会上散发,才引起著名化学家迈尔等的注意和承认,之后,阿伏伽德罗学说才被化学界所接受。如今,阿伏加德罗的同温同压下同体积气体有同数个分子已被实验证明,故这一假说已成为阿伏加德罗定律。现在, 一摩尔物质所含的分子数已被测定为6.02×1023,为了纪念阿伏加德罗的伟大功绩,被命名为阿佛加德罗常数。它是自然科学中的基本常数之一。
归纳总结
物质的量的理解
1、 物质的量是表示一定数目粒子集合体的物理量,属于七个基本物理量之一,符号为n;摩尔是它的单位,每摩尔物质含有阿伏加德罗常数个微粒,约为6.02×1023。
2、物质的量
3、“四化”理解物质的量:
专有化、微观化、具体化、集体化。
谢谢欣赏
