化学人教版2019选择性必修1 1.1 反应热与焓变(共29张ppt)
文档属性
| 名称 | 化学人教版2019选择性必修1 1.1 反应热与焓变(共29张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 579.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-03 00:00:00 | ||
图片预览







文档简介
(共29张PPT)
第一章 化学反应的热效应
第一节 反应热
第1课时 反应热 焓变
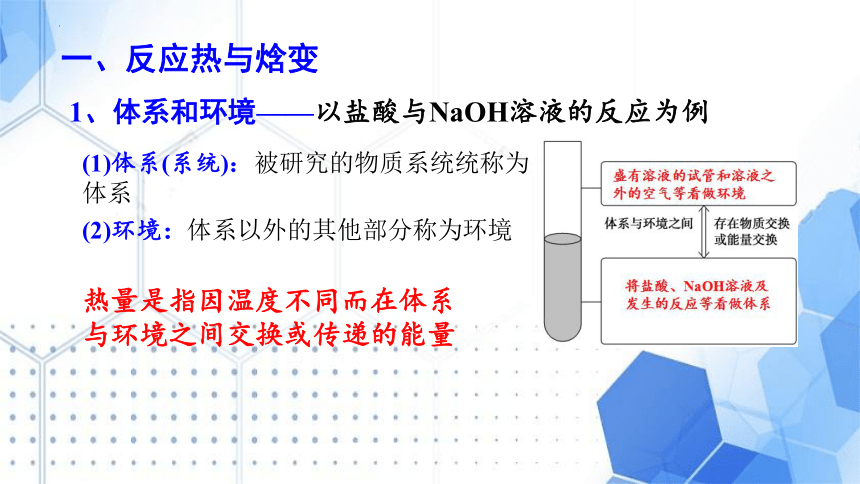
1、体系和环境——以盐酸与NaOH溶液的反应为例
一、反应热与焓变
(2)环境:体系以外的其他部分称为环境
(1)体系(系统):被研究的物质系统统称为体系
热量是指因温度不同而在体系与环境之间交换或传递的能量
2、反应热与焓变
(1)反应热
①含义:在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热
②符号:ΔH
③单位:kJ·mol-1或kJ/mol
④测定方法:利用量热计直接测定
④在等压条件下进行的化学反应(严格地说,对反应体系做功还有限定,中学阶段一般不考虑),其反应热等于反应的焓变,符号:ΔH,单位:kJ/mol(或kJ·mol-1)
(2)内能、焓、焓变
①内能(符号为U):体系内物质的各种能量的总和,受温度、压强和物质的聚集状态等影响
②焓(符号为H):与物质内能有关的物理量
③焓变:焓变( H):是变化前后物质的焓值差,化学反应的焓变,为生成物的总焓值与反应物的总焓值之差,即:ΔH=H(生成物)-H(反应物)
以H2(g)+Cl2(g)===2HCl(g)反应的能量变化为例说明
(3)从微观角度认识反应热的实质
1molH2
2molH
共价键断裂
吸收436kJ能量
1molCl2
2molCl
共价键断裂
吸收243kJ能量
共价键形成
释放862kJ能量
}
2molHCl
(4)反应热和焓变的比较
类别项目 反应热 焓变
不同点 概念 化学反应释放或吸收的热量 化学反应中生成物的总焓与反应物的总焓之差
相同点 “+”“-”的意义 “+”表示反应吸热,“-”表示反应放热 数据来源 可以通过实验直接测得,也可以利用已知数据通过计算求得 联系 ①等值关系:恒压条件下反应的反应热等于焓变②等价关系:符号是ΔH,单位是kJ·mol-1 【微点拨】
①焓(H)是与内能有关的物理量,内能描述的是物质所具有的能量,是物质固有的性质之一。不同的物质,其焓不同;相同的物质,如果温度或压强不同,物质的状态不同,其焓也会不同。
③化学反应的能量变化主要表现为热量变化,但并不完全是热量变化,还有光能、电能等
②焓、焓变、反应热代表的意义不同;焓只有正值,而焓变有正值、负值之分
⑥任何化学反应在发生物质变化的同时都伴随着能量的变化,通常表现为热量变化,即放出热量或吸收热量。
④物质发生化学反应一定伴随着能量变化,但伴随能量变化的物质变化不一定都是化学变化如:水蒸气变成液态水的过程放热,但该变化为物理变化
⑤能量越低越稳定。
同一物质能量由高到低:气体(g)>液体(l)>固体(s);
稳定性:气体(g)<液体(l)<固体(s)
在化学反应中,一定条件下所释放或吸收的热量即为化学反应热
(1)从反应热的量化参数——键能的角度分析:
化学反应是旧键断裂,新键生成的反应,两者吸收和释放能量的差异表现为反应能量的变化。
3、化学反应过程中能量变化的原因
化学键的断裂和形成时吸收和放出的能量差别
化学反应伴随能量变化的本质原因
新键生成释放的能量小于旧键断裂吸收的能量,则反应吸热
新键生成释放的能量大于旧键断裂吸收的能量,则反应放热
(2)从反应物和生成物焓(H)的变化角度分析
反应物总焓小于生成物总焓,反应吸热
反应物总焓大于生成物总焓,反应放热
【微点拨】
①一个反应是吸热反应还是放热反应与反应条件无必然关系。有些放热反应需加热才能进行。
③形成生成物的化学键放出的能量越多,说明生成物越稳定,本身的能量越低。
②破坏反应物中的化学键吸收的能量越小,说明反应物越不稳定,本身的能量越高。
3、由图分析,下列说法正确的是( )
D.A→B+C ΔH>0,则B+C→A ΔH<0
A.A→B+C和B+C→A两个反应吸收或放出的能量不等
B.A→B+C ΔH<0
C.A具有的焓高于B和C具有的焓的总和
D
即:放热反应的 H<0,吸热反应的 H>0
二、放热反应和吸热反应
(1)放热反应:反应完成时,生成物释放的总能量大于反应物吸收的总能量的反应是放热反应。由于反应后放出热量(释放给环境)而使反应体系的能量降低,故ΔH<,即ΔH为-
(2)吸热反应:反应完成时,生成物释放的总能量小于反应物吸收的总能量的反应是吸热反应。由于反应时吸收环境能量而使反应体系的能量升高,故ΔH>0,即ΔH为+
1、基本概念
2、符号的规定:
规定放热反应的 H为“—”,吸热反应的 H为“+”
3、图示法描述吸热反应与放热反应
反应物的总能量大于生成物的总能量为放热反应
即:E(反应物)>E(生成物)
反应物的总能量小于生成物的总能量为吸热反应
即:E(反应物)<E(生成物)
①所有的燃烧反应,如:木炭、CH4等在空气或氧气中的燃烧,钠、H2在氯气中燃烧,镁条在CO2中燃烧 ②所有的酸碱中和反应,如:HCl+NaOH===NaCl+H2O ③大多数的化合反应,如:CaO+H2O===Ca(OH)2 H2+F2===2HF ④铝热反应,如:2Al+Fe2O3 2Fe+Al2O3 ⑤活泼金属与水、与酸的反应,如:2Na+2H2O===2NaOH+H2↑
Mg+2H+===Mg2++H2↑ ⑥生成沉淀的反应
4、常见的放热反应、吸热反应
(1)常见的放热反应
①大多数分解反应,如:NH4Cl NH3↑+HCl↑
CaCO3 CaO+CO2↑ ②Ba(OH)2·8H2O与NH4Cl的反应 ③C和CO2发生的化合反应及C和H2O(g)的反应 ④以碳、CO、H2为还原剂的氧化还原反应:
如:H2+CuO H2O+Cu C+H2O(g) CO+H2
(2)常见的吸热反应
③ H不仅应用在化学反应中,它还应用于任何有能量变化的过程,如:H2O(l)→H2O(g) H>0;共价键的断裂,吸收能量, H>0;原子间通过共用电子对形成共价键,放出能量, H<0
5、放热反应和吸热反应的判断
(1)ΔH为“-”或ΔH<0是放热反应,ΔH为“+”或ΔH>0是吸热反应
(2)若生成物的总能量大于反应物的总能量,则为吸热反应
(3)由稳定的物质生成不稳定的物质的反应为吸热反应
(4)加热引发的反应,停止加热后反应能继续进行的,则为放热反应,停止加热后反应随之停止,则为吸热反应
【微点拨】
①放热反应和吸热反应是针对化学反应而言,物质三态之间的变化有能量的变化,但属物理变化,故不属于放热反应或吸热反应
②放热反应和吸热反应取决于反应物和生成物总能量的相对大小,与反应条件并无必然的关系
A.吸热反应使环境的温度升高B.当反应放热时ΔH>0,反应吸热时ΔH<0C.化学反应中,当反应物的总能量大于生成物的总能量时,反应放热,ΔH为“-”D.需要加热才能发生的反应一定是吸热反应
1、下列说法正确的是( )
【练2】
C
常见物质中的化学键数目
物质 CO2(C=O) CH4(C-H) P4(P-P) SiO2(Si-O) 石墨 金刚石 S8(S-S) Si
键数 2 4 6 4 1.5 2 8 2
四、焓变(ΔH)的计算方法
1、焓变与物质化学键断裂与形成的关系:
ΔH=反应物总键能-生成物总键能
2、焓变与反应物、生成物能量的关系:
ΔH=生成物的总能量-反应物的总能量=H(生成物)-H(反应物)
1、SF6是一种优良的绝缘气体,分子结构中只存在S—F键。已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F—F、S—F键需吸收的能量分别为160 kJ、330 kJ。则反应S(s)+3F2(g)===SF6(g)的反应热ΔH为( )A.-1 780 kJ·mol-1 B.-1 220 kJ·mol-1
C.-450 kJ·mol-1 D.+430 kJ·mol-1
【练4】
B
中和反应的实质是H+和OH-结合生成水,因而理解中和热时要注意以下几点:①条件:稀溶液,因浓酸溶液或浓碱溶液稀释时会放出热量②反应物:酸与碱 (在中学化学中,只讨论强酸和强碱反应的中和热)③生成物及其物质的量:必须是形成1mol的H2O(l)④表述:用文字叙述中和热时,不带“-”;用ΔH表示时,带上“-”
如:强酸与强碱反应的中和热为57.3 kJ·mol-1或ΔH=-57.3 kJ·mol-1
五、中和热概念及其数值
1、概念:在稀溶液中,酸与碱发生中和反应生成1 mol H2O(l)时释放的热量称为中和热
2、表示方法:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
【微点拨】
⑧中和反应的实质是H+和OH-化合反应生成H2O。若反应过程中有其它物质生成(生成不溶物质或难电离的物质等),这部分热量不包含在中和热内
⑤强酸、强碱发生中和反应时,中和热为一定值,与酸、碱的用量无关,与其中一种过量也无关,但酸和碱放出的热量与其用量有关
⑥浓的强酸和强碱在发生中和反应的同时还要发生溶解,溶解要放出热量,故放出热量大于57.3kJ
⑦弱酸和弱碱在发生中和反应的同时还要发生电离,电离要吸收热量,故放出热量小于57.3kJ
1、实验装置
2、实验测量数据(1)反应物温度的测量①用量筒量取50 mL 0.50 mol·L-1盐酸,打开杯盖,倒入量热计的内筒,盖上杯盖,插入温度计,测量并记录盐酸的温度(数据填入下表)。用水把温度计上的酸冲洗干净,擦干备用②用另一个量筒量取50 mL 0.55 mol·L-1 NaOH溶液,用温度计测量并记录NaOH溶液的温度(数据填入下表)
六、中和反应反应热的测定
(2)反应后体系温度测量打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒,立即盖上杯盖,插入温度计,用搅拌器匀速搅拌。密切关注温度不变化,将最高温度记为反应后体系的温度(t2)
(3)重复上述步骤(1)至步骤(2)两次
(1)取盐酸和NaOH溶液温度的平均值记为反应前体系的温度(t1)。计算温度差t2-t1),将数据填入下表
实验次数 反应物的温度t1/℃ 反应前体系的温度 反应后体系的温度 温度差
盐酸 NaOH溶液 t1/℃ t2/℃ (t2-t1)/℃
1
2
3
(2)取三次测量所得温度差的平均值作为计算依据
3、数据处理
(3)根据温度差和比热容等计算反应热
(1)计算依据:Q=cmΔt 式中:Q为中和反应放出的热量,c为反应混合液的比热容m为反应混合液的质量,Δt为反应前后溶液温度的差值(2)计算技巧:为了计算简便,可以近似地认为实验所用酸、碱稀溶液的密度、比热容与水的相同,并忽略量热计的比热容①50 mL 0.50 mol·L-1盐酸的质量m1=50 g,50 mL 0.55 mol·L-1 NaOH溶液的质量m2=50 g②反应后生成的溶液的比热容c=4.18 J·(g·℃)-1,50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液发生中和反应时放出的热量为Q=c·m·Δt=c·(m1+m2)·(t2-t1)=0.418(t2-t1) kJ③生成1molH2O时放出的热量为0.025(0.418(t2-t1)) kJ则中和热ΔH=-0.025(0.418(t2-t1)) kJ·mol-1
[c=4.18 J·(g·℃)-1]
4、中和热的计算
(3)中和热ΔH计算:
(1)测量盐酸的温度后,要将温度计上的酸冲洗干净后,再测量NaOH溶液的温度,避免酸、碱在温度计的表面反应放热而影响测量结果(2)实验中要用强酸、强碱的稀溶液(0.1~0.5 mol·L-1)(3)测定中和热不能用弱酸或弱碱,因弱酸、弱碱电离时吸收热量而使测量数值偏低(4)中和热的数值是57.3 kJ·mol-1,测定时与强酸、强碱的用量无关(5)加过量碱液使酸完全反应,碱过量对中和热测定没有影响(6)数据处理时,相差较大的数据可能是偶然误差引起的,应舍去
5、中和热测定实验中应注意的事项
(1)装置中的环形玻璃搅拌棒能否用金属(不与酸、碱反应)质环形搅拌棒代替?为什么?
(2)实验中所用HCl和NaOH的物质的量比为何不是1∶1而是NaOH过量?若用HCl过量行吗?
(3)能否用浓硫酸代替盐酸?对结果会产生什么影响?
(4)能否用醋酸代替盐酸或用氨水代替KOH溶液?对结果会产生什么影响?
6、实验讨论
不能。原因是金属质环形搅拌棒易导热,造成实验过程中热量损失
碱过量的目的是保证盐酸完全反应。若使盐酸过量,也是可以的
不能。浓硫酸溶解于水时放热,所测ΔH偏小,即ΔH<-57.3 kJ·mol-1
不能。弱酸、弱碱电离吸热,所测ΔH偏大,即ΔH>-57.3 kJ·mol-1
(5)温度计上的酸为何要用水冲洗干净?冲洗后的溶液能否倒入小烧杯?为什么?
(6)酸、碱混合时,为何要把量筒中的NaOH溶液一次倒入小烧杯而不能缓缓倒入? (7)若改用100 mL 0.50 mol/L的盐酸和100 mL 0.55 mol/L的NaOH溶液,所测中和热的数值是否约为本实验结果的二倍(假定各步操作没有失误)?
(8)怎样用环形玻璃搅拌棒搅拌溶液,不能用铜丝搅拌棒代替的理由是什么?
环形玻璃搅拌棒应上下移动;铜传热快,热量损失大,因此不能用铜丝搅拌棒代替环形玻璃搅拌棒
因为该温度计还要用来测碱液的温度,若不冲洗,温度计上的酸会和碱发生中和反应而使热量散失,故要冲洗干净;冲洗后的溶液不能倒入小烧杯,若倒入,会使总溶液的质量增加,而导致实验结果误差
因为本实验的关键是测反应的反应热,若动作迟缓,将会使热量损失而使误差增大
否。因中和热是指酸与碱发生中和反应生成1 mol H2O时放出的热量,其数值与反应物的量的多少无关,故所测结果应基本和本次实验结果相同
7、误差分析——以50mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH反应为例
引起误差的实验操作 温度差 |ΔH|
保温措施不好 偏小 偏小
搅拌不充分 偏小 偏小
所用酸、碱浓度过大 偏大 偏大
用同浓度的氨水代替NaOH溶液 偏小 偏小
用同浓度的醋酸代替盐酸 偏小 偏小
4、用50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________
(2)大烧杯上如不盖硬纸板,求得的中和热数值________(填“偏大”“偏小”或“无影响”)
(3)如果用60 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热___________________(填“相等”或“不相等”)
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会________(填“偏大”“偏小”或“无影响”)
环形玻璃搅拌棒
偏小
不相等
相等
偏小
第一章 化学反应的热效应
第一节 反应热
第1课时 反应热 焓变
1、体系和环境——以盐酸与NaOH溶液的反应为例
一、反应热与焓变
(2)环境:体系以外的其他部分称为环境
(1)体系(系统):被研究的物质系统统称为体系
热量是指因温度不同而在体系与环境之间交换或传递的能量
2、反应热与焓变
(1)反应热
①含义:在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热
②符号:ΔH
③单位:kJ·mol-1或kJ/mol
④测定方法:利用量热计直接测定
④在等压条件下进行的化学反应(严格地说,对反应体系做功还有限定,中学阶段一般不考虑),其反应热等于反应的焓变,符号:ΔH,单位:kJ/mol(或kJ·mol-1)
(2)内能、焓、焓变
①内能(符号为U):体系内物质的各种能量的总和,受温度、压强和物质的聚集状态等影响
②焓(符号为H):与物质内能有关的物理量
③焓变:焓变( H):是变化前后物质的焓值差,化学反应的焓变,为生成物的总焓值与反应物的总焓值之差,即:ΔH=H(生成物)-H(反应物)
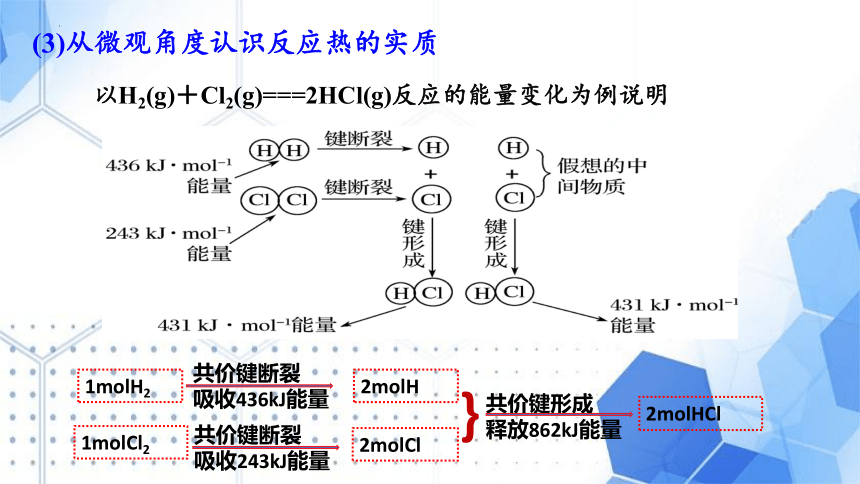
以H2(g)+Cl2(g)===2HCl(g)反应的能量变化为例说明
(3)从微观角度认识反应热的实质
1molH2
2molH
共价键断裂
吸收436kJ能量
1molCl2
2molCl
共价键断裂
吸收243kJ能量
共价键形成
释放862kJ能量
}
2molHCl
(4)反应热和焓变的比较
类别项目 反应热 焓变
不同点 概念 化学反应释放或吸收的热量 化学反应中生成物的总焓与反应物的总焓之差
相同点 “+”“-”的意义 “+”表示反应吸热,“-”表示反应放热 数据来源 可以通过实验直接测得,也可以利用已知数据通过计算求得 联系 ①等值关系:恒压条件下反应的反应热等于焓变②等价关系:符号是ΔH,单位是kJ·mol-1 【微点拨】
①焓(H)是与内能有关的物理量,内能描述的是物质所具有的能量,是物质固有的性质之一。不同的物质,其焓不同;相同的物质,如果温度或压强不同,物质的状态不同,其焓也会不同。
③化学反应的能量变化主要表现为热量变化,但并不完全是热量变化,还有光能、电能等
②焓、焓变、反应热代表的意义不同;焓只有正值,而焓变有正值、负值之分
⑥任何化学反应在发生物质变化的同时都伴随着能量的变化,通常表现为热量变化,即放出热量或吸收热量。
④物质发生化学反应一定伴随着能量变化,但伴随能量变化的物质变化不一定都是化学变化如:水蒸气变成液态水的过程放热,但该变化为物理变化
⑤能量越低越稳定。
同一物质能量由高到低:气体(g)>液体(l)>固体(s);
稳定性:气体(g)<液体(l)<固体(s)
在化学反应中,一定条件下所释放或吸收的热量即为化学反应热
(1)从反应热的量化参数——键能的角度分析:
化学反应是旧键断裂,新键生成的反应,两者吸收和释放能量的差异表现为反应能量的变化。
3、化学反应过程中能量变化的原因
化学键的断裂和形成时吸收和放出的能量差别
化学反应伴随能量变化的本质原因
新键生成释放的能量小于旧键断裂吸收的能量,则反应吸热
新键生成释放的能量大于旧键断裂吸收的能量,则反应放热
(2)从反应物和生成物焓(H)的变化角度分析
反应物总焓小于生成物总焓,反应吸热
反应物总焓大于生成物总焓,反应放热
【微点拨】
①一个反应是吸热反应还是放热反应与反应条件无必然关系。有些放热反应需加热才能进行。
③形成生成物的化学键放出的能量越多,说明生成物越稳定,本身的能量越低。
②破坏反应物中的化学键吸收的能量越小,说明反应物越不稳定,本身的能量越高。
3、由图分析,下列说法正确的是( )
D.A→B+C ΔH>0,则B+C→A ΔH<0
A.A→B+C和B+C→A两个反应吸收或放出的能量不等
B.A→B+C ΔH<0
C.A具有的焓高于B和C具有的焓的总和
D
即:放热反应的 H<0,吸热反应的 H>0
二、放热反应和吸热反应
(1)放热反应:反应完成时,生成物释放的总能量大于反应物吸收的总能量的反应是放热反应。由于反应后放出热量(释放给环境)而使反应体系的能量降低,故ΔH<,即ΔH为-
(2)吸热反应:反应完成时,生成物释放的总能量小于反应物吸收的总能量的反应是吸热反应。由于反应时吸收环境能量而使反应体系的能量升高,故ΔH>0,即ΔH为+
1、基本概念
2、符号的规定:
规定放热反应的 H为“—”,吸热反应的 H为“+”
3、图示法描述吸热反应与放热反应
反应物的总能量大于生成物的总能量为放热反应
即:E(反应物)>E(生成物)
反应物的总能量小于生成物的总能量为吸热反应
即:E(反应物)<E(生成物)
①所有的燃烧反应,如:木炭、CH4等在空气或氧气中的燃烧,钠、H2在氯气中燃烧,镁条在CO2中燃烧 ②所有的酸碱中和反应,如:HCl+NaOH===NaCl+H2O ③大多数的化合反应,如:CaO+H2O===Ca(OH)2 H2+F2===2HF ④铝热反应,如:2Al+Fe2O3 2Fe+Al2O3 ⑤活泼金属与水、与酸的反应,如:2Na+2H2O===2NaOH+H2↑
Mg+2H+===Mg2++H2↑ ⑥生成沉淀的反应
4、常见的放热反应、吸热反应
(1)常见的放热反应
①大多数分解反应,如:NH4Cl NH3↑+HCl↑
CaCO3 CaO+CO2↑ ②Ba(OH)2·8H2O与NH4Cl的反应 ③C和CO2发生的化合反应及C和H2O(g)的反应 ④以碳、CO、H2为还原剂的氧化还原反应:
如:H2+CuO H2O+Cu C+H2O(g) CO+H2
(2)常见的吸热反应
③ H不仅应用在化学反应中,它还应用于任何有能量变化的过程,如:H2O(l)→H2O(g) H>0;共价键的断裂,吸收能量, H>0;原子间通过共用电子对形成共价键,放出能量, H<0
5、放热反应和吸热反应的判断
(1)ΔH为“-”或ΔH<0是放热反应,ΔH为“+”或ΔH>0是吸热反应
(2)若生成物的总能量大于反应物的总能量,则为吸热反应
(3)由稳定的物质生成不稳定的物质的反应为吸热反应
(4)加热引发的反应,停止加热后反应能继续进行的,则为放热反应,停止加热后反应随之停止,则为吸热反应
【微点拨】
①放热反应和吸热反应是针对化学反应而言,物质三态之间的变化有能量的变化,但属物理变化,故不属于放热反应或吸热反应
②放热反应和吸热反应取决于反应物和生成物总能量的相对大小,与反应条件并无必然的关系
A.吸热反应使环境的温度升高B.当反应放热时ΔH>0,反应吸热时ΔH<0C.化学反应中,当反应物的总能量大于生成物的总能量时,反应放热,ΔH为“-”D.需要加热才能发生的反应一定是吸热反应
1、下列说法正确的是( )
【练2】
C
常见物质中的化学键数目
物质 CO2(C=O) CH4(C-H) P4(P-P) SiO2(Si-O) 石墨 金刚石 S8(S-S) Si
键数 2 4 6 4 1.5 2 8 2
四、焓变(ΔH)的计算方法
1、焓变与物质化学键断裂与形成的关系:
ΔH=反应物总键能-生成物总键能
2、焓变与反应物、生成物能量的关系:
ΔH=生成物的总能量-反应物的总能量=H(生成物)-H(反应物)
1、SF6是一种优良的绝缘气体,分子结构中只存在S—F键。已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F—F、S—F键需吸收的能量分别为160 kJ、330 kJ。则反应S(s)+3F2(g)===SF6(g)的反应热ΔH为( )A.-1 780 kJ·mol-1 B.-1 220 kJ·mol-1
C.-450 kJ·mol-1 D.+430 kJ·mol-1
【练4】
B
中和反应的实质是H+和OH-结合生成水,因而理解中和热时要注意以下几点:①条件:稀溶液,因浓酸溶液或浓碱溶液稀释时会放出热量②反应物:酸与碱 (在中学化学中,只讨论强酸和强碱反应的中和热)③生成物及其物质的量:必须是形成1mol的H2O(l)④表述:用文字叙述中和热时,不带“-”;用ΔH表示时,带上“-”
如:强酸与强碱反应的中和热为57.3 kJ·mol-1或ΔH=-57.3 kJ·mol-1
五、中和热概念及其数值
1、概念:在稀溶液中,酸与碱发生中和反应生成1 mol H2O(l)时释放的热量称为中和热
2、表示方法:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
【微点拨】
⑧中和反应的实质是H+和OH-化合反应生成H2O。若反应过程中有其它物质生成(生成不溶物质或难电离的物质等),这部分热量不包含在中和热内
⑤强酸、强碱发生中和反应时,中和热为一定值,与酸、碱的用量无关,与其中一种过量也无关,但酸和碱放出的热量与其用量有关
⑥浓的强酸和强碱在发生中和反应的同时还要发生溶解,溶解要放出热量,故放出热量大于57.3kJ
⑦弱酸和弱碱在发生中和反应的同时还要发生电离,电离要吸收热量,故放出热量小于57.3kJ
1、实验装置
2、实验测量数据(1)反应物温度的测量①用量筒量取50 mL 0.50 mol·L-1盐酸,打开杯盖,倒入量热计的内筒,盖上杯盖,插入温度计,测量并记录盐酸的温度(数据填入下表)。用水把温度计上的酸冲洗干净,擦干备用②用另一个量筒量取50 mL 0.55 mol·L-1 NaOH溶液,用温度计测量并记录NaOH溶液的温度(数据填入下表)
六、中和反应反应热的测定
(2)反应后体系温度测量打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒,立即盖上杯盖,插入温度计,用搅拌器匀速搅拌。密切关注温度不变化,将最高温度记为反应后体系的温度(t2)
(3)重复上述步骤(1)至步骤(2)两次
(1)取盐酸和NaOH溶液温度的平均值记为反应前体系的温度(t1)。计算温度差t2-t1),将数据填入下表
实验次数 反应物的温度t1/℃ 反应前体系的温度 反应后体系的温度 温度差
盐酸 NaOH溶液 t1/℃ t2/℃ (t2-t1)/℃
1
2
3
(2)取三次测量所得温度差的平均值作为计算依据
3、数据处理
(3)根据温度差和比热容等计算反应热
(1)计算依据:Q=cmΔt 式中:Q为中和反应放出的热量,c为反应混合液的比热容m为反应混合液的质量,Δt为反应前后溶液温度的差值(2)计算技巧:为了计算简便,可以近似地认为实验所用酸、碱稀溶液的密度、比热容与水的相同,并忽略量热计的比热容①50 mL 0.50 mol·L-1盐酸的质量m1=50 g,50 mL 0.55 mol·L-1 NaOH溶液的质量m2=50 g②反应后生成的溶液的比热容c=4.18 J·(g·℃)-1,50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液发生中和反应时放出的热量为Q=c·m·Δt=c·(m1+m2)·(t2-t1)=0.418(t2-t1) kJ③生成1molH2O时放出的热量为0.025(0.418(t2-t1)) kJ则中和热ΔH=-0.025(0.418(t2-t1)) kJ·mol-1
[c=4.18 J·(g·℃)-1]
4、中和热的计算
(3)中和热ΔH计算:
(1)测量盐酸的温度后,要将温度计上的酸冲洗干净后,再测量NaOH溶液的温度,避免酸、碱在温度计的表面反应放热而影响测量结果(2)实验中要用强酸、强碱的稀溶液(0.1~0.5 mol·L-1)(3)测定中和热不能用弱酸或弱碱,因弱酸、弱碱电离时吸收热量而使测量数值偏低(4)中和热的数值是57.3 kJ·mol-1,测定时与强酸、强碱的用量无关(5)加过量碱液使酸完全反应,碱过量对中和热测定没有影响(6)数据处理时,相差较大的数据可能是偶然误差引起的,应舍去
5、中和热测定实验中应注意的事项
(1)装置中的环形玻璃搅拌棒能否用金属(不与酸、碱反应)质环形搅拌棒代替?为什么?
(2)实验中所用HCl和NaOH的物质的量比为何不是1∶1而是NaOH过量?若用HCl过量行吗?
(3)能否用浓硫酸代替盐酸?对结果会产生什么影响?
(4)能否用醋酸代替盐酸或用氨水代替KOH溶液?对结果会产生什么影响?
6、实验讨论
不能。原因是金属质环形搅拌棒易导热,造成实验过程中热量损失
碱过量的目的是保证盐酸完全反应。若使盐酸过量,也是可以的
不能。浓硫酸溶解于水时放热,所测ΔH偏小,即ΔH<-57.3 kJ·mol-1
不能。弱酸、弱碱电离吸热,所测ΔH偏大,即ΔH>-57.3 kJ·mol-1
(5)温度计上的酸为何要用水冲洗干净?冲洗后的溶液能否倒入小烧杯?为什么?
(6)酸、碱混合时,为何要把量筒中的NaOH溶液一次倒入小烧杯而不能缓缓倒入? (7)若改用100 mL 0.50 mol/L的盐酸和100 mL 0.55 mol/L的NaOH溶液,所测中和热的数值是否约为本实验结果的二倍(假定各步操作没有失误)?
(8)怎样用环形玻璃搅拌棒搅拌溶液,不能用铜丝搅拌棒代替的理由是什么?
环形玻璃搅拌棒应上下移动;铜传热快,热量损失大,因此不能用铜丝搅拌棒代替环形玻璃搅拌棒
因为该温度计还要用来测碱液的温度,若不冲洗,温度计上的酸会和碱发生中和反应而使热量散失,故要冲洗干净;冲洗后的溶液不能倒入小烧杯,若倒入,会使总溶液的质量增加,而导致实验结果误差
因为本实验的关键是测反应的反应热,若动作迟缓,将会使热量损失而使误差增大
否。因中和热是指酸与碱发生中和反应生成1 mol H2O时放出的热量,其数值与反应物的量的多少无关,故所测结果应基本和本次实验结果相同
7、误差分析——以50mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH反应为例
引起误差的实验操作 温度差 |ΔH|
保温措施不好 偏小 偏小
搅拌不充分 偏小 偏小
所用酸、碱浓度过大 偏大 偏大
用同浓度的氨水代替NaOH溶液 偏小 偏小
用同浓度的醋酸代替盐酸 偏小 偏小
4、用50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________
(2)大烧杯上如不盖硬纸板,求得的中和热数值________(填“偏大”“偏小”或“无影响”)
(3)如果用60 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热___________________(填“相等”或“不相等”)
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会________(填“偏大”“偏小”或“无影响”)
环形玻璃搅拌棒
偏小
不相等
相等
偏小
