化学人教版选择性必修1 2.1.2 活化能(共21张ppt)
文档属性
| 名称 | 化学人教版选择性必修1 2.1.2 活化能(共21张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-03 17:12:31 | ||
图片预览






文档简介
(共21张PPT)
第二章 化学反应速率与化学平衡
活化能
高二化学
新人教化学选择性必修一《化学反应原理》
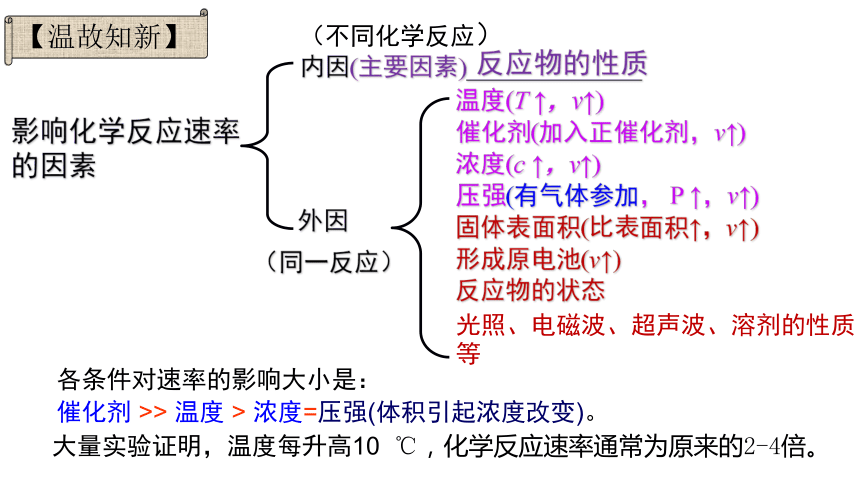
各条件对速率的影响大小是:
催化剂 >> 温度 > 浓度=压强(体积引起浓度改变)。
(不同化学反应)
内因(主要因素)______________
反应物的性质
影响化学反应速率的因素
外因
(同一反应)
温度(T ↑,v↑)
催化剂(加入正催化剂,v↑)
浓度(c ↑,v↑)
压强(有气体参加, P ↑,v↑)
固体表面积(比表面积↑,v↑)
形成原电池(v↑)
反应物的状态
光照、电磁波、超声波、溶剂的性质等
【温故知新】
大量实验证明,温度每升高10 ℃,化学反应速率通常为原来的2-4倍。
【问题】如何解释浓度、压强、温度及催化剂等因素对化学反应速率的影响呢
【微观探析】理论分析,从有效碰撞的角度理解影响化学反应速率的因素
阅读教材P25-26页,回答下列问题:
1、什么是基元反应和反应历程?
2、什么是有效碰撞?发生有效碰撞的条件是什么?
3、什么是活化分子?什么是活化能?在能量反应图里怎么表示活化能?
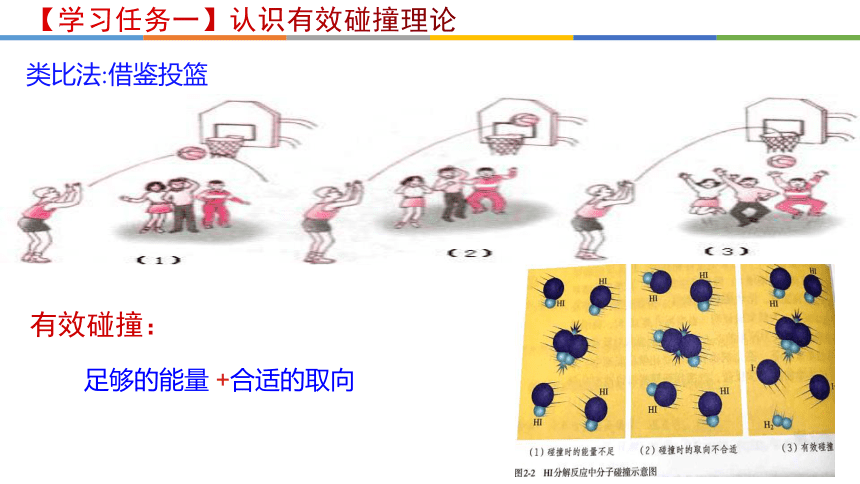
【学习任务一】认识有效碰撞理论
研究发现,大多数化学反应并不是经过简单碰撞就能完成的,而往往经过多个反应步骤才能实现。
每一步反应都称为基元反应,这两个先后进行的基元反应反映了2HI= H2+ I2 的反应历程。反应历程又称反应机理。
如2HI=H2 + I2 ,实际上是经过下列两步反应完成的:
① 2HI→ H2 + 2I·(自由基) ② 2I· → I2。
有效碰撞
【质疑】基元反应发生的先决条件是反应物分子必须发生碰撞,那么反应物分子发生的每一次碰撞都能发生反应吗?
【学习任务一】认识有效碰撞理论
类比法:借鉴投篮
足够的能量 +合适的取向
有效碰撞:
【学习任务一】认识有效碰撞理论
活化分子具有的平均能量与反应物分子具有的平均能量之差
如图2-3所示,
E1表示反应的活化能,
E2 表示活化分子变成生成物分子放出的能量,
E1-E2 表示反应热。
活化分子:
活化能:
具有足够的能量发生有效碰撞的分子
活化能
活化分子变成生成物放出的能量
【学习任务一】认识有效碰撞理论
【质疑】反应物分子都可以发生发生有效碰撞吗?
一个反应要发生一般经历
哪些过程?
普通
分子
活化
分子
有效
碰撞
新物质分子
能量
活化分子百分数:活化分子数/分子总数 ×100%
化学反应速率与活化分子、有效碰撞的关系:
N活化分子 = N总分子× 活化分子%
吸收能量
(活化能)
合理取向的碰撞
单位体积内___________越多(或活化分子的百分数越大)→单位时间内_________次数越多→化学反应速率___________。
构建模型【有效碰撞理论模型】
活化分子数
有效碰撞
越大
对某一化学反应,一定条件下,反应物分子中活化分子的百分数是一定的,单位体积内活化分子的数目与反应物分子的总数成正比。(课本P26最后一段)
【学习任务一】认识有效碰撞理论
请尝试用碰撞理论解释:当其他条件相同时,为什么增大反应物的浓度会使化学反应速率增大,而降低反应物的浓度会使化学反应速率减小
【思考与讨论1】
浓度↑
→单位体积内N总↑
→单位体积内N活↑
→有效碰撞↑
→ v ↑
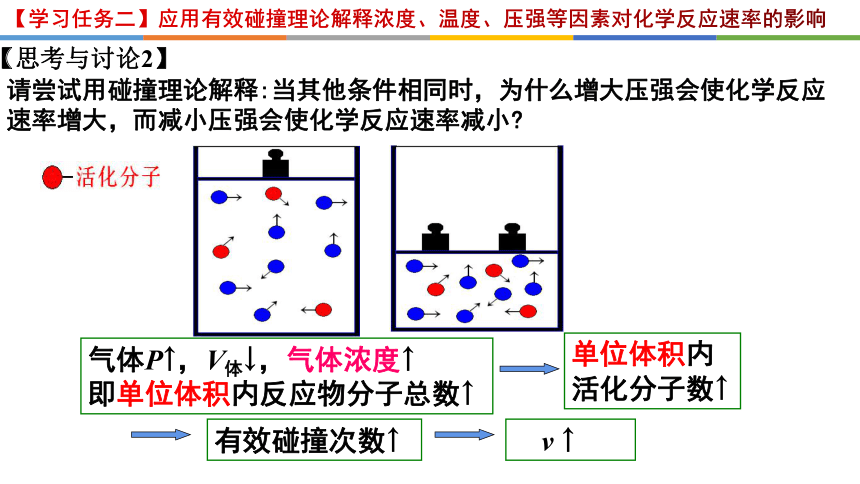
【学习任务二】应用有效碰撞理论解释浓度、温度、压强等因素对化学反应速率的影响
气体P↑,V体↓,气体浓度↑
即单位体积内反应物分子总数↑
单位体积内
活化分子数↑
有效碰撞次数↑
v ↑
请尝试用碰撞理论解释:当其他条件相同时,为什么增大压强会使化学反应速率增大,而减小压强会使化学反应速率减小
【思考与讨论2】
【学习任务二】应用有效碰撞理论解释浓度、温度、压强等因素对化学反应速率的影响
【思考与讨论3】
请尝试用碰撞理论解释:当其他条件相同时,为什么升高温度会使化学反应速率增大,而降低温度会使化学反应速率减小
温度↑
活化分子百分数↑
运动加快,
碰撞频率↑
有效碰撞
次数↑
v ↑
【学习任务二】应用有效碰撞理论解释浓度、温度、压强等因素对化学反应速率的影响
使用催化剂→降低活化能→大大增加活化分子百分数
→增加有效碰撞几率 →
加快反应速率
【思考与讨论4】
请尝试用碰撞理论解释:当其他条件相同时,为什么加入催化剂会使化学反应速率增大?
催化剂的研究是高科技领域的重要内容。
反应热△H
(不变)
【学习任务二】应用有效碰撞理论解释浓度、温度、压强等因素对化学反应速率的影响
【小结】
影响 外因 单位体积内 活化分子百分数 有效碰撞次数 化学反应速率
分子总数 活化分子数
增大反应物浓度
增大压强
升高温度
正催化剂
增加
增加
增加
加快
增加
增加
增加
加快
不变
增加
增加
加快
影响化学反应速率的因素
不变
增加
增加
加快
不变
不变
增加
增加
活化分子百分数:活化分子数/分子总数 ×100%
【知识拓展】除了改变浓度、温度、压强及选用催化剂等,还有很多改变化学反应速率的方法。例如,通过光辐照、放射线辐照、超声波、电弧、强磁场、高速研磨等。总之,向反应体系输入能量,都有可能改变化学反应速率。
1.在有气体参与的反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是( )
A.增大反应物的浓度 B.降低温度
C.增大压强 D.加入催化剂
B
【学习评价】
课本P28
B
课本P29
b
放热
ΔH
课本P29
Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
催化作用
向盛有PbO2和稀H2SO4混合物的试管中滴加含Fe2+的溶液,振荡使其充分反应,观察现象;再向其中加入Pb,振荡使其充分反应,观察现象。
【高考链接】(2018年全国I卷)采用N2O5为硝化剂是一种新型的绿色硝化技术,在材料、医药等工业中得到广泛应用。回答下列问题:
(3)对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第一步 N2O5 NO2+NO3 快速平衡
第二步 NO2+NO3→NO+NO2+O2 慢反应
第三步 NO+NO3→2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是___________(填标号)。
A. v(第一步的逆反应)>v(第二步反应)
B. 反应的中间产物只有NO3
C. 第二步中NO2与NO3的碰撞仅部分有效
D. 第三步反应活化能较高
AC
活化能越高,速率越低
4、(2019年全国I卷)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用·标注。
可知水煤气变换的ΔH 0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正= eV,写出该步骤的化学方程式: 。
5、炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如图所示。活化氧可以快速氧化SO2。下列说法不正确的是( )
A. 每活化一个氧分子吸收0.29eV能量
B. 水可使氧分子活化反应的活化能降低0.18 eV
C. 氧分子的活化是O-O的断裂与
C-O键的生成过程
D. 炭黑颗粒是大气中SO2转化为SO3 的催化剂
A
6、我国科学家在绿色化学领域取得新进展。利用双催化剂Cu和Cu2O,在水溶液中用H原子将CO2高效还原为重要工业原料之一的甲醇,反应机理如下图。下列有关说法不正确的是( )
A. CO2生成甲醇是通过多步还原反应实现的
B. 催化剂Cu结合氢原子,催化剂Cu2O结合含碳微粒
C. 该催化过程中只涉及化学键的形成,未涉及化学键的断裂
D. 有可能通过调控反应条件获得甲醛等有机物
C
第二章 化学反应速率与化学平衡
活化能
高二化学
新人教化学选择性必修一《化学反应原理》
各条件对速率的影响大小是:
催化剂 >> 温度 > 浓度=压强(体积引起浓度改变)。
(不同化学反应)
内因(主要因素)______________
反应物的性质
影响化学反应速率的因素
外因
(同一反应)
温度(T ↑,v↑)
催化剂(加入正催化剂,v↑)
浓度(c ↑,v↑)
压强(有气体参加, P ↑,v↑)
固体表面积(比表面积↑,v↑)
形成原电池(v↑)
反应物的状态
光照、电磁波、超声波、溶剂的性质等
【温故知新】
大量实验证明,温度每升高10 ℃,化学反应速率通常为原来的2-4倍。
【问题】如何解释浓度、压强、温度及催化剂等因素对化学反应速率的影响呢
【微观探析】理论分析,从有效碰撞的角度理解影响化学反应速率的因素
阅读教材P25-26页,回答下列问题:
1、什么是基元反应和反应历程?
2、什么是有效碰撞?发生有效碰撞的条件是什么?
3、什么是活化分子?什么是活化能?在能量反应图里怎么表示活化能?
【学习任务一】认识有效碰撞理论
研究发现,大多数化学反应并不是经过简单碰撞就能完成的,而往往经过多个反应步骤才能实现。
每一步反应都称为基元反应,这两个先后进行的基元反应反映了2HI= H2+ I2 的反应历程。反应历程又称反应机理。
如2HI=H2 + I2 ,实际上是经过下列两步反应完成的:
① 2HI→ H2 + 2I·(自由基) ② 2I· → I2。
有效碰撞
【质疑】基元反应发生的先决条件是反应物分子必须发生碰撞,那么反应物分子发生的每一次碰撞都能发生反应吗?
【学习任务一】认识有效碰撞理论
类比法:借鉴投篮
足够的能量 +合适的取向
有效碰撞:
【学习任务一】认识有效碰撞理论
活化分子具有的平均能量与反应物分子具有的平均能量之差
如图2-3所示,
E1表示反应的活化能,
E2 表示活化分子变成生成物分子放出的能量,
E1-E2 表示反应热。
活化分子:
活化能:
具有足够的能量发生有效碰撞的分子
活化能
活化分子变成生成物放出的能量
【学习任务一】认识有效碰撞理论
【质疑】反应物分子都可以发生发生有效碰撞吗?
一个反应要发生一般经历
哪些过程?
普通
分子
活化
分子
有效
碰撞
新物质分子
能量
活化分子百分数:活化分子数/分子总数 ×100%
化学反应速率与活化分子、有效碰撞的关系:
N活化分子 = N总分子× 活化分子%
吸收能量
(活化能)
合理取向的碰撞
单位体积内___________越多(或活化分子的百分数越大)→单位时间内_________次数越多→化学反应速率___________。
构建模型【有效碰撞理论模型】
活化分子数
有效碰撞
越大
对某一化学反应,一定条件下,反应物分子中活化分子的百分数是一定的,单位体积内活化分子的数目与反应物分子的总数成正比。(课本P26最后一段)
【学习任务一】认识有效碰撞理论
请尝试用碰撞理论解释:当其他条件相同时,为什么增大反应物的浓度会使化学反应速率增大,而降低反应物的浓度会使化学反应速率减小
【思考与讨论1】
浓度↑
→单位体积内N总↑
→单位体积内N活↑
→有效碰撞↑
→ v ↑
【学习任务二】应用有效碰撞理论解释浓度、温度、压强等因素对化学反应速率的影响
气体P↑,V体↓,气体浓度↑
即单位体积内反应物分子总数↑
单位体积内
活化分子数↑
有效碰撞次数↑
v ↑
请尝试用碰撞理论解释:当其他条件相同时,为什么增大压强会使化学反应速率增大,而减小压强会使化学反应速率减小
【思考与讨论2】
【学习任务二】应用有效碰撞理论解释浓度、温度、压强等因素对化学反应速率的影响
【思考与讨论3】
请尝试用碰撞理论解释:当其他条件相同时,为什么升高温度会使化学反应速率增大,而降低温度会使化学反应速率减小
温度↑
活化分子百分数↑
运动加快,
碰撞频率↑
有效碰撞
次数↑
v ↑
【学习任务二】应用有效碰撞理论解释浓度、温度、压强等因素对化学反应速率的影响
使用催化剂→降低活化能→大大增加活化分子百分数
→增加有效碰撞几率 →
加快反应速率
【思考与讨论4】
请尝试用碰撞理论解释:当其他条件相同时,为什么加入催化剂会使化学反应速率增大?
催化剂的研究是高科技领域的重要内容。
反应热△H
(不变)
【学习任务二】应用有效碰撞理论解释浓度、温度、压强等因素对化学反应速率的影响
【小结】
影响 外因 单位体积内 活化分子百分数 有效碰撞次数 化学反应速率
分子总数 活化分子数
增大反应物浓度
增大压强
升高温度
正催化剂
增加
增加
增加
加快
增加
增加
增加
加快
不变
增加
增加
加快
影响化学反应速率的因素
不变
增加
增加
加快
不变
不变
增加
增加
活化分子百分数:活化分子数/分子总数 ×100%
【知识拓展】除了改变浓度、温度、压强及选用催化剂等,还有很多改变化学反应速率的方法。例如,通过光辐照、放射线辐照、超声波、电弧、强磁场、高速研磨等。总之,向反应体系输入能量,都有可能改变化学反应速率。
1.在有气体参与的反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是( )
A.增大反应物的浓度 B.降低温度
C.增大压强 D.加入催化剂
B
【学习评价】
课本P28
B
课本P29
b
放热
ΔH
课本P29
Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
催化作用
向盛有PbO2和稀H2SO4混合物的试管中滴加含Fe2+的溶液,振荡使其充分反应,观察现象;再向其中加入Pb,振荡使其充分反应,观察现象。
【高考链接】(2018年全国I卷)采用N2O5为硝化剂是一种新型的绿色硝化技术,在材料、医药等工业中得到广泛应用。回答下列问题:
(3)对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第一步 N2O5 NO2+NO3 快速平衡
第二步 NO2+NO3→NO+NO2+O2 慢反应
第三步 NO+NO3→2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是___________(填标号)。
A. v(第一步的逆反应)>v(第二步反应)
B. 反应的中间产物只有NO3
C. 第二步中NO2与NO3的碰撞仅部分有效
D. 第三步反应活化能较高
AC
活化能越高,速率越低
4、(2019年全国I卷)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用·标注。
可知水煤气变换的ΔH 0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正= eV,写出该步骤的化学方程式: 。
5、炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如图所示。活化氧可以快速氧化SO2。下列说法不正确的是( )
A. 每活化一个氧分子吸收0.29eV能量
B. 水可使氧分子活化反应的活化能降低0.18 eV
C. 氧分子的活化是O-O的断裂与
C-O键的生成过程
D. 炭黑颗粒是大气中SO2转化为SO3 的催化剂
A
6、我国科学家在绿色化学领域取得新进展。利用双催化剂Cu和Cu2O,在水溶液中用H原子将CO2高效还原为重要工业原料之一的甲醇,反应机理如下图。下列有关说法不正确的是( )
A. CO2生成甲醇是通过多步还原反应实现的
B. 催化剂Cu结合氢原子,催化剂Cu2O结合含碳微粒
C. 该催化过程中只涉及化学键的形成,未涉及化学键的断裂
D. 有可能通过调控反应条件获得甲醛等有机物
C
