高中化学苏教版2019必修一 4.2.2 氧化还原反应方程式的配平 课件(15张PPT)
文档属性
| 名称 | 高中化学苏教版2019必修一 4.2.2 氧化还原反应方程式的配平 课件(15张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 727.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-04 22:18:45 | ||
图片预览




文档简介
(共15张PPT)
第2课时
氧化还原反应方程式的配平
第二单元 硫及其化合物的相互转化
专题4 硫与环境保护
问题1:氧化还原反应的概念
问题2:氧化还原反应的特征、实质分别是什么?
问题3:氧化还原反应中遵循哪些规律?
问题4:怎样判断氧化剂、还原剂、氧化产物和还原产物?
问题5:氧化还原反应中电子的转移方向和数目的表示方法
思考:
一、氧化还原反应(复习)
1.概念:___________________________________
2.特征:___________________________________
3.实质:___________________________________
4.规律:___________________、
___________________、
___________________。
有化合价升降变化或电子得失的化学反应
某些元素化合价发生升降变化
发生电子转移
遵循质量守恒
化合价升降总数相等
得失电子守恒
用双线桥法表示下列化学反应的电子转移方向和数目,并指明氧化剂、还原剂、氧化产物和还原产物。
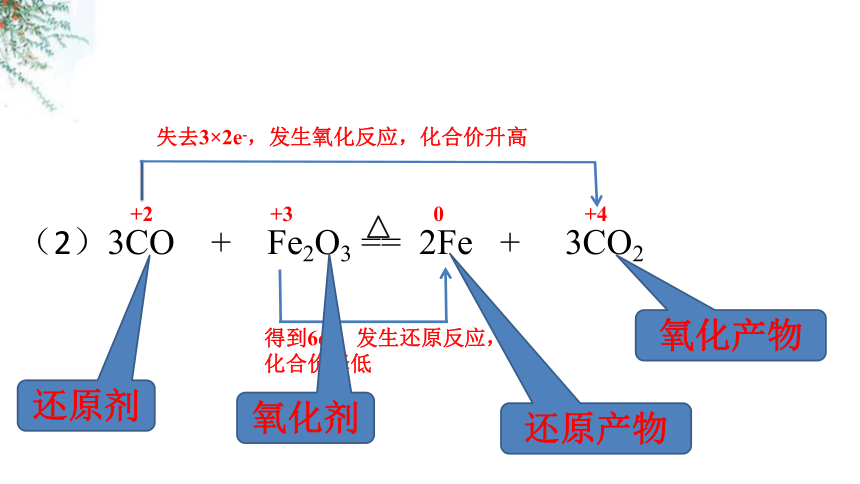
(2)3CO + Fe2O3 == 2Fe + 3CO2
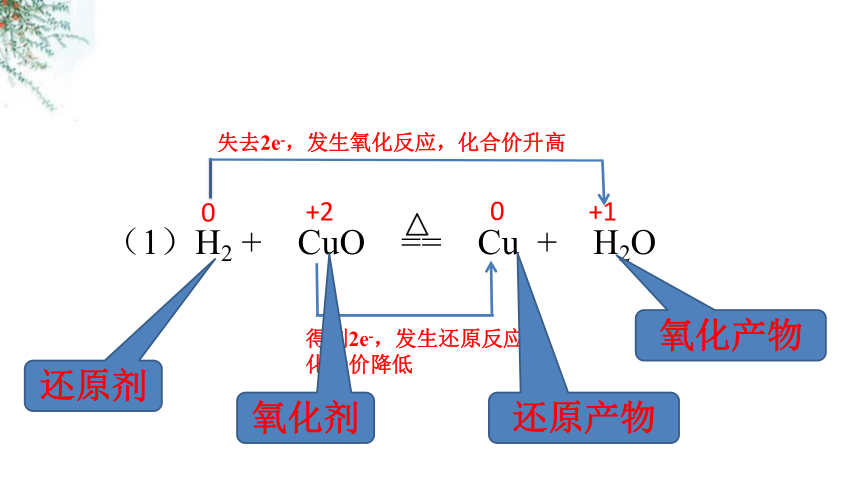
(1)H2 + CuO == Cu + H2O
(1)H2 + CuO == Cu + H2O
0
+2
0
+1
得到2e-,发生还原反应,
化合价降低
失去2e-,发生氧化反应,化合价升高
还原剂
氧化剂
还原产物
氧化产物
(2)3CO + Fe2O3 == 2Fe + 3CO2
+2
+3
0
+4
失去3×2e-,发生氧化反应,化合价升高
得到6e-,发生还原反应,
化合价降低
还原剂
氧化剂
还原产物
氧化产物
二、氧化还原反应方程式配平
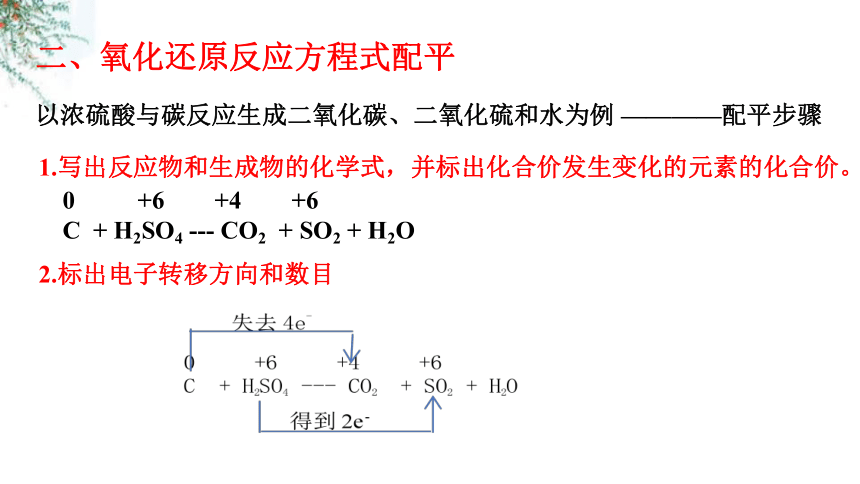
以浓硫酸与碳反应生成二氧化碳、二氧化硫和水为例 ————配平步骤
1.写出反应物和生成物的化学式,并标出化合价发生变化的元素的化合价。
2.标出电子转移方向和数目
0 +6 +4 +6
C + H2SO4 --- CO2 + SO2 + H2O
3.使用得电子总数相等
4.根据质量守恒定律配平其他物质的计量数,并注明气体符号,反应条件,将单线改为双线
学以致用:完成下列化学方程式的书写并配平
1. 二氧化硫和硫化氢(H2S)气体混合,反应生成成硫和水。
_________________________________________________________
2.二氧化硫和氯气同时通入少量水中,反应生成硫成硫酸和盐酸。
_________________________________________________________
SO2 + 2H2S == 3S + 2H2O
SO2 + Cl2 + 2H2O == H2SO4 + 2HCl
1.邻位价态转化规律
(1)-2价是硫元素的最低价态,只有还原性。它与氧化剂反应,其价态一般会升至相邻的价态。如:H2S+2FeCl3===2HCl+2FeCl2+S↓。
(2)能发生自身氧化还原反应,在反应时分别升至和降至与其相邻的价态。如:3S+6KOH===2K2S+K2SO3+3H2O。
(3)中间价态的0和+4价硫,既可以被氧化,也可以被还原。
(4)最高价+6价,只有氧化性,在化学反应中得到电子,化合价降低,一般降到相邻价态。
三、氧化剂和还原剂与化合价的关系
2.氧化剂和还原剂的判断
有多种价态的元素,
(1)高价态的化合物具有氧化性,在氧化还原反应中可作氧化剂;
(2)低价态的化合物具有还原性,在氧化还原反应中可作还原剂;
(3)中间价态的化合物,在不同的化学反应中既表现出氧化性,也可能表现出还原性。
小结:氧化还原反应配平步骤
1.下列化学反应中,不属于氧化还原反应的是( )
A.Mg+2HCl===MgCl2+H2↑
B.2NO+O2===2NO2
C.CuO+H2===Cu+H2O
D.CaCl2+Na2CO3===CaCO3↓+2NaCl
D
跟踪练习
2.下列关于氧化还原反应的说法中正确的是( )
A.氧化还原反应前后元素化合价有升降
B.氧化还原反应前后一定有氧的得失
C.实现Fe3+―→Fe2+的变化过程一定是氧化反应
D.元素化合价升高的反应是还原反应
A
本节内容结束
第2课时
氧化还原反应方程式的配平
第二单元 硫及其化合物的相互转化
专题4 硫与环境保护
问题1:氧化还原反应的概念
问题2:氧化还原反应的特征、实质分别是什么?
问题3:氧化还原反应中遵循哪些规律?
问题4:怎样判断氧化剂、还原剂、氧化产物和还原产物?
问题5:氧化还原反应中电子的转移方向和数目的表示方法
思考:
一、氧化还原反应(复习)
1.概念:___________________________________
2.特征:___________________________________
3.实质:___________________________________
4.规律:___________________、
___________________、
___________________。
有化合价升降变化或电子得失的化学反应
某些元素化合价发生升降变化
发生电子转移
遵循质量守恒
化合价升降总数相等
得失电子守恒
用双线桥法表示下列化学反应的电子转移方向和数目,并指明氧化剂、还原剂、氧化产物和还原产物。
(2)3CO + Fe2O3 == 2Fe + 3CO2
(1)H2 + CuO == Cu + H2O
(1)H2 + CuO == Cu + H2O
0
+2
0
+1
得到2e-,发生还原反应,
化合价降低
失去2e-,发生氧化反应,化合价升高
还原剂
氧化剂
还原产物
氧化产物
(2)3CO + Fe2O3 == 2Fe + 3CO2
+2
+3
0
+4
失去3×2e-,发生氧化反应,化合价升高
得到6e-,发生还原反应,
化合价降低
还原剂
氧化剂
还原产物
氧化产物
二、氧化还原反应方程式配平
以浓硫酸与碳反应生成二氧化碳、二氧化硫和水为例 ————配平步骤
1.写出反应物和生成物的化学式,并标出化合价发生变化的元素的化合价。
2.标出电子转移方向和数目
0 +6 +4 +6
C + H2SO4 --- CO2 + SO2 + H2O
3.使用得电子总数相等
4.根据质量守恒定律配平其他物质的计量数,并注明气体符号,反应条件,将单线改为双线
学以致用:完成下列化学方程式的书写并配平
1. 二氧化硫和硫化氢(H2S)气体混合,反应生成成硫和水。
_________________________________________________________
2.二氧化硫和氯气同时通入少量水中,反应生成硫成硫酸和盐酸。
_________________________________________________________
SO2 + 2H2S == 3S + 2H2O
SO2 + Cl2 + 2H2O == H2SO4 + 2HCl
1.邻位价态转化规律
(1)-2价是硫元素的最低价态,只有还原性。它与氧化剂反应,其价态一般会升至相邻的价态。如:H2S+2FeCl3===2HCl+2FeCl2+S↓。
(2)能发生自身氧化还原反应,在反应时分别升至和降至与其相邻的价态。如:3S+6KOH===2K2S+K2SO3+3H2O。
(3)中间价态的0和+4价硫,既可以被氧化,也可以被还原。
(4)最高价+6价,只有氧化性,在化学反应中得到电子,化合价降低,一般降到相邻价态。
三、氧化剂和还原剂与化合价的关系
2.氧化剂和还原剂的判断
有多种价态的元素,
(1)高价态的化合物具有氧化性,在氧化还原反应中可作氧化剂;
(2)低价态的化合物具有还原性,在氧化还原反应中可作还原剂;
(3)中间价态的化合物,在不同的化学反应中既表现出氧化性,也可能表现出还原性。
小结:氧化还原反应配平步骤
1.下列化学反应中,不属于氧化还原反应的是( )
A.Mg+2HCl===MgCl2+H2↑
B.2NO+O2===2NO2
C.CuO+H2===Cu+H2O
D.CaCl2+Na2CO3===CaCO3↓+2NaCl
D
跟踪练习
2.下列关于氧化还原反应的说法中正确的是( )
A.氧化还原反应前后元素化合价有升降
B.氧化还原反应前后一定有氧的得失
C.实现Fe3+―→Fe2+的变化过程一定是氧化反应
D.元素化合价升高的反应是还原反应
A
本节内容结束
