高中化学苏教版2019必修一 4.3 防治二氧化硫对环境的污染 课件(32张PPT)
文档属性
| 名称 | 高中化学苏教版2019必修一 4.3 防治二氧化硫对环境的污染 课件(32张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 812.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-04 00:00:00 | ||
图片预览










文档简介
(共32张PPT)
第三单元 防治二氧化硫对环境的污染
专题4 硫与环境保护
学习目标
1.了解自然界中硫的循环。
2.了解二氧化硫对大气质量的影响,特别是酸雨的成因、危害及防治措施。
防治二氧化硫对环境的污染
1.自然界中的硫循环
地壳的岩石里、生物体内以及大气与水中都含有_______。随着地壳运动、生
命活动以及大气与水的流动,这些_________不断发生___________,形成了
___________________。
2.酸雨及其治理
(1)SO2的产生
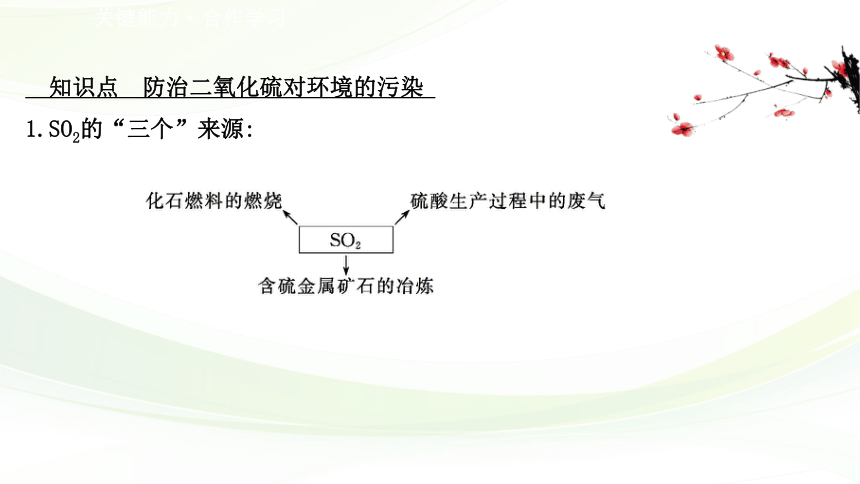
含硫化石燃料_____、含_______________和_____________中均会产生一定量
含二氧化硫的废气,若直接排放空气中,会导致严重的环境问题。
必备知识·自主学习
硫元素
含硫物质
转化和转移
硫在自然界中的循环
燃烧
硫金属矿石冶炼
硫酸生产过程
(2)硫酸型酸雨的形成
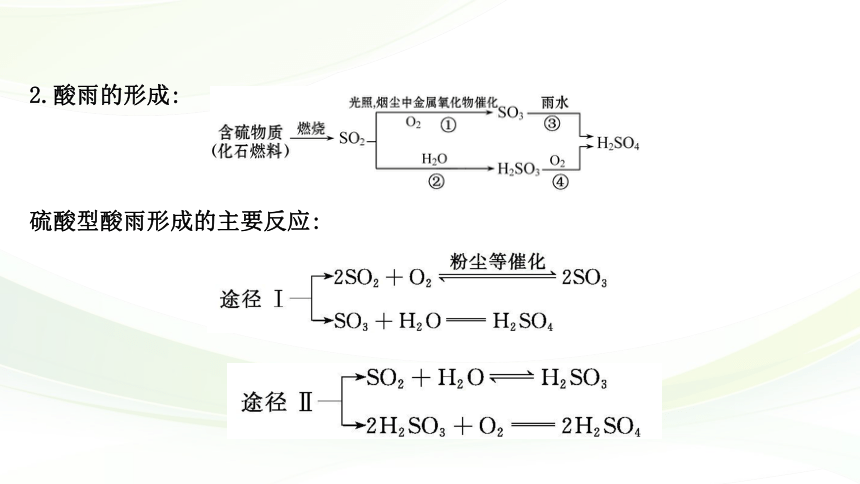
①空气中的SO2被_____吸收,生成_______,_______被___________,形成_______
_____。
②空气中的SO2在_____和___________________等的作用下也可被氧化成_____
_____,_________溶于水生成的_____随雨水降落,形成硫酸型酸雨。酸雨的pH
小于____,对环境造成危害。
(3)酸雨的治理
①治理关键:减少二氧化硫的排放。
降水
亚硫酸
亚硫酸
氧化为硫酸
硫酸型
酸雨
光照
烟尘中的金属氧化物
三氧
化硫
三氧化硫
硫酸
5.6
②治理方法:
一种途径是开发能替代_________的新能源(如氢能、太阳能、核能等),减少
_________的使用。
另一种途径是对含硫燃料预先进行_________,减少_________的排放,并对生产
中产生的_____________进行处理或回收利用。
化石燃料
化石燃料
脱硫处理
二氧化硫
二氧化硫废气
3.空气质量评价
(1)空气质量指数:根据空气中的________________、___________________、
_________、_________、_____和_______________计算出来的数值。空气质
量指数越小,空气质量_____,对人体健康的危害就越小。
(2)空气质量指数的确定:___________的质量指数即为该地区的空气质量指数。
(3)雾霾:___________的颗粒物___________在空中,这些颗粒物___________
_____________形成_____,使空气水平能见度__________,我们把这种空气浑
浊现象叫作雾霾。
细颗粒物(PM2.5)
可吸入颗粒物(PM10)
二氧化硫
二氧化氮
臭氧
一氧化碳的浓度
越好
首要污染物
大量极细微
均匀地悬浮
容易吸附空
气中的水蒸气
雾滴
小于10 km
【自主探索】
(1)硫酸型酸雨放置一段时间后,酸性会增强,其原因是什么
提示:因为SO2溶于水生成H2SO3,H2SO3经长时间放置后会被氧化成硫酸,由于硫酸是强酸,所以该酸雨放置一段时间后酸性增强。
(2)(情境思考)正常雨水的pH是多少 为什么正常的雨水会显酸性
提示:由于雨水中会溶解CO2,正常的雨水pH为5.6,此时雨虽然呈酸性但并不是酸雨。
关键能力·合作学习
知识点 防治二氧化硫对环境的污染
1.SO2的“三个”来源:
2.酸雨的形成:
硫酸型酸雨形成的主要反应:
【合作探究】
二氧化硫造成的大气污染危害巨大,由它形成的酸雨更能危害人体健康及植物
的生长,使土壤酸化、腐蚀建筑物等,必须消除二氧化硫对环境的污染。
(1)石灰石-石膏法是将石灰石粉末制成浆液与烟气充分接触混合并氧化,最终
生成硫酸钙,从而使硫转移到煤渣中。写出此过程发生反应的方程式。(证据推
理与模型认知)
提示:CaCO3+SO2 CaSO3+CO2、2CaSO3+O2 ==== 2CaSO4
△
====
(2)(思维升华)氨水脱硫法是采用喷雾吸收法,雾化的氨水与烟气中的SO2直接接触吸收SO2,写出此过程发生反应的方程式。(宏观辨识与微观探析)。
提示:2NH3+SO2+H2O ==== (NH4)2SO3
2(NH4)2SO3+O2 ==== 2(NH4)2SO4。
(3)(情境应用)如何处理浓硫酸与铜反应的实验中生成的二氧化硫尾气 (科学探究与创新意识)
提示:用碱液吸收。
【典例示范】
【典例】现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下:
分析数据,回答下列问题:
(1)①雨水样品的pH变化的原因是什么
②如何用实验验证①中变化原因
③如果将刚取样的上述雨水和自来水相混合,pH将如何变化 原因是什么
(2)减少酸雨产生的途径有哪些
测试时间/h 0 1 2 3 4
雨水的pH 4.73 4.63 4.56 4.55 4.55
【解析】(1)①酸雨放置时pH变小,其原因是雨水中的H2SO3被空气中氧气氧化所
致:SO2+H2O H2SO3,2H2SO3+O2 ==== 2H2SO4。
②可以通过检验不同时间的雨水中 的浓度大小确定2H2SO3+O2 ==== 2H2SO4
的发生。分别取2 mL 0 h 和3 h的雨水于试管中,加入等量盐酸酸化,再加入等
量足量的BaCl2溶液,盛有3 h的雨水的试管中溶液更浑浊,说明 浓度大。
③雨水和自来水混合,应考虑H2SO3与Cl2(或HClO)的反应:H2SO3+HClO ==== H2SO4
+HCl(或SO2+2H2O+Cl2 ==== H2SO4+2HCl)。因此雨水与自来水混合后溶液
pH将变小。
(2)减少酸雨的产生需减少SO2的排放,将煤转化为清洁能源(如煤的气化和液
化),燃料脱硫、固硫,开发不含硫的新能源(如氢能、核能等),都是有力措施。
答案:(1)①雨水中存在反应SO2+H2O H2SO3,2H2SO3+O2 ==== 2H2SO4,酸性增
强,pH变小
②分别取2 mL 0 h和3 h的雨水于试管中,加入等量盐酸酸化,再加入等量足量
的BaCl2溶液,盛有3 h的雨水的试管中溶液更浑浊,说明 浓度大,说明
2H2SO3+O2 ==== 2H2SO4的发生
③变小;自来水使用Cl2消毒,含有Cl2和HClO,与雨水混合发生反应H2SO3+HClO
==== H2SO4+HCl(或SO2+2H2O+Cl2 ==== H2SO4+2HCl)酸性增强,pH变小
(2) ①少用煤作燃料;②燃料脱硫;③开发新能源
【规律方法】
1.常见环境污染
污染类型 主要污染物 污染物来源
酸雨(pH<5.6) SO2、NO2 化石燃料的燃烧
光化学烟雾 NOx 汽车尾气
臭氧空洞 氟氯烃 冰箱制冷剂
白色污染 聚乙烯、聚氯乙烯 废弃塑料制品
赤潮和水华 含N、P较高的废水 农业、生活废水
居室污染 甲醛、苯、甲苯、氡 建筑、装修材料
雾霾 SO2、NOx以及颗粒物(PM) 颗粒物
2.环境保护
(1)空气质量日报
主要包括“空气质量指数”、“空气质量级别”、“首要污染物”。目前计入的污染物主要是SO2、NOx、一氧化碳、臭氧、固体小颗粒等。
(2)环境保护的措施
①工业废气携带颗粒物的回收利用。
②工业、生活污水经处理达标后排放,限制使用含N、P洗涤剂。
③回收、限制废弃塑料,研制可降解塑料。
【素养训练】
酸雨是指pH小于5.6的雨水,个别地方雨水的pH竟低于2.1(食醋的pH=3)。形成酸雨的原因是大气中含有SO2和氮氧化物。主要来源是煤和石油的燃烧。全世界每年大约有1.5亿吨SO2被排放。
(1)SO2可在空气中受光照被氧化,最终与雨水反应形成酸雨。试写出这两个化学反应方程式: __________________________________________。
(2)酸雨可导致的危害有________________。
A.腐蚀建筑物 B.导致树木枯萎
C.造成洪涝灾害 D.使生态环境恶化
(3)为了减少酸雨的形成,必须对燃料中的硫化物进行____________,对废气中的氮氧化物进行____________。
【解析】SO2在空气中被氧气氧化为SO3,SO3溶于水生成H2SO4;NO2溶于水会生成
HNO3;酸雨会腐蚀建筑物,使树木枯萎、生态环境恶化;为了减少酸雨的形成,必
须进行燃料的脱硫、氮氧化物的碱液吸收等处理,从而减少SO2的排放量。
答案:(1)2SO2+O2 2SO3,SO3+H2O ==== H2SO4
(2)ABD
(3)脱硫处理 碱液吸收
【课堂小结】
三言两语话重点
1.酸雨的形成:
(1)途径1:SO2 H2SO3 H2SO4
(2)途径2:SO2 SO3 H2SO4
2.防治二氧化硫的污染:
(1)开发新能源,减少化石燃料的使用。
(2)减少二氧化硫的排放。
课堂检测·素养达标
1.下列有关环境问题的说法正确的是 ( )
A.燃煤时加入适量石灰石,可减少废气中SO2的量
B.臭氧的体积分数超过10-4%的空气有利于人体健康
C.pH在5.6~7.0的降水通常称为酸雨
D.含磷合成洗涤剂易于被细菌分解,故不会导致水体污染
【解析】选A。臭氧的体积分数超过10-4%开始对人体产生危害,B错误;酸雨的pH小于5.6,C错误;含磷洗涤剂的排放,会使水体富营养化,D错误。
2.(双选)我国南方地区冬季常出现酸性冬雾,酸性冬雾是一种胶体,由于冬雾中溶解了大量燃煤排放的二氧化硫,形成了酸雾雾滴,其酸性比酸雨强得多。下列关于酸雾的说法中不正确的是 ( )
A.燃煤中加碳酸钙可以减轻酸雾的污染
B.酸雾的pH大于5.6
C.酸雾可产生丁达尔效应
D.酸雾不会使呼吸道疾病加重
【解析】选B、D。酸雾的pH应小于5.6;酸雾会使呼吸道疾病加重。
【补偿训练】
1.下表中解决相对应的环境问题所采取的措施不科学的是 ( )
环境问题 措施
A 臭氧空洞 限制氟氯烃类物质的生产量和消耗量
B 酸雨 改变能源结构,减少二氧化硫和氮氧化物的排放量
C 白色污染 回收利用废旧塑料,开发可降解塑料
D 水体富营养化 禁止使用含磷洗衣粉及施用氮肥
【解析】选D。氟氯烃是造成臭氧空洞的主要原因;减少二氧化硫、氮氧化物的排放有利于控制酸雨的产生;对废旧塑料回收利用及开发可降解塑料制品均有利于减少白色污染;禁止施用氮肥不符合农业现状,D不科学。
2.煤炭燃烧时会排放二氧化硫等污染物,为了减少污染物的排放,许多地方都使
用了洁净煤(如脱硫)技术。读煤炭脱硫效率图。
关于洁净煤技术的影响,叙述正确的是 ( )
A.该技术脱硫效率达到100%
B.该技术不能减小酸雨危害
C.该技术使煤炭资源得到了循环利用
D.该技术提高了煤炭资源利用的经济价值
【解析】选D。 洁净煤技术脱硫效率没达到100%,A错误;洁净煤技术可使煤炭燃烧时排放的酸性气体减少,酸雨危害减小,B错误;该技术没有体现煤炭资源的循环利用,但提高了煤炭资源利用的经济价值,C错误,D正确。
3.(教材二次开发·教材习题改编)入冬以来,雾霾天气已经严重影响了我国多数人的正常出行和生活节奏。为改善空气质量而启动的“蓝天工程”得到了全民的支持。下列措施不利于“蓝天工程”建设的是 ( )
A.加高工厂的烟囱,使烟尘和废气远离地表
B.推广使用燃煤脱硫技术,防止SO2污染
C.研制新型高效可充电电池,发展纯电动汽车
D.开发利用绿色能源(例如太阳能)替代化石燃料
【解析】选A。 加高工厂的烟囱,使烟尘和废气远离地表,不能改变空气中污染物的含量,A错误。
【素养新思维】
3.某城市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)PM2.5分散在空气中形成的分散系__________(填“属于”或“不属于”)胶体。
(2)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断待测试样为______(填“酸”或“碱”)性,表示该试样酸碱
性的c(H+)或c(OH-)=______ mol·L-1。
(3)煤燃烧排放的烟气含有SO2和NOx,形成酸雨,污染大气,采用NaClO2溶液在碱
性条件下可对烟气进行脱硫,脱硝,效果非常好。完成下列对烟气脱硝过程的离
子方程式。
____Cl +____NO+__ ====____ Cl-+____ +____
离子 K+ Na+ Cl-
浓度/mol·L-1 4× 10-6 6× 10-6 2× 10-5 4× 10-5 3× 10-5 2×
10-5
【解析】(1)PM2.5的直径小于等于2.5×10-6 m,所以分散在空气中形成的分散
系不属于胶体。
(2)根据电荷守恒得:c(H+)+c(K+)+c(Na+)+c( )=2c( )+c( )+c(Cl-),
将表中数据代入得:c(H+)=10-4 mol·L-1,所以待测试样显酸性。
(3)氮元素化合价从+2价升高到+5价,失去3个电子,氯元素化合价从+3价降低
到-1价,得到4个电子,根据电子得失守恒可知反应的方程式为3Cl +4NO+
4OH- ==== 3Cl-+4 +2H2O。
答案:(1)不属于 (2)酸 10-4 (3)3 4 4OH- 3 4 2H2O
本节内容结束
第三单元 防治二氧化硫对环境的污染
专题4 硫与环境保护
学习目标
1.了解自然界中硫的循环。
2.了解二氧化硫对大气质量的影响,特别是酸雨的成因、危害及防治措施。
防治二氧化硫对环境的污染
1.自然界中的硫循环
地壳的岩石里、生物体内以及大气与水中都含有_______。随着地壳运动、生
命活动以及大气与水的流动,这些_________不断发生___________,形成了
___________________。
2.酸雨及其治理
(1)SO2的产生
含硫化石燃料_____、含_______________和_____________中均会产生一定量
含二氧化硫的废气,若直接排放空气中,会导致严重的环境问题。
必备知识·自主学习
硫元素
含硫物质
转化和转移
硫在自然界中的循环
燃烧
硫金属矿石冶炼
硫酸生产过程
(2)硫酸型酸雨的形成
①空气中的SO2被_____吸收,生成_______,_______被___________,形成_______
_____。
②空气中的SO2在_____和___________________等的作用下也可被氧化成_____
_____,_________溶于水生成的_____随雨水降落,形成硫酸型酸雨。酸雨的pH
小于____,对环境造成危害。
(3)酸雨的治理
①治理关键:减少二氧化硫的排放。
降水
亚硫酸
亚硫酸
氧化为硫酸
硫酸型
酸雨
光照
烟尘中的金属氧化物
三氧
化硫
三氧化硫
硫酸
5.6
②治理方法:
一种途径是开发能替代_________的新能源(如氢能、太阳能、核能等),减少
_________的使用。
另一种途径是对含硫燃料预先进行_________,减少_________的排放,并对生产
中产生的_____________进行处理或回收利用。
化石燃料
化石燃料
脱硫处理
二氧化硫
二氧化硫废气
3.空气质量评价
(1)空气质量指数:根据空气中的________________、___________________、
_________、_________、_____和_______________计算出来的数值。空气质
量指数越小,空气质量_____,对人体健康的危害就越小。
(2)空气质量指数的确定:___________的质量指数即为该地区的空气质量指数。
(3)雾霾:___________的颗粒物___________在空中,这些颗粒物___________
_____________形成_____,使空气水平能见度__________,我们把这种空气浑
浊现象叫作雾霾。
细颗粒物(PM2.5)
可吸入颗粒物(PM10)
二氧化硫
二氧化氮
臭氧
一氧化碳的浓度
越好
首要污染物
大量极细微
均匀地悬浮
容易吸附空
气中的水蒸气
雾滴
小于10 km
【自主探索】
(1)硫酸型酸雨放置一段时间后,酸性会增强,其原因是什么
提示:因为SO2溶于水生成H2SO3,H2SO3经长时间放置后会被氧化成硫酸,由于硫酸是强酸,所以该酸雨放置一段时间后酸性增强。
(2)(情境思考)正常雨水的pH是多少 为什么正常的雨水会显酸性
提示:由于雨水中会溶解CO2,正常的雨水pH为5.6,此时雨虽然呈酸性但并不是酸雨。
关键能力·合作学习
知识点 防治二氧化硫对环境的污染
1.SO2的“三个”来源:
2.酸雨的形成:
硫酸型酸雨形成的主要反应:
【合作探究】
二氧化硫造成的大气污染危害巨大,由它形成的酸雨更能危害人体健康及植物
的生长,使土壤酸化、腐蚀建筑物等,必须消除二氧化硫对环境的污染。
(1)石灰石-石膏法是将石灰石粉末制成浆液与烟气充分接触混合并氧化,最终
生成硫酸钙,从而使硫转移到煤渣中。写出此过程发生反应的方程式。(证据推
理与模型认知)
提示:CaCO3+SO2 CaSO3+CO2、2CaSO3+O2 ==== 2CaSO4
△
====
(2)(思维升华)氨水脱硫法是采用喷雾吸收法,雾化的氨水与烟气中的SO2直接接触吸收SO2,写出此过程发生反应的方程式。(宏观辨识与微观探析)。
提示:2NH3+SO2+H2O ==== (NH4)2SO3
2(NH4)2SO3+O2 ==== 2(NH4)2SO4。
(3)(情境应用)如何处理浓硫酸与铜反应的实验中生成的二氧化硫尾气 (科学探究与创新意识)
提示:用碱液吸收。
【典例示范】
【典例】现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下:
分析数据,回答下列问题:
(1)①雨水样品的pH变化的原因是什么
②如何用实验验证①中变化原因
③如果将刚取样的上述雨水和自来水相混合,pH将如何变化 原因是什么
(2)减少酸雨产生的途径有哪些
测试时间/h 0 1 2 3 4
雨水的pH 4.73 4.63 4.56 4.55 4.55
【解析】(1)①酸雨放置时pH变小,其原因是雨水中的H2SO3被空气中氧气氧化所
致:SO2+H2O H2SO3,2H2SO3+O2 ==== 2H2SO4。
②可以通过检验不同时间的雨水中 的浓度大小确定2H2SO3+O2 ==== 2H2SO4
的发生。分别取2 mL 0 h 和3 h的雨水于试管中,加入等量盐酸酸化,再加入等
量足量的BaCl2溶液,盛有3 h的雨水的试管中溶液更浑浊,说明 浓度大。
③雨水和自来水混合,应考虑H2SO3与Cl2(或HClO)的反应:H2SO3+HClO ==== H2SO4
+HCl(或SO2+2H2O+Cl2 ==== H2SO4+2HCl)。因此雨水与自来水混合后溶液
pH将变小。
(2)减少酸雨的产生需减少SO2的排放,将煤转化为清洁能源(如煤的气化和液
化),燃料脱硫、固硫,开发不含硫的新能源(如氢能、核能等),都是有力措施。
答案:(1)①雨水中存在反应SO2+H2O H2SO3,2H2SO3+O2 ==== 2H2SO4,酸性增
强,pH变小
②分别取2 mL 0 h和3 h的雨水于试管中,加入等量盐酸酸化,再加入等量足量
的BaCl2溶液,盛有3 h的雨水的试管中溶液更浑浊,说明 浓度大,说明
2H2SO3+O2 ==== 2H2SO4的发生
③变小;自来水使用Cl2消毒,含有Cl2和HClO,与雨水混合发生反应H2SO3+HClO
==== H2SO4+HCl(或SO2+2H2O+Cl2 ==== H2SO4+2HCl)酸性增强,pH变小
(2) ①少用煤作燃料;②燃料脱硫;③开发新能源
【规律方法】
1.常见环境污染
污染类型 主要污染物 污染物来源
酸雨(pH<5.6) SO2、NO2 化石燃料的燃烧
光化学烟雾 NOx 汽车尾气
臭氧空洞 氟氯烃 冰箱制冷剂
白色污染 聚乙烯、聚氯乙烯 废弃塑料制品
赤潮和水华 含N、P较高的废水 农业、生活废水
居室污染 甲醛、苯、甲苯、氡 建筑、装修材料
雾霾 SO2、NOx以及颗粒物(PM) 颗粒物
2.环境保护
(1)空气质量日报
主要包括“空气质量指数”、“空气质量级别”、“首要污染物”。目前计入的污染物主要是SO2、NOx、一氧化碳、臭氧、固体小颗粒等。
(2)环境保护的措施
①工业废气携带颗粒物的回收利用。
②工业、生活污水经处理达标后排放,限制使用含N、P洗涤剂。
③回收、限制废弃塑料,研制可降解塑料。
【素养训练】
酸雨是指pH小于5.6的雨水,个别地方雨水的pH竟低于2.1(食醋的pH=3)。形成酸雨的原因是大气中含有SO2和氮氧化物。主要来源是煤和石油的燃烧。全世界每年大约有1.5亿吨SO2被排放。
(1)SO2可在空气中受光照被氧化,最终与雨水反应形成酸雨。试写出这两个化学反应方程式: __________________________________________。
(2)酸雨可导致的危害有________________。
A.腐蚀建筑物 B.导致树木枯萎
C.造成洪涝灾害 D.使生态环境恶化
(3)为了减少酸雨的形成,必须对燃料中的硫化物进行____________,对废气中的氮氧化物进行____________。
【解析】SO2在空气中被氧气氧化为SO3,SO3溶于水生成H2SO4;NO2溶于水会生成
HNO3;酸雨会腐蚀建筑物,使树木枯萎、生态环境恶化;为了减少酸雨的形成,必
须进行燃料的脱硫、氮氧化物的碱液吸收等处理,从而减少SO2的排放量。
答案:(1)2SO2+O2 2SO3,SO3+H2O ==== H2SO4
(2)ABD
(3)脱硫处理 碱液吸收
【课堂小结】
三言两语话重点
1.酸雨的形成:
(1)途径1:SO2 H2SO3 H2SO4
(2)途径2:SO2 SO3 H2SO4
2.防治二氧化硫的污染:
(1)开发新能源,减少化石燃料的使用。
(2)减少二氧化硫的排放。
课堂检测·素养达标
1.下列有关环境问题的说法正确的是 ( )
A.燃煤时加入适量石灰石,可减少废气中SO2的量
B.臭氧的体积分数超过10-4%的空气有利于人体健康
C.pH在5.6~7.0的降水通常称为酸雨
D.含磷合成洗涤剂易于被细菌分解,故不会导致水体污染
【解析】选A。臭氧的体积分数超过10-4%开始对人体产生危害,B错误;酸雨的pH小于5.6,C错误;含磷洗涤剂的排放,会使水体富营养化,D错误。
2.(双选)我国南方地区冬季常出现酸性冬雾,酸性冬雾是一种胶体,由于冬雾中溶解了大量燃煤排放的二氧化硫,形成了酸雾雾滴,其酸性比酸雨强得多。下列关于酸雾的说法中不正确的是 ( )
A.燃煤中加碳酸钙可以减轻酸雾的污染
B.酸雾的pH大于5.6
C.酸雾可产生丁达尔效应
D.酸雾不会使呼吸道疾病加重
【解析】选B、D。酸雾的pH应小于5.6;酸雾会使呼吸道疾病加重。
【补偿训练】
1.下表中解决相对应的环境问题所采取的措施不科学的是 ( )
环境问题 措施
A 臭氧空洞 限制氟氯烃类物质的生产量和消耗量
B 酸雨 改变能源结构,减少二氧化硫和氮氧化物的排放量
C 白色污染 回收利用废旧塑料,开发可降解塑料
D 水体富营养化 禁止使用含磷洗衣粉及施用氮肥
【解析】选D。氟氯烃是造成臭氧空洞的主要原因;减少二氧化硫、氮氧化物的排放有利于控制酸雨的产生;对废旧塑料回收利用及开发可降解塑料制品均有利于减少白色污染;禁止施用氮肥不符合农业现状,D不科学。
2.煤炭燃烧时会排放二氧化硫等污染物,为了减少污染物的排放,许多地方都使
用了洁净煤(如脱硫)技术。读煤炭脱硫效率图。
关于洁净煤技术的影响,叙述正确的是 ( )
A.该技术脱硫效率达到100%
B.该技术不能减小酸雨危害
C.该技术使煤炭资源得到了循环利用
D.该技术提高了煤炭资源利用的经济价值
【解析】选D。 洁净煤技术脱硫效率没达到100%,A错误;洁净煤技术可使煤炭燃烧时排放的酸性气体减少,酸雨危害减小,B错误;该技术没有体现煤炭资源的循环利用,但提高了煤炭资源利用的经济价值,C错误,D正确。
3.(教材二次开发·教材习题改编)入冬以来,雾霾天气已经严重影响了我国多数人的正常出行和生活节奏。为改善空气质量而启动的“蓝天工程”得到了全民的支持。下列措施不利于“蓝天工程”建设的是 ( )
A.加高工厂的烟囱,使烟尘和废气远离地表
B.推广使用燃煤脱硫技术,防止SO2污染
C.研制新型高效可充电电池,发展纯电动汽车
D.开发利用绿色能源(例如太阳能)替代化石燃料
【解析】选A。 加高工厂的烟囱,使烟尘和废气远离地表,不能改变空气中污染物的含量,A错误。
【素养新思维】
3.某城市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)PM2.5分散在空气中形成的分散系__________(填“属于”或“不属于”)胶体。
(2)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断待测试样为______(填“酸”或“碱”)性,表示该试样酸碱
性的c(H+)或c(OH-)=______ mol·L-1。
(3)煤燃烧排放的烟气含有SO2和NOx,形成酸雨,污染大气,采用NaClO2溶液在碱
性条件下可对烟气进行脱硫,脱硝,效果非常好。完成下列对烟气脱硝过程的离
子方程式。
____Cl +____NO+__ ====____ Cl-+____ +____
离子 K+ Na+ Cl-
浓度/mol·L-1 4× 10-6 6× 10-6 2× 10-5 4× 10-5 3× 10-5 2×
10-5
【解析】(1)PM2.5的直径小于等于2.5×10-6 m,所以分散在空气中形成的分散
系不属于胶体。
(2)根据电荷守恒得:c(H+)+c(K+)+c(Na+)+c( )=2c( )+c( )+c(Cl-),
将表中数据代入得:c(H+)=10-4 mol·L-1,所以待测试样显酸性。
(3)氮元素化合价从+2价升高到+5价,失去3个电子,氯元素化合价从+3价降低
到-1价,得到4个电子,根据电子得失守恒可知反应的方程式为3Cl +4NO+
4OH- ==== 3Cl-+4 +2H2O。
答案:(1)不属于 (2)酸 10-4 (3)3 4 4OH- 3 4 2H2O
本节内容结束
