高中化学苏教版2019必修一 5.2.2 共价键 课件(70张PPT)
文档属性
| 名称 | 高中化学苏教版2019必修一 5.2.2 共价键 课件(70张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-04 00:00:00 | ||
图片预览









文档简介
(共70张PPT)
第2课时 共价键
专题5 微观结构与物质的多样性
第二单元 微粒之间的相互作用力
学习目标
1.了解共价键、共价化合物的概念,会用电子式表示共价键的行成过程。
2.会识别判断共价化合物,熟知分子结构不同的表示方法。
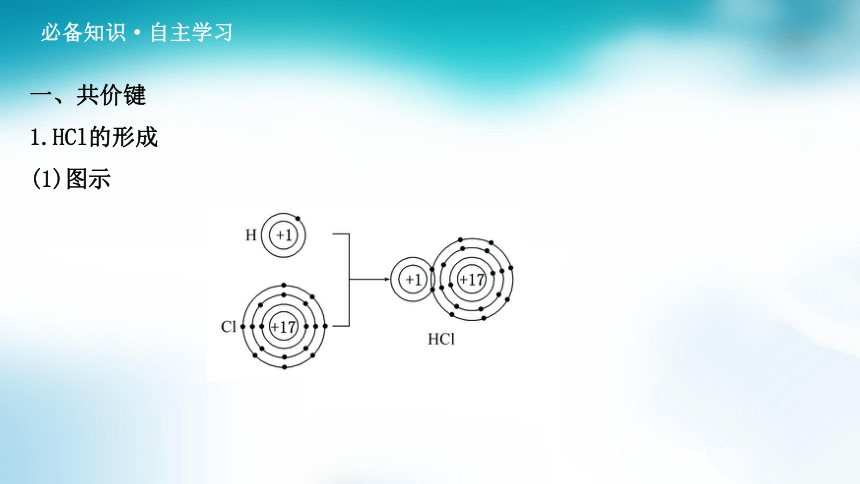
一、共价键
1.HCl的形成
(1)图示
必备知识·自主学习
(2)分析
氢原子、氯原子各提供1个电子组成___________,从而使各原子的最外层都___
___________________。
共用电子对
形
成稳定的电子层结构
2.共价键
(1)概念:原子间通过___________所形成的强烈的相互作用。
(2)成键三要素
①成键微粒:_____;
②成键本质:___________;
③成键元素:一般是同种或不同种非金属元素。
共用电子对
原子
共用电子对
3.共价化合物
(1)概念:以___________形成的化合物。
(2)四类常见的共价化合物
①非金属氢化物:如HCl、H2O等;
②非金属氧化物:如CO2、SO3等;
③含氧酸:如H2SO4、HNO3等;
④大多数有机化合物:如甲烷、酒精等。
共用电子对
4.共价分子的表示方法—电子式
(1)共用电子对标在成键两原子之间,且每个原子的最外层电子都标出,即使有
相同的原子也不能合并。
(2)写双原子分子的非金属单质的电子式时,注意共用电子对的数目和表示方
法。
【自主探索】
1.含共价键的物质一定是共价化合物吗
提示:不一定。如非金属单质(O2、N2等)中含有共价键,但不属于化合物;某些离子化合物(如NaOH、NH4Cl等)中既含离子键,也含共价键。
2.(知识关联)根据电离方程式:HCl====H++Cl-,能否判断HCl分子中存在离子键
提示:不能。氯化氢属于共价化合物,分子中没有离子键。
二、物质结构的表示
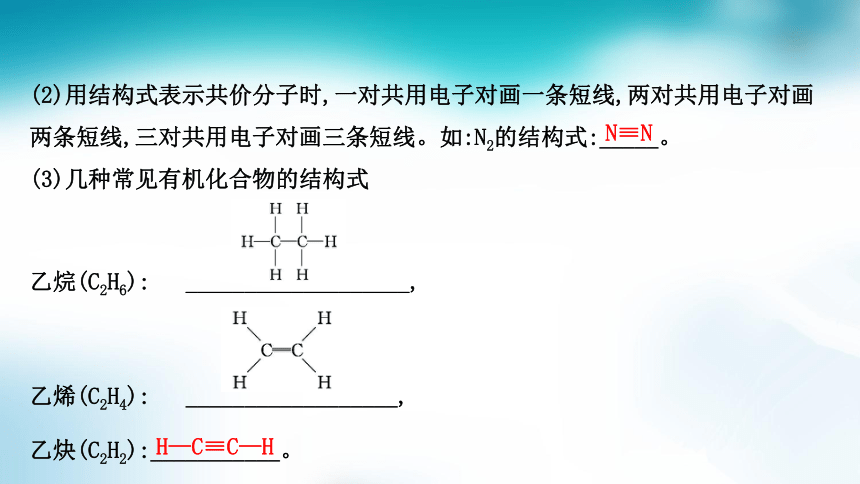
1.结构式
(1)结构式:就是把电子式中___________________________________,未成键电
子省略不写,如Cl—Cl、
O=C=O、 等。
原子间的一条短线表示一对共用电子对
(2)用结构式表示共价分子时,一对共用电子对画一条短线,两对共用电子对画
两条短线,三对共用电子对画三条短线。如:N2的结构式:_____。
(3)几种常见有机化合物的结构式
乙烷(C2H6): ___________________,
乙烯(C2H4): __________________,
乙炔(C2H2):___________。
N≡N
H—C≡C—H
2.球棍模型:用球表示原子(可用不同颜色或大小的球来区别不同的原子),用棍表示共价键(单、双、三键),通过球和棍连接反映分子结构的模型叫球棍模型。
3.空间填充模型:按照合适的比例,以不同大小的球表示不同的原子,真实地表示原子的空间位置关系和分子的结构的模型称为空间填充模型。
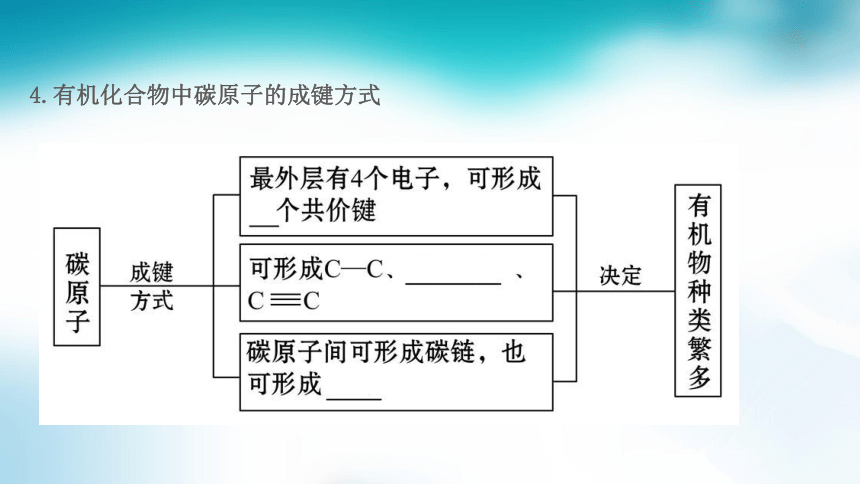
4.有机化合物中碳原子的成键方式
【自主探索】
判断正误,正确的打“√”,错误的打“×”。
(1)Na+的结构示意图为 。 ( )
提示:×。Na+的结构示意图为 。
(2)甲烷分子的空间填充模型为 。 ( )
提示:√。甲烷分子中含有4个碳氢键,碳原子半径大于氢原子,空间构型为正四
面体形,空间填充模型为 。
三、分子间作用力 氢键
1.分子间作用力
(1)定义:_________________的作用力。
(2)特点:分子间作用力比化学键弱得多,它主要影响物质的_________________
等物理性质,而化学键主要影响物质的化学性质。
(3)变化规律
一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,
物质的熔、沸点也越高。例如:熔、沸点:I2>Br2>Cl2>F2。
将分子聚集在一起
熔、沸点和溶解性
2.氢键
(1)定义:分子间存在的_______________________。
(2)形成条件
除H外,形成氢键的原子通常是O、F、N。
(3)存在
氢键存在广泛,如DNA分子、醇、羧酸分子、H2O、NH3、HF等分子之间。
(4)主要表现
氢键使物质的熔、沸点升高,对溶解度等产生影响。
一种特殊的分子间作用力
【自主探索】
(1)(思维升华)如图中每条折线表示元素周期表中第ⅣA~ⅦA族中的某一族元
素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是哪种物质
提示:在第ⅣA~ⅦA族元素的氢化物中,NH3、H2O、HF因存在氢键,故沸点异常高,则含a的线为第ⅣA 族元素的氢化物,则a点为SiH4。
(2)(知识关联)稀有气体原子间只存在分子间作用力,不存在化学键,这句话是否正确
提示:正确。稀有气体是单原子分子,其原子就是气体分子,在稀有气体中仅存在着微弱的分子间作用力。
知识点一 共价键
1.共价键、离子键的比较
离子键 共价键
概念 使带相反电荷的阴、阳离 子结合的相互作用 原子间通过共用电子对所形成
的强烈的相互作用
成键微粒 阴、阳离子 原子
成键元素 活泼金属元素和活泼非金属元素(铵盐除外) 大多数为非金属元素
成键实质 阴、阳离子间的电性作用 共用电子对对两原子核产生的
电性作用
关键能力·合作学习
离子键 共价键
存在范围 活泼金属氧化物、强碱、 大多数盐 多数非金属单质、共价化合
物及部分离子化合物
实例 CaCl2、Na2O2、NaOH Cl2、CCl4、NaHCO3
2.常见物质的电子式
(1)非金属单质及共价化合物
(2)含共价键的离子化合物
(3)用电子式表示共价化合物的形成过程
【合作探究】
1.(思维升华)氯化铝的物理性质非常特殊,如氯化铝的熔点为190 ℃(2.02×
103 Pa),但在180 ℃就开始升华。据此判断,氯化铝是共价化合物还是离子化合物,可以证明你的判断正确的实验依据是什么 (宏观辨识与微观探析)
提示:共价化合物 氯化铝在熔融状态下不导电。
2.(知识关联)实验室中的碘升华、溴蒸气被木炭吸附、酒精溶于水、氯化氢气体溶于水时,共价键是否被破坏 (宏观辨识与微观探析)
提示:碘升华、溴蒸气被木炭吸附、酒精溶于水共价键没有被破坏、HCl溶于水电离成H+和Cl-,破坏了共价键。
【典例示范】
【典例】氯水中存在多种微粒,下列有关粒子的表示方法正确的是 ( )
【解题指南】解答本题需注意以下两点:
(1)明确物质的形成过程;
(2)熟记电子式的书写。
【解析】选C。氯气的电子式为 ,A错误;氢氧根离子的电子式为
,B错误;HClO的电子式为 ,D错误。
【方法导引】
常见物质所含的化学键
【母题追问】(1)将Cl2通入石灰乳中制取漂白粉,写出氯化钙的电子式。
提示:
(2)用电子式表示Na2O的形成过程。
提示:
【素养训练】
某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,受热分解产生N2和Na,NaN3属于离子化合物还是共价化合物 并写出N2的电子式。
(2)Fe2O3是主氧化剂,与Na发生置换反应,其还原产物是什么
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O。KClO4含有哪类化学键 并写出K的原子结构示意图。
【解析】(1)NaN3是离子化合物;N2分子内含有三键,氮原子间形成三对共用电子
对,其电子式为 。
(2)Na与Fe2O3发生置换反应,故生成的还原产物为Fe。(3)KClO4是离子化合物,
含有离子键、极性共价键;K属于19号元素,原子结构示意图为 。
答案:(1)离子化合物 (2)Fe
(3)离子键、共价键
知识点二 物质结构的表示
几种常见共价分子结构的多种表示方法:
【合作探究】
(思维升华)下面是一些常见分子的空间填充模型。各物质分子中的共用电子对数目分别是多少 (宏观辨识与微观探析)
提示:3、3、2、4。在共价分子中一对共用电子对形成一个共价键,有几个共价键就有几对共用电子对。各物质分子的电子式和共用电子对数目如表:
【合作探究】
(情境应用)以共价单键相连的非金属单质中,1个原子与相邻原子成键的数目为(8-N)个,N为该非金属元素的族序数,这一现象化学家称为8-N规则。某非金属单质结构如图所示,构成该单质的元素位于第几主族 (科学探究与创新意识)
提示:由图可知,1个该原子与相邻的3个原子形成3个共价键,即8-N=3,N=5,所以构成该单质的元素位于第ⅤA族。
【典例示范】
【典例】原子实是指原子除最外层电子后剩余的部分。下列各图中的大黑点代表短周期元素的原子实,小黑点代表未用于形成共价键的最外层电子,短线代表共价键。下列各图表示的结构与化学式一定不相符的是 ( )
【解题指南】解答本题需注意以下两点:
(1)明确物质的电子式。
(2)理解结构式的含义。
【解析】选C。氯原子最外层有7个电子,只有1个形成了共价键,故SiCl4的正确图示为: 。
【规律方法】物质结构的表示(以乙烯为例)
(1)分子式:C2H4
(2)实验式:CH2
(3)电子式:
(4)结构式:
【母题追问】CS2分子的结构式如何表示
提示:S=C=S。类似于CO2。
【素养训练】
苹果含有少量有害物质氢氰酸。氢氰酸大量沉积在体内,会导致头晕、头痛、呼吸速率加快等症状,严重时可能出现昏迷。但也不必过分担心,苹果中的氢氰酸主要存在于果核,氢氰酸(HCN)分子结构中存在C≡N,氢氰酸属于剧毒类。第二次世界大战期间,纳粹德国常把氰化氢作为毒气室的杀人毒气使用。你能写出氢氰酸的结构式吗
提示:H—C≡N。
知识点三 分子间作用力 氢键
1.化学键、分子间作用力与氢键的比较
化学键 分子间作用力 氢键
概念 物质中直接相邻的原子或离子之间存在的强烈的相互作用 分子间存在着将分子聚集在一起的作用力 某些物质分子间的相互作用(静电作用)
存在 相邻原子(离子)之间 分子间 HF、H2O、NH3、乙醇等分子间
强弱 较强 很弱 比化学键弱,比分子间作用力强
化学键 分子间作用力 氢键
对物质性质的影响 主要影响物质的化学性质 随相对分子质量的增大,熔点、沸点升高 使得物质的熔点、沸点升高,在水中的溶解度增大
2.特点(强度):分子间作用力<氢键<化学键。
【方法指导】
分子间作用力的存在
(1)分子间作用力存在于由某些共价键形成的共价化合物和绝大多数气态、液态、固态非金属单质分子之间。
(2)像离子化合物、二氧化硅、金刚石等由共价键形成的物质,微粒之间不存在分子间作用力。
(3)分子间作用力、氢键不属于化学键。分子间作用力、氢键主要影响物质的物理性质,与物质的化学性质无关。
【合作探究】
1.(思维升华)CO2气体在一定条件下可与金属镁反应,干冰在一定条件下也可以形成CO2气体,这两个变化过程中需要克服的作用力分别是什么 (宏观辨识与微观探析)
提示:化学键、分子间作用力。CO2与金属镁反应是化学变化,需要克服化学键,干冰形成CO2气体是状态之间的转化,仅需要克服分子间作用力。
2.(教材二次开发)乙醇是一种有机物,俗称酒精,化学式为CH3CH2—OH,在常温、常压下是一种易燃、易挥发的无色透明液体,它的水溶液具有酒香的气味,并略带刺激。酒精为什么可以与水以任意比例互溶 (宏观辨识与微观探析)
提示:原因是乙醇的—OH和水分子之间能形成氢键。
【典例示范】
【典例】下列物质内存在分子间作用力的是 ( )
A.CaCl2 B.KOH
C.SO2 D.Na2O
【解题指南】解答本题需注意以下两点:
(1)物质的化合物类型判断;
(2)离子化合物中不存在分子间作用力。
【解析】选C。分子间作用力一般存在于大多数共价化合物和非金属单质的分子之间,SO2是共价化合物,其分子间存在分子间作用力。而另外三个选项均为离子化合物,是以离子键结合的,没有分子间作用力。
【母题追问】CaCl2、SO2在熔化时分别破坏的作用力是什么
提示:化学键、分子间作用力。
【素养训练】
水是生命之源,没有水就没有生命,而硫化氢却杀人于无形。已知水的沸点比硫化氢的要高,H2S的沸点是-60.4 ℃,水的沸点:99.975 ℃。为什么水的沸点比H2S高很多
提示:水分子间除存在分子间作用力之外,还存在氢键。
【课堂小结】
三言两语话重点
(1)物质结构的表示
电子式、结构式、球棍模型、空间填充模型
(2)影响物质的物理性质的两种作用力
分子间作用力、氢键
课堂检测·素养达标
1.(双选)冰晶石(Na3AlF6)常用于电解氧化铝来冶炼铝。冰晶石可由Al(OH)3、
NaCl、CaF2及H2SO4等原料生产。有关化学用语表示错误的是 ( )
A.冰晶石属于共价化合物
B.H2SO4、液态HCl、HNO3、CaCl2分子间存在分子间作用力
C.氯离子的结构示意图:
D.CaF2的电子式:
﹒
﹒
【解析】选A、B。根据冰晶石的化学式Na3AlF6,其属于离子化合物,A错误;CaCl2是离子化合物,不存在分子间作用力,B错误;C、D正确。
【补偿训练】
前中国科学院院长卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成化合物H2NCONH2·H2O2,不但使H2O2稳定下来,而且其结构也没有发生改变,得到了可供衍射实验的单晶体。
已知H2O2的结构式为H—O—O—H,下列说法中不正确的是 ( )
A.H2NCONH2与H2O2是通过氢键结合的
B.H2O2分子的电子式为
C.H2O2既有氧化性又有还原性
D.H2NCONH2·H2O2属于离子化合物
【解析】选D。根据尿素(H2NCONH2)和H2O2形成化合物H2NCONH2·H2O2,且结构没有发生改变,说明H2NCONH2与H2O2不是通过化学键形成的化合物,而是通过氢键结合,A正确;H2O2分子的结构为H—O—O—H,B正确;H2O2中的氧元素为-1价,是-2与0价的中间价态,所以H2O2既有氧化性又有还原性,C正确;H2NCONH2与H2O2都是共价化合物,当形成H2NCONH2·H2O2时,因结构没有发生改变,所以H2NCONH2·H2O2也属于共价化合物,D错误。
2.离子键、共价键、分子间作用力等是构成物质微粒之间的不同作用力。下列物质中只含有上述一种作用力的是 ( )
A.冰 B.氯化钠
C.氢氧化钠 D.碘
【解析】选B。冰含有共价键和分子间作用力,A错误;氯化钠中只含离子键,B正确;氢氧化钠含有离子键和共价键,C错误;碘含有共价键和分子间作用力,D错误。
3.(教材二次开发·教材习题改编)下列说法正确的是 ( )
A.因为水分子内存在氢键,所以水分子非常稳定
B.氢键属于化学键
C.水分子间存在氢键使水分子间作用力增加,导致水的沸点较高
D.水分子之间无分子间作用力,只有氢键
【解析】选C。水分子之间存在分子间作用力,也存在氢键,由于氢键的存在,使得水的沸点较高,化学键是分子内相邻原子或离子之间强烈的相互作用,由于H2O中氢氧共价键较强,故水分子较稳定,氢键不属于化学键。
4.对下列化学用语的理解和描述不正确的是 ( )
A.硼氢化钠(NaBH4)的电子式为
B.水的结构式:H—O—H
C.空间填充模型 表示水分子,不可以表示二氧化碳分子
D.电子式 可以表示羟基,也可表示氢氧根离子
【解析】选D。NaBH4为离子化合物,A正确;水的结构式:H—O—H,B正确;C中的空间填充模型不可以表示二氧化碳分子,C正确;羟基与氢氧根离子的电子式不同,D错误。
【补偿训练】
(1)有下列物质:He、N2、CaO、NH3、Na2S、KOH、NaHCO3。其中:
①只含共价键的是________;
②只含离子键的是________;
③既含有共价键又含有离子键的是________;
④属于共价化合物的是________;
⑤属于离子化合物的是________。
(2)下列变化中,既破坏离子键又破坏共价键的是______。
A.氯化氢溶于水
B.加热氯酸钾使其分解
C.碘溶于CCl4
D.氯化钠溶于水
【解析】(1)N2、NH3分子中只含共价键;CaO、Na2S中只含离子键;KOH、NaHCO3中既含有离子键又含有共价键,He分子中不含化学键。
(2)氯化氢溶于水共价键被破坏;KClO3受热分解破坏离子键和共价键;NaCl溶于水离子键被破坏;I2溶于CCl4后,共价键未被破坏。
答案:(1)①N2、NH3 ②CaO、Na2S ③KOH、NaHCO3 ④NH3 ⑤CaO、Na2S、KOH、NaHCO3
(2)B
素养新思维
5.氢键是除范德华力外的另一种分子间作用力,普遍存在于N、O、F的原子与H原子之间,非金属性越强的原子与氢原子形成氢键越强。氢键可以表示为: “A—H…B—”其中A、B表示N、F、O原子,“—”表示共价键,“…”表示氢键,根据你所学习氢键的知识,请分析下列问题:
(1)在下列几种氢键:①O—H…O;
②N—H…N;③F—H…F;则按氢键由强到弱的顺序是______(填序号);
(2)H2O、H2S与H2Se的结构相似,则H2O、H2S与H2Se的沸点大小顺序为__________, 其判断依据为____________________________。
【解析】(1)非金属性越强的原子形成的氢键越强,所以三种氢键的强弱顺序为③>①>②;
(2)H2O在汽化时需要破坏氢键和分子间作用力,所以沸点最高;H2Se的相对分子质量大于H2S的相对分子质量,其对应的H2Se的分子间作用力大于H2S的分子间作用力,所以H2Se的沸点大于H2S的沸点。
答案:(1)③>①>② (2)H2O>H2Se>H2S
H2O中存在氢键,H2Se的相对分子质量大于H2S的,故沸点:H2O>H2Se>H2S
本节内容结束
第2课时 共价键
专题5 微观结构与物质的多样性
第二单元 微粒之间的相互作用力
学习目标
1.了解共价键、共价化合物的概念,会用电子式表示共价键的行成过程。
2.会识别判断共价化合物,熟知分子结构不同的表示方法。
一、共价键
1.HCl的形成
(1)图示
必备知识·自主学习
(2)分析
氢原子、氯原子各提供1个电子组成___________,从而使各原子的最外层都___
___________________。
共用电子对
形
成稳定的电子层结构
2.共价键
(1)概念:原子间通过___________所形成的强烈的相互作用。
(2)成键三要素
①成键微粒:_____;
②成键本质:___________;
③成键元素:一般是同种或不同种非金属元素。
共用电子对
原子
共用电子对
3.共价化合物
(1)概念:以___________形成的化合物。
(2)四类常见的共价化合物
①非金属氢化物:如HCl、H2O等;
②非金属氧化物:如CO2、SO3等;
③含氧酸:如H2SO4、HNO3等;
④大多数有机化合物:如甲烷、酒精等。
共用电子对
4.共价分子的表示方法—电子式
(1)共用电子对标在成键两原子之间,且每个原子的最外层电子都标出,即使有
相同的原子也不能合并。
(2)写双原子分子的非金属单质的电子式时,注意共用电子对的数目和表示方
法。
【自主探索】
1.含共价键的物质一定是共价化合物吗
提示:不一定。如非金属单质(O2、N2等)中含有共价键,但不属于化合物;某些离子化合物(如NaOH、NH4Cl等)中既含离子键,也含共价键。
2.(知识关联)根据电离方程式:HCl====H++Cl-,能否判断HCl分子中存在离子键
提示:不能。氯化氢属于共价化合物,分子中没有离子键。
二、物质结构的表示
1.结构式
(1)结构式:就是把电子式中___________________________________,未成键电
子省略不写,如Cl—Cl、
O=C=O、 等。
原子间的一条短线表示一对共用电子对
(2)用结构式表示共价分子时,一对共用电子对画一条短线,两对共用电子对画
两条短线,三对共用电子对画三条短线。如:N2的结构式:_____。
(3)几种常见有机化合物的结构式
乙烷(C2H6): ___________________,
乙烯(C2H4): __________________,
乙炔(C2H2):___________。
N≡N
H—C≡C—H
2.球棍模型:用球表示原子(可用不同颜色或大小的球来区别不同的原子),用棍表示共价键(单、双、三键),通过球和棍连接反映分子结构的模型叫球棍模型。
3.空间填充模型:按照合适的比例,以不同大小的球表示不同的原子,真实地表示原子的空间位置关系和分子的结构的模型称为空间填充模型。
4.有机化合物中碳原子的成键方式
【自主探索】
判断正误,正确的打“√”,错误的打“×”。
(1)Na+的结构示意图为 。 ( )
提示:×。Na+的结构示意图为 。
(2)甲烷分子的空间填充模型为 。 ( )
提示:√。甲烷分子中含有4个碳氢键,碳原子半径大于氢原子,空间构型为正四
面体形,空间填充模型为 。
三、分子间作用力 氢键
1.分子间作用力
(1)定义:_________________的作用力。
(2)特点:分子间作用力比化学键弱得多,它主要影响物质的_________________
等物理性质,而化学键主要影响物质的化学性质。
(3)变化规律
一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,
物质的熔、沸点也越高。例如:熔、沸点:I2>Br2>Cl2>F2。
将分子聚集在一起
熔、沸点和溶解性
2.氢键
(1)定义:分子间存在的_______________________。
(2)形成条件
除H外,形成氢键的原子通常是O、F、N。
(3)存在
氢键存在广泛,如DNA分子、醇、羧酸分子、H2O、NH3、HF等分子之间。
(4)主要表现
氢键使物质的熔、沸点升高,对溶解度等产生影响。
一种特殊的分子间作用力
【自主探索】
(1)(思维升华)如图中每条折线表示元素周期表中第ⅣA~ⅦA族中的某一族元
素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是哪种物质
提示:在第ⅣA~ⅦA族元素的氢化物中,NH3、H2O、HF因存在氢键,故沸点异常高,则含a的线为第ⅣA 族元素的氢化物,则a点为SiH4。
(2)(知识关联)稀有气体原子间只存在分子间作用力,不存在化学键,这句话是否正确
提示:正确。稀有气体是单原子分子,其原子就是气体分子,在稀有气体中仅存在着微弱的分子间作用力。
知识点一 共价键
1.共价键、离子键的比较
离子键 共价键
概念 使带相反电荷的阴、阳离 子结合的相互作用 原子间通过共用电子对所形成
的强烈的相互作用
成键微粒 阴、阳离子 原子
成键元素 活泼金属元素和活泼非金属元素(铵盐除外) 大多数为非金属元素
成键实质 阴、阳离子间的电性作用 共用电子对对两原子核产生的
电性作用
关键能力·合作学习
离子键 共价键
存在范围 活泼金属氧化物、强碱、 大多数盐 多数非金属单质、共价化合
物及部分离子化合物
实例 CaCl2、Na2O2、NaOH Cl2、CCl4、NaHCO3
2.常见物质的电子式
(1)非金属单质及共价化合物
(2)含共价键的离子化合物
(3)用电子式表示共价化合物的形成过程
【合作探究】
1.(思维升华)氯化铝的物理性质非常特殊,如氯化铝的熔点为190 ℃(2.02×
103 Pa),但在180 ℃就开始升华。据此判断,氯化铝是共价化合物还是离子化合物,可以证明你的判断正确的实验依据是什么 (宏观辨识与微观探析)
提示:共价化合物 氯化铝在熔融状态下不导电。
2.(知识关联)实验室中的碘升华、溴蒸气被木炭吸附、酒精溶于水、氯化氢气体溶于水时,共价键是否被破坏 (宏观辨识与微观探析)
提示:碘升华、溴蒸气被木炭吸附、酒精溶于水共价键没有被破坏、HCl溶于水电离成H+和Cl-,破坏了共价键。
【典例示范】
【典例】氯水中存在多种微粒,下列有关粒子的表示方法正确的是 ( )
【解题指南】解答本题需注意以下两点:
(1)明确物质的形成过程;
(2)熟记电子式的书写。
【解析】选C。氯气的电子式为 ,A错误;氢氧根离子的电子式为
,B错误;HClO的电子式为 ,D错误。
【方法导引】
常见物质所含的化学键
【母题追问】(1)将Cl2通入石灰乳中制取漂白粉,写出氯化钙的电子式。
提示:
(2)用电子式表示Na2O的形成过程。
提示:
【素养训练】
某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,受热分解产生N2和Na,NaN3属于离子化合物还是共价化合物 并写出N2的电子式。
(2)Fe2O3是主氧化剂,与Na发生置换反应,其还原产物是什么
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O。KClO4含有哪类化学键 并写出K的原子结构示意图。
【解析】(1)NaN3是离子化合物;N2分子内含有三键,氮原子间形成三对共用电子
对,其电子式为 。
(2)Na与Fe2O3发生置换反应,故生成的还原产物为Fe。(3)KClO4是离子化合物,
含有离子键、极性共价键;K属于19号元素,原子结构示意图为 。
答案:(1)离子化合物 (2)Fe
(3)离子键、共价键
知识点二 物质结构的表示
几种常见共价分子结构的多种表示方法:
【合作探究】
(思维升华)下面是一些常见分子的空间填充模型。各物质分子中的共用电子对数目分别是多少 (宏观辨识与微观探析)
提示:3、3、2、4。在共价分子中一对共用电子对形成一个共价键,有几个共价键就有几对共用电子对。各物质分子的电子式和共用电子对数目如表:
【合作探究】
(情境应用)以共价单键相连的非金属单质中,1个原子与相邻原子成键的数目为(8-N)个,N为该非金属元素的族序数,这一现象化学家称为8-N规则。某非金属单质结构如图所示,构成该单质的元素位于第几主族 (科学探究与创新意识)
提示:由图可知,1个该原子与相邻的3个原子形成3个共价键,即8-N=3,N=5,所以构成该单质的元素位于第ⅤA族。
【典例示范】
【典例】原子实是指原子除最外层电子后剩余的部分。下列各图中的大黑点代表短周期元素的原子实,小黑点代表未用于形成共价键的最外层电子,短线代表共价键。下列各图表示的结构与化学式一定不相符的是 ( )
【解题指南】解答本题需注意以下两点:
(1)明确物质的电子式。
(2)理解结构式的含义。
【解析】选C。氯原子最外层有7个电子,只有1个形成了共价键,故SiCl4的正确图示为: 。
【规律方法】物质结构的表示(以乙烯为例)
(1)分子式:C2H4
(2)实验式:CH2
(3)电子式:
(4)结构式:
【母题追问】CS2分子的结构式如何表示
提示:S=C=S。类似于CO2。
【素养训练】
苹果含有少量有害物质氢氰酸。氢氰酸大量沉积在体内,会导致头晕、头痛、呼吸速率加快等症状,严重时可能出现昏迷。但也不必过分担心,苹果中的氢氰酸主要存在于果核,氢氰酸(HCN)分子结构中存在C≡N,氢氰酸属于剧毒类。第二次世界大战期间,纳粹德国常把氰化氢作为毒气室的杀人毒气使用。你能写出氢氰酸的结构式吗
提示:H—C≡N。
知识点三 分子间作用力 氢键
1.化学键、分子间作用力与氢键的比较
化学键 分子间作用力 氢键
概念 物质中直接相邻的原子或离子之间存在的强烈的相互作用 分子间存在着将分子聚集在一起的作用力 某些物质分子间的相互作用(静电作用)
存在 相邻原子(离子)之间 分子间 HF、H2O、NH3、乙醇等分子间
强弱 较强 很弱 比化学键弱,比分子间作用力强
化学键 分子间作用力 氢键
对物质性质的影响 主要影响物质的化学性质 随相对分子质量的增大,熔点、沸点升高 使得物质的熔点、沸点升高,在水中的溶解度增大
2.特点(强度):分子间作用力<氢键<化学键。
【方法指导】
分子间作用力的存在
(1)分子间作用力存在于由某些共价键形成的共价化合物和绝大多数气态、液态、固态非金属单质分子之间。
(2)像离子化合物、二氧化硅、金刚石等由共价键形成的物质,微粒之间不存在分子间作用力。
(3)分子间作用力、氢键不属于化学键。分子间作用力、氢键主要影响物质的物理性质,与物质的化学性质无关。
【合作探究】
1.(思维升华)CO2气体在一定条件下可与金属镁反应,干冰在一定条件下也可以形成CO2气体,这两个变化过程中需要克服的作用力分别是什么 (宏观辨识与微观探析)
提示:化学键、分子间作用力。CO2与金属镁反应是化学变化,需要克服化学键,干冰形成CO2气体是状态之间的转化,仅需要克服分子间作用力。
2.(教材二次开发)乙醇是一种有机物,俗称酒精,化学式为CH3CH2—OH,在常温、常压下是一种易燃、易挥发的无色透明液体,它的水溶液具有酒香的气味,并略带刺激。酒精为什么可以与水以任意比例互溶 (宏观辨识与微观探析)
提示:原因是乙醇的—OH和水分子之间能形成氢键。
【典例示范】
【典例】下列物质内存在分子间作用力的是 ( )
A.CaCl2 B.KOH
C.SO2 D.Na2O
【解题指南】解答本题需注意以下两点:
(1)物质的化合物类型判断;
(2)离子化合物中不存在分子间作用力。
【解析】选C。分子间作用力一般存在于大多数共价化合物和非金属单质的分子之间,SO2是共价化合物,其分子间存在分子间作用力。而另外三个选项均为离子化合物,是以离子键结合的,没有分子间作用力。
【母题追问】CaCl2、SO2在熔化时分别破坏的作用力是什么
提示:化学键、分子间作用力。
【素养训练】
水是生命之源,没有水就没有生命,而硫化氢却杀人于无形。已知水的沸点比硫化氢的要高,H2S的沸点是-60.4 ℃,水的沸点:99.975 ℃。为什么水的沸点比H2S高很多
提示:水分子间除存在分子间作用力之外,还存在氢键。
【课堂小结】
三言两语话重点
(1)物质结构的表示
电子式、结构式、球棍模型、空间填充模型
(2)影响物质的物理性质的两种作用力
分子间作用力、氢键
课堂检测·素养达标
1.(双选)冰晶石(Na3AlF6)常用于电解氧化铝来冶炼铝。冰晶石可由Al(OH)3、
NaCl、CaF2及H2SO4等原料生产。有关化学用语表示错误的是 ( )
A.冰晶石属于共价化合物
B.H2SO4、液态HCl、HNO3、CaCl2分子间存在分子间作用力
C.氯离子的结构示意图:
D.CaF2的电子式:
﹒
﹒
【解析】选A、B。根据冰晶石的化学式Na3AlF6,其属于离子化合物,A错误;CaCl2是离子化合物,不存在分子间作用力,B错误;C、D正确。
【补偿训练】
前中国科学院院长卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成化合物H2NCONH2·H2O2,不但使H2O2稳定下来,而且其结构也没有发生改变,得到了可供衍射实验的单晶体。
已知H2O2的结构式为H—O—O—H,下列说法中不正确的是 ( )
A.H2NCONH2与H2O2是通过氢键结合的
B.H2O2分子的电子式为
C.H2O2既有氧化性又有还原性
D.H2NCONH2·H2O2属于离子化合物
【解析】选D。根据尿素(H2NCONH2)和H2O2形成化合物H2NCONH2·H2O2,且结构没有发生改变,说明H2NCONH2与H2O2不是通过化学键形成的化合物,而是通过氢键结合,A正确;H2O2分子的结构为H—O—O—H,B正确;H2O2中的氧元素为-1价,是-2与0价的中间价态,所以H2O2既有氧化性又有还原性,C正确;H2NCONH2与H2O2都是共价化合物,当形成H2NCONH2·H2O2时,因结构没有发生改变,所以H2NCONH2·H2O2也属于共价化合物,D错误。
2.离子键、共价键、分子间作用力等是构成物质微粒之间的不同作用力。下列物质中只含有上述一种作用力的是 ( )
A.冰 B.氯化钠
C.氢氧化钠 D.碘
【解析】选B。冰含有共价键和分子间作用力,A错误;氯化钠中只含离子键,B正确;氢氧化钠含有离子键和共价键,C错误;碘含有共价键和分子间作用力,D错误。
3.(教材二次开发·教材习题改编)下列说法正确的是 ( )
A.因为水分子内存在氢键,所以水分子非常稳定
B.氢键属于化学键
C.水分子间存在氢键使水分子间作用力增加,导致水的沸点较高
D.水分子之间无分子间作用力,只有氢键
【解析】选C。水分子之间存在分子间作用力,也存在氢键,由于氢键的存在,使得水的沸点较高,化学键是分子内相邻原子或离子之间强烈的相互作用,由于H2O中氢氧共价键较强,故水分子较稳定,氢键不属于化学键。
4.对下列化学用语的理解和描述不正确的是 ( )
A.硼氢化钠(NaBH4)的电子式为
B.水的结构式:H—O—H
C.空间填充模型 表示水分子,不可以表示二氧化碳分子
D.电子式 可以表示羟基,也可表示氢氧根离子
【解析】选D。NaBH4为离子化合物,A正确;水的结构式:H—O—H,B正确;C中的空间填充模型不可以表示二氧化碳分子,C正确;羟基与氢氧根离子的电子式不同,D错误。
【补偿训练】
(1)有下列物质:He、N2、CaO、NH3、Na2S、KOH、NaHCO3。其中:
①只含共价键的是________;
②只含离子键的是________;
③既含有共价键又含有离子键的是________;
④属于共价化合物的是________;
⑤属于离子化合物的是________。
(2)下列变化中,既破坏离子键又破坏共价键的是______。
A.氯化氢溶于水
B.加热氯酸钾使其分解
C.碘溶于CCl4
D.氯化钠溶于水
【解析】(1)N2、NH3分子中只含共价键;CaO、Na2S中只含离子键;KOH、NaHCO3中既含有离子键又含有共价键,He分子中不含化学键。
(2)氯化氢溶于水共价键被破坏;KClO3受热分解破坏离子键和共价键;NaCl溶于水离子键被破坏;I2溶于CCl4后,共价键未被破坏。
答案:(1)①N2、NH3 ②CaO、Na2S ③KOH、NaHCO3 ④NH3 ⑤CaO、Na2S、KOH、NaHCO3
(2)B
素养新思维
5.氢键是除范德华力外的另一种分子间作用力,普遍存在于N、O、F的原子与H原子之间,非金属性越强的原子与氢原子形成氢键越强。氢键可以表示为: “A—H…B—”其中A、B表示N、F、O原子,“—”表示共价键,“…”表示氢键,根据你所学习氢键的知识,请分析下列问题:
(1)在下列几种氢键:①O—H…O;
②N—H…N;③F—H…F;则按氢键由强到弱的顺序是______(填序号);
(2)H2O、H2S与H2Se的结构相似,则H2O、H2S与H2Se的沸点大小顺序为__________, 其判断依据为____________________________。
【解析】(1)非金属性越强的原子形成的氢键越强,所以三种氢键的强弱顺序为③>①>②;
(2)H2O在汽化时需要破坏氢键和分子间作用力,所以沸点最高;H2Se的相对分子质量大于H2S的相对分子质量,其对应的H2Se的分子间作用力大于H2S的分子间作用力,所以H2Se的沸点大于H2S的沸点。
答案:(1)③>①>② (2)H2O>H2Se>H2S
H2O中存在氢键,H2Se的相对分子质量大于H2S的,故沸点:H2O>H2Se>H2S
本节内容结束
