高中化学苏教版2019必修一 3.1.3 氧化还原反应 课件(43张PPT)
文档属性
| 名称 | 高中化学苏教版2019必修一 3.1.3 氧化还原反应 课件(43张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-04 22:25:31 | ||
图片预览











文档简介
(共43张PPT)
专题3 从海水中获得的化学物质
第一单元 氯气及氯的化合物
第3课时 氧化还原反应
学习目标
1.了解氧化还原反应的有关概念。
2.理解氧化还原反应过程中化合价升降与电子转移的关系。
3.会分析电子转移的方向和数目。
4.了解氧化还原反应方程式的配平方法。
1
0
-1
0
+1
知识梳理
1.元素化合价变化与电子转移关系
(2)结论:①氧化还原反应的特征:反应前后元素的________发生了改变。
②氧化还原反应的本质:反应过程中有电子的______,包括电子 的得失和共用电子对的偏移。
化合价
转移
2.氧化还原反应的有关概念
(1)氧化剂和还原剂
氧化
得到电
子
失去电
子
(2)氧化反应和还原反应
失去
还原
得到
氧化
反应物
生成物
相等
价态
3.氧化还原反应电子转移的表示方法
[基础自测]
1.判断正误(正确的打“√”,错误的打“×”)
(1)有化合价变化的反应不一定是氧化还原反应。( )
(2)在HNO3、N2O4、NaNO2、NO、N2和NH4Cl中氮元素的化合价分别为+5、+4、+3、+2、0和-3价。( )
(3)在氧化还原反应中可能只有元素的化合价的升高,而无化合价的降低。( )
(4)氧化还原反应过程中得电子的物质是还原剂,失电子的原子被还原。( )
(5)氧化还原反应时还原剂先失去电子,氧化剂后得到电子。( )
×
×
×
×
√
合作探究
探究点1 氧化还原反应的本质及有关概念判断
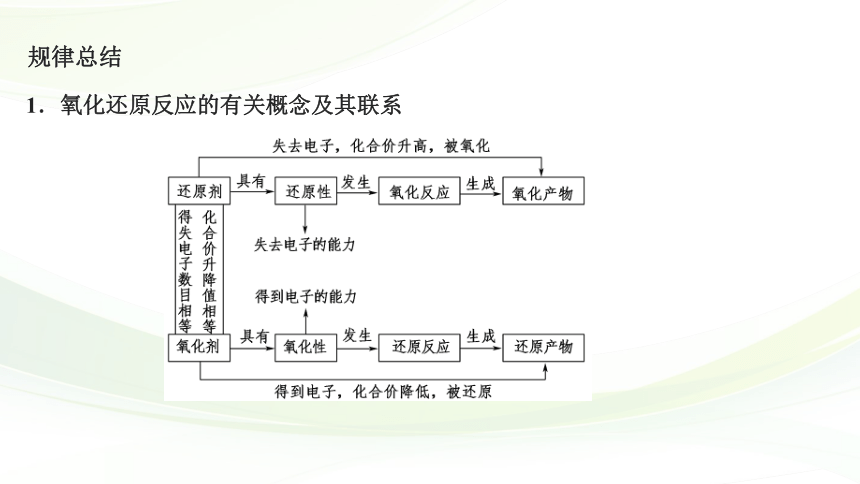
规律总结
1.氧化还原反应的有关概念及其联系
[对点训练]
B
A
规律总结
探究点2 单线桥、双线桥法表示电子转移的方向和数目
[对点训练]
3.下列式子中不正确的是( )
D
【解析】D项中得、失注明错误。
探究点3 氧化还原反应方程式的配平和电子守恒计算
↑ ↓
[典例导航2] 24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的K2Cr2O7溶液完全反应。已知Na2SO3被K2Cr2O7氧化为Na2SO4,则Cr元素在还原产物中的化合价为( )
A.+2价 B.+3价
C.+4价 D.+5价
B
( )
规律总结
↓ ↑
C
当堂检测
【解析】氧化剂在反应时化合价降低。
B
A
【解析】CrO3―→Cr2(SO4)3过程Cr的化合价降低,CrO3作氧化剂,故酒精作还原剂,表现还原性,被氧化,发生氧化反应。
C
D
误区警示
本节内容结束
专题3 从海水中获得的化学物质
第一单元 氯气及氯的化合物
第3课时 氧化还原反应
学习目标
1.了解氧化还原反应的有关概念。
2.理解氧化还原反应过程中化合价升降与电子转移的关系。
3.会分析电子转移的方向和数目。
4.了解氧化还原反应方程式的配平方法。
1
0
-1
0
+1
知识梳理
1.元素化合价变化与电子转移关系
(2)结论:①氧化还原反应的特征:反应前后元素的________发生了改变。
②氧化还原反应的本质:反应过程中有电子的______,包括电子 的得失和共用电子对的偏移。
化合价
转移
2.氧化还原反应的有关概念
(1)氧化剂和还原剂
氧化
得到电
子
失去电
子
(2)氧化反应和还原反应
失去
还原
得到
氧化
反应物
生成物
相等
价态
3.氧化还原反应电子转移的表示方法
[基础自测]
1.判断正误(正确的打“√”,错误的打“×”)
(1)有化合价变化的反应不一定是氧化还原反应。( )
(2)在HNO3、N2O4、NaNO2、NO、N2和NH4Cl中氮元素的化合价分别为+5、+4、+3、+2、0和-3价。( )
(3)在氧化还原反应中可能只有元素的化合价的升高,而无化合价的降低。( )
(4)氧化还原反应过程中得电子的物质是还原剂,失电子的原子被还原。( )
(5)氧化还原反应时还原剂先失去电子,氧化剂后得到电子。( )
×
×
×
×
√
合作探究
探究点1 氧化还原反应的本质及有关概念判断
规律总结
1.氧化还原反应的有关概念及其联系
[对点训练]
B
A
规律总结
探究点2 单线桥、双线桥法表示电子转移的方向和数目
[对点训练]
3.下列式子中不正确的是( )
D
【解析】D项中得、失注明错误。
探究点3 氧化还原反应方程式的配平和电子守恒计算
↑ ↓
[典例导航2] 24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的K2Cr2O7溶液完全反应。已知Na2SO3被K2Cr2O7氧化为Na2SO4,则Cr元素在还原产物中的化合价为( )
A.+2价 B.+3价
C.+4价 D.+5价
B
( )
规律总结
↓ ↑
C
当堂检测
【解析】氧化剂在反应时化合价降低。
B
A
【解析】CrO3―→Cr2(SO4)3过程Cr的化合价降低,CrO3作氧化剂,故酒精作还原剂,表现还原性,被氧化,发生氧化反应。
C
D
误区警示
本节内容结束
