【备考2023】华师大版科学中考一轮复习过关题:化学计算(含解析)
文档属性
| 名称 | 【备考2023】华师大版科学中考一轮复习过关题:化学计算(含解析) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-08-06 00:00:00 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
初中化学计算综合练习
1.在科技创新课上,小丽在10g高锰酸钾,加热后剩余固体质量为9g,再往试管中加入5g氯酸钾,继续加热后,试管中剩余固体13g,则生成氧气的总质量为( )
A.8g B.4g C.3g D.2g
2.将A、B、C三种物质各16g混合加热,充分反应后混合物中有12gA、27g C和一定质量的D.如果A、B、C、D各物质的相对分子质量分别为16、32、44、18,该反应的化学方程式为( )
A.2A+B═C+2D B.A+2B═C+2D C.2A+B═2C+D D.A+B═C+D
3.如图表示一定质量的KClO3和MnO2固体混合物受热过程中,某变量随时间的变化趋势,纵坐标y可以表示( )
A.固体中氧元素的质量
B.固体中MnO2的质量
C.生成O2的质量
D.固体中钾元素的质量分数
4.有一在空气中暴露过的KOH样品,经分析测知其含水7.62%,含K2CO32.38%,KOH 90%,若将此样品加入10g 20%的盐酸中,再用10.2%的KOH溶液中和过量的酸,则蒸发中和后的溶液所得固体的质量约为( )
A.3.4g B.4.1g C.4.5g D.无法计算
5.小明在加热高锰酸钾制取氧气时绘制了如图的图象,y可以表示( )
A.生成氧气的总质量 B.生成二氧化锰的质量
C.固体物质的总质量 D.固体中钾元素的质量
6.在一个密闭容器中,有甲、乙、丙、丁四种物质,在一定条件下发生反应,测得反应前后各物质的质量如下表。下列说法不正确的是( )
物质 甲 乙 丙 丁
反应前的质量/g 40 90 10 3
反应后的质量/g 12 19 10 x
A.x=102
B.丁一定是化合物
C.丙可能为该反应的催化剂
D.参加反应的甲和乙的质量之比为4:9
7.某纯净的有机化合物,在8克纯氧中充分燃烧,生成8.8克二氧化碳和1.8克水,该物质组成中( )
A.一定含有C、H、O三种元素
B.该有机物可能是C2H2
C.一定含有C、H元素,可能含有O元素
D.燃烧过程中消耗了有机物1.6克
8.锌粉、铝粉、铁粉的混合物3.6g与一定量的稀硫酸恰好完全反应生成氢气0.2克,将反应后的溶液蒸发水分,则得固体硫酸锌、硫酸铝、硫酸亚铁的混合物的质量为( )
A.13.2g B.13.4 g C.12 g D.11g
9.小明对一包可能变质的氢氧化钠固体(不含水分等其他杂质)进行了定量实验分析:称取9.3g氢氧化钠固体样品放入锥形瓶中,加入40.7g水,充分振荡,再向锥形瓶中依次滴加25g盐酸溶液充分反应,测得数据和绘制图象如下:
实验序号 1 2 3 4 5
加入盐酸溶液的质量(g) 25 25 25 25 25
锥形瓶中物质的质量(g) 75 100 123.9 147.8 172.8
请根据有关信息回答问题:
(1)a的数值为 。
(2)分析实验数据与图象,小明得出该样品已部分变质的结论,其依据是 。
(3)计算该样品中氢氧化钠的质量分数(结果保留一位小数)。
将a克过氧化氢和b克的二氧化锰混合,使之完全反应;反应方程式为:
2H2O22H2O+O2↑。
(1)若得到水为c克,则可得氧气为 克;
(2)若得到剩余物c克,则可得氧气为 克;
(3)若反应后质量减轻c克,则可得氧气 克。
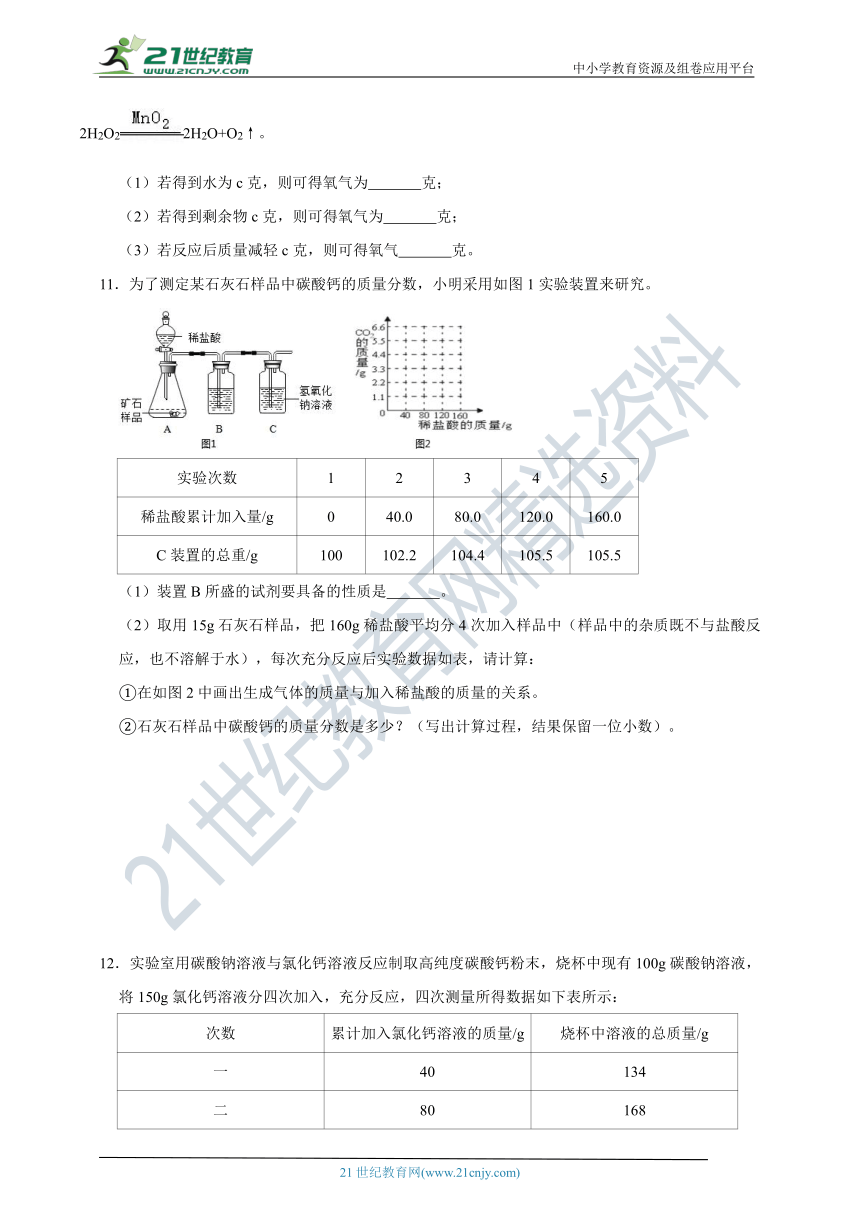
11.为了测定某石灰石样品中碳酸钙的质量分数,小明采用如图1实验装置来研究。
实验次数 1 2 3 4 5
稀盐酸累计加入量/g 0 40.0 80.0 120.0 160.0
C装置的总重/g 100 102.2 104.4 105.5 105.5
(1)装置B所盛的试剂要具备的性质是 。
(2)取用15g石灰石样品,把160g稀盐酸平均分4次加入样品中(样品中的杂质既不与盐酸反应,也不溶解于水),每次充分反应后实验数据如表,请计算:
①在如图2中画出生成气体的质量与加入稀盐酸的质量的关系。
②石灰石样品中碳酸钙的质量分数是多少?(写出计算过程,结果保留一位小数)。
12.实验室用碳酸钠溶液与氯化钙溶液反应制取高纯度碳酸钙粉末,烧杯中现有100g碳酸钠溶液,将150g氯化钙溶液分四次加入,充分反应,四次测量所得数据如下表所示:
次数 累计加入氯化钙溶液的质量/g 烧杯中溶液的总质量/g
一 40 134
二 80 168
三 120 205
四 150 x
(1)第三次测量时,所得溶液中的溶质有 (填化学式)。
(2)表格中x的数值为 。
(3)原100g碳酸钠溶液中所含溶质质量为 。
13.5G通讯需要大量光纤连接各种基站,在光纤的表面涂布Cu﹣Al合金层的金属涂层光纤是其中一种。为测定金属涂层光纤的Cu﹣Al合金层中铝的质量分数,小乐进行了相关实验,测得实验数据如表所示,则:
甲 乙 丙
加入Cu﹣Al合金层样品粉末的质量(g) 10 10 20
加入稀硫酸的质量(g) 100 50 50
烧杯中剩余物的质量(g) 109 59 69
(1)实验中Cu﹣Al合金层样品粉末与稀硫酸恰好完全反应的实验是 (选填“甲”“乙”或“丙”);
(2)该Cu﹣Al合金层样品粉末中铝的质量分数为多少?(写出计算过程)
14.实验室用足量的稀盐酸和大理石制取CO2,为了分析反应后滤液的成分,取100g反应后的滤液,逐滴滴入溶质质量分数为20.0%的Na2CO3溶液,测得滴加溶液的质量与产生沉淀的关系如图。回答下列问题:(已知:CaCl2溶液呈中性)
(1)从开始加入碳酸钠溶液至10g时,没有产生沉淀的原因是 。
(2)计算原滤液中氯化钙的质量。
(3)通过计算求出图中m的大小。
(4)随着滴加Na2CO3溶液质量的增加,烧杯中溶液的pH也呈现一定的变化规律。结合图象判断:b→c段烧杯中溶液pH如何变化? 。
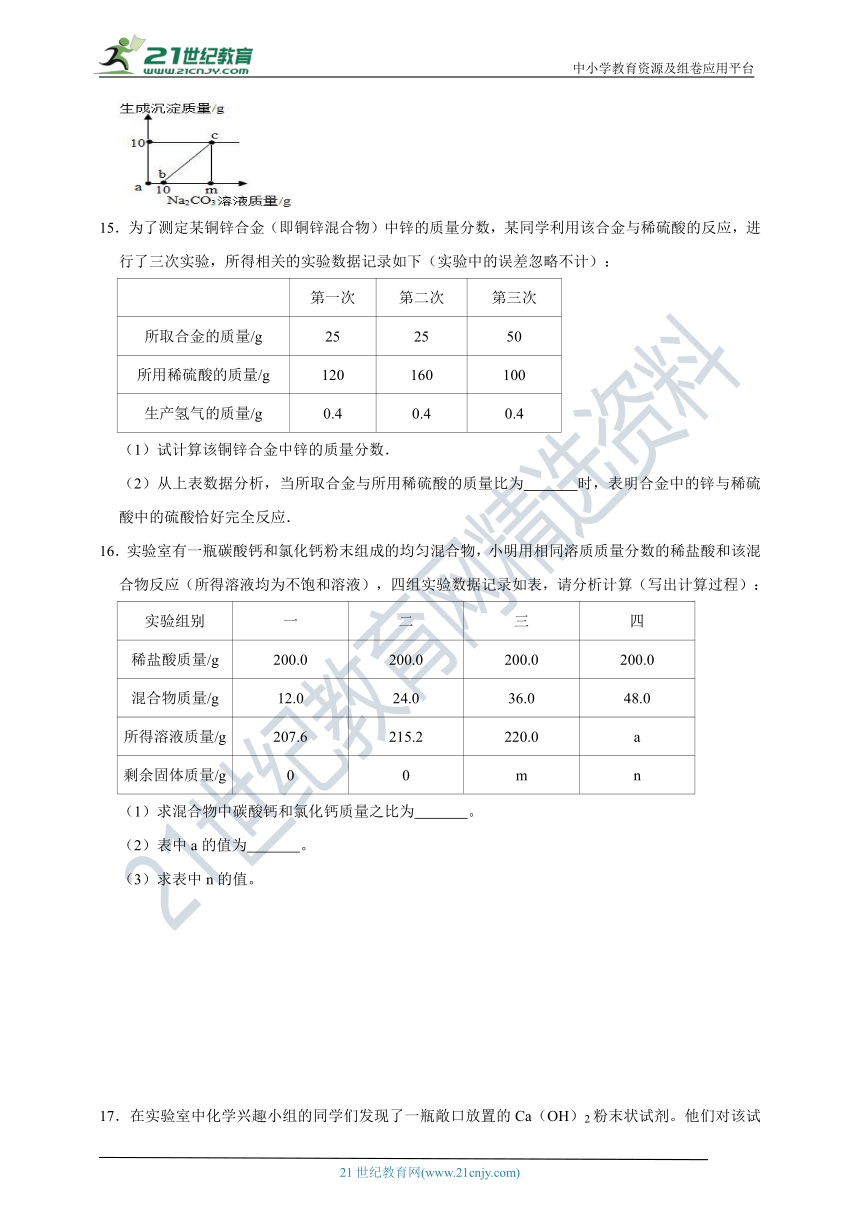
15.为了测定某铜锌合金(即铜锌混合物)中锌的质量分数,某同学利用该合金与稀硫酸的反应,进行了三次实验,所得相关的实验数据记录如下(实验中的误差忽略不计):
第一次 第二次 第三次
所取合金的质量/g 25 25 50
所用稀硫酸的质量/g 120 160 100
生产氢气的质量/g 0.4 0.4 0.4
(1)试计算该铜锌合金中锌的质量分数.
(2)从上表数据分析,当所取合金与所用稀硫酸的质量比为 时,表明合金中的锌与稀硫酸中的硫酸恰好完全反应.
16.实验室有一瓶碳酸钙和氯化钙粉末组成的均匀混合物,小明用相同溶质质量分数的稀盐酸和该混合物反应(所得溶液均为不饱和溶液),四组实验数据记录如表,请分析计算(写出计算过程):
实验组别 一 二 三 四
稀盐酸质量/g 200.0 200.0 200.0 200.0
混合物质量/g 12.0 24.0 36.0 48.0
所得溶液质量/g 207.6 215.2 220.0 a
剩余固体质量/g 0 0 m n
(1)求混合物中碳酸钙和氯化钙质量之比为 。
(2)表中a的值为 。
(3)求表中n的值。
17.在实验室中化学兴趣小组的同学们发现了一瓶敞口放置的Ca(OH)2粉末状试剂。他们对该试剂进行了定量实验分析:称取试剂19.8g放入锥形瓶中,加入30.2g的水,充分振荡,再向锥形瓶中依次滴加25g盐酸,充分反应后。测得部分数据与图象如图所示。
请根据有关信息回答问题。
第1次 第2次 第3次 第4次 第5次 第6次
加入盐酸的质量/g 25 25 25 25 25 25
锥形瓶中物质的质量/g 75 100 a 150 172.8 197.8
(1)a的数值为 。
(2)兴趣小组的同学们通过实验,得出该试剂 (填“是”或“不是”)已部分变质的结论,其依据是 (温馨提示:通过实验数据和图象作出你的判断)。
(3)b的数值为 。
(4)该试剂中氢氧化钙的质量分数为 (不要求计算过程,结果保留一位小数)。
18.为了探究石灰石与稀盐酸反应制备二氧化碳后的废液中的溶质成分,将废液过滤,取滤液20g于烧杯中,在不断振荡的条件下,向其中滴加质量分数为10.6%的碳酸钠溶液直至过量,有关的变化如图所示:根据题中有关信息和图象分析回答下列问题。
(1)原废液中的溶质成分有 (用化学式回答)。
(2)A点处溶液中溶质的质量是多少克?(通过计算回答)
参考答案与试题解析
一.选择题(共8小题)
1.在科技创新课上,小丽在10g高锰酸钾,加热后剩余固体质量为9g,再往试管中加入5g氯酸钾,继续加热后,试管中剩余固体13g,则生成氧气的总质量为( )
A.8g B.4g C.3g D.2g
【解答】解:依据质量守恒定律反应后减小的质量即是生成的氧气的质量,反应时虽经两次加入固体但对整个固体来说减少的质量即是生成氧气的质量,即生成的氧气的质量是(10+5﹣13)g=2g。
故选:D。
2.将A、B、C三种物质各16g混合加热,充分反应后混合物中有12gA、27g C和一定质量的D.如果A、B、C、D各物质的相对分子质量分别为16、32、44、18,该反应的化学方程式为( )
A.2A+B═C+2D B.A+2B═C+2D C.2A+B═2C+D D.A+B═C+D
【解答】解:充分反应后混合物中有12gA、27gC和一定质量的D,说明A是反应物,反应了4g,B是反应物,反应了16g,C是生成物,生成了11g,根据质量守恒定律可知,D是生成物,生成了:4g+16g﹣11g=9g,如果A、B、C、D各物质的相对分子质量分别为16、32、44、18,则A、B、C、D各物质的化学计量数之比为::::=1:2:1:2,即该反应的化学方程式为A+2B═C+2D。
故选:B。
3.如图表示一定质量的KClO3和MnO2固体混合物受热过程中,某变量随时间的变化趋势,纵坐标y可以表示( )
A.固体中氧元素的质量
B.固体中MnO2的质量
C.生成O2的质量
D.固体中钾元素的质量分数
【解答】解:A.反应后生成氧气跑掉,故固体中氧元素的质量从开反应就不断减少,反应停止后不变,由于二氧化锰中也有氧元素,故最后不能为0,故符合该图象正确。
B.二氧化锰在反应中为催化剂,反应前后质量不变,不符合该图象。
C.生成氧气的质量不断增加,不符合该图象。
D.反应前后固体中钾元素的质量不变,固体质量减少,钾元素的质量分数增大,不符合该图象。
故选:A。
4.有一在空气中暴露过的KOH样品,经分析测知其含水7.62%,含K2CO32.38%,KOH 90%,若将此样品加入10g 20%的盐酸中,再用10.2%的KOH溶液中和过量的酸,则蒸发中和后的溶液所得固体的质量约为( )
A.3.4g B.4.1g C.4.5g D.无法计算
【解答】解:因样品中碳酸钾和氢氧化钾能与盐酸反应,过量酸用KOH溶液中和后溶液中的溶质只有氯化钾,
即蒸发中和后的溶液所得固体的质量为氯化钾的质量,设氯化钾的质量为x,
由Cl原子守恒可得,
HCl~KCl
36.5 74.5
10g×20% x
解得x=4.08g≈4.1g,
故选:B。
5.小明在加热高锰酸钾制取氧气时绘制了如图的图象,y可以表示( )
A.生成氧气的总质量 B.生成二氧化锰的质量
C.固体物质的总质量 D.固体中钾元素的质量
【解答】解:A、高锰酸钾在加热条件下生成锰酸钾、二氧化锰和氧气,生成氧气的质量逐渐增加,至完全反应不再发生改变,与图示不符,故选项错误。
B、高锰酸钾在加热条件下生成锰酸钾、二氧化锰和氧气,生成二氧化锰的质量逐渐增加,至完全反应不再发生改变,与图示不符,故选项错误。
C、高锰酸钾在加热条件下生成锰酸钾、二氧化锰和氧气,反应后氧气逸出,固体物质的总质量不断减少,至完全反应不再发生改变,与图示不符,故选项错误。
D、高锰酸钾在加热条件下生成锰酸钾、二氧化锰和氧气,固体中钾元素的质量不变,与图相符,故选项正确。
故选:D。
6.在一个密闭容器中,有甲、乙、丙、丁四种物质,在一定条件下发生反应,测得反应前后各物质的质量如下表。下列说法不正确的是( )
物质 甲 乙 丙 丁
反应前的质量/g 40 90 10 3
反应后的质量/g 12 19 10 x
A.x=102
B.丁一定是化合物
C.丙可能为该反应的催化剂
D.参加反应的甲和乙的质量之比为4:9
【解答】解:由表中数据分析可知,反应前后甲的质量减少了40g﹣12g=28g,故是反应物,参加反应的质量为28g;同理可以确定乙是反应物,生成的质量为90g﹣19g=71g;丙的质量不变,可能作该反应的催化剂,也可能没有参加反应;由质量守恒定律,丁应是生成物,生成的质量为28g+71g=99g,故x的数值为3+99=102。
A、x的数值为3+99=102,故选项说法正确。
B、该反应的反应物为甲和乙,生成物是丁,符合“多变一”的形式,属于化合反应,丁是化合反应的生成物,丁一定是化合物,故选项说法正确。
C、丙的质量不变,可能作该反应的催化剂,也可能没有参加反应,故选项说法正确。
D、参加反应的甲和乙的质量之比28g:71g=28:71,故选项说法错误。
故选:D。
7.某纯净的有机化合物,在8克纯氧中充分燃烧,生成8.8克二氧化碳和1.8克水,该物质组成中( )
A.一定含有C、H、O三种元素
B.该有机物可能是C2H2
C.一定含有C、H元素,可能含有O元素
D.燃烧过程中消耗了有机物1.6克
【解答】解:A、参加反应的化合物的质量为8.8g+1.8g﹣8g=2.6g。8.8gCO2中含有碳元素的质量为:8.8g××100%=2.4g,1.8g水中含有氢元素的质量为:1.8g××100%=0.2g,生成物8.8g二氧化碳和1.8g水中所含碳、氢元素的质量和=2.4g+0.2g=2.6g,2.6g=2.6g,则该化合物中一定含有碳、氢两种元素,一定不含氧元素,故选项说法错误.
B、根据化合物原子的个数比=元素的质量与相对原子质量之比,则该物质分子中碳原子和氢原子的个数比为:=1:1,该有机物可能是C2H2,故选项说法正确。
C、根据A选项的分析,该化合物中一定含有碳、氢两种元素,一定不含氧元素,故选项说法错误。
D、燃烧过程中消耗了有机物2.6克,故选项说法错误。
故选:B。
8.锌粉、铝粉、铁粉的混合物3.6g与一定量的稀硫酸恰好完全反应生成氢气0.2克,将反应后的溶液蒸发水分,则得固体硫酸锌、硫酸铝、硫酸亚铁的混合物的质量为( )
A.13.2g B.13.4 g C.12 g D.11g
【解答】解:根据硫酸的化学式H2SO4,其中氢元素与硫酸根的质量比=2:96=1:48,当硫酸中所含氢元素的质量为0.2g时,硫酸根的质量=0.2g÷=9.6g,则得固体硫酸锌、硫酸铝、硫酸亚铁混合物的质量为:9.6g+3.6g=13.2g。
故选:A。
二.计算题(共10小题)
9.小明对一包可能变质的氢氧化钠固体(不含水分等其他杂质)进行了定量实验分析:称取9.3g氢氧化钠固体样品放入锥形瓶中,加入40.7g水,充分振荡,再向锥形瓶中依次滴加25g盐酸溶液充分反应,测得数据和绘制图象如下:
实验序号 1 2 3 4 5
加入盐酸溶液的质量(g) 25 25 25 25 25
锥形瓶中物质的质量(g) 75 100 123.9 147.8 172.8
请根据有关信息回答问题:
(1)a的数值为 2.2 。
(2)分析实验数据与图象,小明得出该样品已部分变质的结论,其依据是 滴加盐酸至100g时,开始时有二氧化碳生成,证明有碳酸钙存在,之前滴加的盐酸无现象,说明了盐酸与氢氧化钙反应,从而证明氢氧化钙存在 。
(3)计算该样品中氢氧化钠的质量分数(结果保留一位小数)。
【解答】解:(1)由表中的数据可知,第6次加入盐酸的质量就等于锥形瓶增加的质量,说明了第5次加入的盐酸已将碳酸钙完全反应,则生成的二氧化碳的质量:125g+9.3g+40.7g﹣172.8g=2.2g
(2)由实验数据和图象可知,滴加盐酸至100g时,开始时有二氧化碳生成,证明有碳酸钠存在,之前滴加的盐酸无现象,说明了盐酸与氢氧化钠反应,从而证明氢氧化钠存在,据此得出该试剂已部分变质的结论。
(3)设参加反应的碳酸钠质量为x。
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 2.2g
=,
x=5.3g,
氢氧化钠在样品中的质量分数×100%≈43.0%。
答:氢氧化钠的质量分数为43.0%。
故答案为:(1)2.2;
(2)滴加盐酸至100g时,开始时有二氧化碳生成,证明有碳酸钙存在,之前滴加的盐酸无现象,说明了盐酸与氢氧化钙反应,从而证明氢氧化钙存在;
(3)氢氧化钠的质量分数为43.0%。
10.将a克过氧化氢和b克的二氧化锰混合,使之完全反应;反应方程式为:2H2O22H2O+O2↑。
(1)若得到水为c克,则可得氧气为 (a﹣c) 克;
(2)若得到剩余物c克,则可得氧气为 (a+b﹣c) 克;
(3)若反应后质量减轻c克,则可得氧气 c 克。
【解答】解:(1)将a克过氧化氢和b克的二氧化锰混合,使之完全反应,由质量守恒定律,若得到水为c克,则可得氧气为ag﹣cg=(a﹣c)g;
(2)若得到剩余物c克,由质量守恒定律,则可得氧气为ag+bg﹣cg=(a+b﹣c)g。
(3)若反应后质量减轻c克,减少的即为生成氧气的质量,则可得氧气cg。
故答案为:
(1)(a﹣c);
(2)(a+b﹣c);
(3)c。
11.为了测定某石灰石样品中碳酸钙的质量分数,小明采用如图1实验装置来研究。
实验次数 1 2 3 4 5
稀盐酸累计加入量/g 0 40.0 80.0 120.0 160.0
C装置的总重/g 100 102.2 104.4 105.5 105.5
(1)装置B所盛的试剂要具备的性质是 不能和二氧化碳反应,能够吸收水蒸气 。
(2)取用15g石灰石样品,把160g稀盐酸平均分4次加入样品中(样品中的杂质既不与盐酸反应,也不溶解于水),每次充分反应后实验数据如表,请计算:
①在如图2中画出生成气体的质量与加入稀盐酸的质量的关系。
②石灰石样品中碳酸钙的质量分数是多少?(写出计算过程,结果保留一位小数)。
【解答】解:(1)装置B所盛的试剂要具备的性质是不能和二氧化碳反应,能够吸收水蒸气。
故填:不能和二氧化碳反应,能够吸收水蒸气。
(2)①由表中数据可知,40g稀盐酸恰好完全反应时生成2.2g二氧化碳,最终生成二氧化碳质量是5.5g,说明反应的稀盐酸质量是100g,生成气体的质量与加入稀盐酸的质量的关系如下所示:
。
故填:。
②设碳酸钙质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
x 5.5g
=,
x=12.5g,
石灰石样品中碳酸钙的质量分数是:×100%=83.3%,
答:石灰石样品中碳酸钙的质量分数是83.3%。
12.实验室用碳酸钠溶液与氯化钙溶液反应制取高纯度碳酸钙粉末,烧杯中现有100g碳酸钠溶液,将150g氯化钙溶液分四次加入,充分反应,四次测量所得数据如下表所示:
次数 累计加入氯化钙溶液的质量/g 烧杯中溶液的总质量/g
一 40 134
二 80 168
三 120 205
四 150 x
(1)第三次测量时,所得溶液中的溶质有 CaCl2、NaCl (填化学式)。
(2)表格中x的数值为 235g 。
(3)原100g碳酸钠溶液中所含溶质质量为 15.9g 。
【解答】解:(1)由表中的数据可知,每加入40g的氯化钙生成沉淀的质量是6g,第三次总质量减少100g+120g﹣205g=15g<18g,说明了有剩余的氯化钙,溶液中溶质的为:CaCl2、NaCl;
(2)由于上述分析可知,在第三次加入氯化钙时碳酸钠已完全反应,在第四次加入的氯化钙不发生反应,则溶液的质量为:205g+(150g﹣120g)=235g;
(3)设原100g碳酸钠溶液中所含溶质质量为x。
CaCl2+Na2CO3=CaCO3↓+2NaCl
106 100
x 15g
解得:x=15.9g。
故答为:(1)CaCl2、NaCl。
(2)235g。
(3)15.9g。
13.5G通讯需要大量光纤连接各种基站,在光纤的表面涂布Cu﹣Al合金层的金属涂层光纤是其中一种。为测定金属涂层光纤的Cu﹣Al合金层中铝的质量分数,小乐进行了相关实验,测得实验数据如表所示,则:
甲 乙 丙
加入Cu﹣Al合金层样品粉末的质量(g) 10 10 20
加入稀硫酸的质量(g) 100 50 50
烧杯中剩余物的质量(g) 109 59 69
(1)实验中Cu﹣Al合金层样品粉末与稀硫酸恰好完全反应的实验是 乙 (选填“甲”“乙”或“丙”);
(2)该Cu﹣Al合金层样品粉末中铝的质量分数为多少?(写出计算过程)
【解答】解:(1)由实验甲和实验乙对比,可得知10g合金样品粉末全部反应生成了1g氢气,实验乙和实验丙对比,可得知50g稀硫酸全部反应生成了1g氢气。综上所述,实验乙中的两物质恰好完全反应;
(2)设10g合金样品中铝的质量为x
2Al+3H2SO4=Al2(SO4)3+3H2↑
54 6
x 1g
解得:x=9g
该合金样品中铅的质量分数为:×100%=90%
答:该Cu﹣Al合金层样品粉末中铝的质量分数为90%
故答案为:(1)乙。
(2)90%。
14.实验室用足量的稀盐酸和大理石制取CO2,为了分析反应后滤液的成分,取100g反应后的滤液,逐滴滴入溶质质量分数为20.0%的Na2CO3溶液,测得滴加溶液的质量与产生沉淀的关系如图。回答下列问题:(已知:CaCl2溶液呈中性)
(1)从开始加入碳酸钠溶液至10g时,没有产生沉淀的原因是 碳酸钠先与过量的稀盐酸反应,当稀盐酸消耗完后,碳酸钠才与氯化钙反应生成碳酸钙沉淀 。
(2)计算原滤液中氯化钙的质量。
(3)通过计算求出图中m的大小。
(4)随着滴加Na2CO3溶液质量的增加,烧杯中溶液的pH也呈现一定的变化规律。结合图象判断:b→c段烧杯中溶液pH如何变化? 不变 。
【解答】解:(1)碳酸钠先与过量的稀盐酸反应,当稀盐酸消耗完后,碳酸钠才与氯化钙反应生成碳酸钙沉淀;
(2)设生成10g碳酸钙需要氯化钙的质量为x,碳酸钠的质量为y。
Na2CO3+CaCl2=2NaCl+CaCO3↓
106 111 100
x y 10g
x=10.6g
y=11.1g
答:原滤液中氯化钙的质量为11.1g;
(3)与氯化钙反应的碳酸钠溶液的质量为:
10.6g÷20%=53g
m的值为:
10+53=63
答:图中m的值为63;
(4)由于混合溶液中含有盐酸和氯化钙,盐酸先反应掉,所以逐渐滴入碳酸钠溶液的过程中,a→b段杯中溶液的pH有小于7,慢慢变大,后来等于7,b→c段是碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,溶液的pH不变。
故答案为:
(1)碳酸钠先与过量的稀盐酸反应,当稀盐酸消耗完后,碳酸钠才与氯化钙反应生成碳酸钙沉淀;
(2)11.1g;
(3)63;
(4)不变。
15.为了测定某铜锌合金(即铜锌混合物)中锌的质量分数,某同学利用该合金与稀硫酸的反应,进行了三次实验,所得相关的实验数据记录如下(实验中的误差忽略不计):
第一次 第二次 第三次
所取合金的质量/g 25 25 50
所用稀硫酸的质量/g 120 160 100
生产氢气的质量/g 0.4 0.4 0.4
(1)试计算该铜锌合金中锌的质量分数.
(2)从上表数据分析,当所取合金与所用稀硫酸的质量比为 1:4 时,表明合金中的锌与稀硫酸中的硫酸恰好完全反应.
【解答】解:(1)由实验数据可知,25g合金与足量酸反应最多生成0.4g氢气,
设25g合金中锌的质量为x,则
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.4g
解得x=13g,
则铜锌合金中锌的质量分数为×100%=52%,
答:铜锌合金中锌的质量分数为52%;
(2)由实验一和实验三的数据可知,25g合金和100g硫酸都能在反应中生成等质量的氢气,
即25g合金与100g硫酸恰好完全反应,则其质量比为25g:100g=1:4,故答案为:1:4;
16.实验室有一瓶碳酸钙和氯化钙粉末组成的均匀混合物,小明用相同溶质质量分数的稀盐酸和该混合物反应(所得溶液均为不饱和溶液),四组实验数据记录如表,请分析计算(写出计算过程):
实验组别 一 二 三 四
稀盐酸质量/g 200.0 200.0 200.0 200.0
混合物质量/g 12.0 24.0 36.0 48.0
所得溶液质量/g 207.6 215.2 220.0 a
剩余固体质量/g 0 0 m n
(1)求混合物中碳酸钙和氯化钙质量之比为 5:1 。
(2)表中a的值为 222.0 。
(3)求表中n的值。
【解答】解:根据图表中数据分析,每消耗12.0g混合物,溶液增加7.6g,第三组加入混合物36.0g,溶液增加质量为20.0g小于7.6g×3,说明混合物剩余,稀盐酸完全反应;第一、二组稀盐酸还有剩余,故:
(1)由第一组数据可知,二氧化碳的质量为200.0+12.0g﹣207.6g=4.4g
设12.0g混合物中碳酸钙的质量为x。
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
x 4.4g
,
解得x=10.0g
故混合物中碳酸钙和氯化钙质量之比为10.0g:(12.0g﹣10.0g)=5:1;
(2)由于第三组混合物剩余,稀盐酸完全反应;所以第四组比第三组多溶解了48.0g﹣36.0g=12.0g混合物中的氯化钙,12.0g混合物中的氯化钙质量为12.0g﹣10.0g=2.0g,所以a=220.0+2.0=222.0;
(3)第三组中产生二氧化碳的质量为200.0g+36.0g﹣220.0g﹣m=16.0g﹣m。
设反应的碳酸钙的质量为y。
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
y 16.0g﹣m
,
解得y=,
36.0g混合物中的碳酸钙质量为36.0g×=30.0g,所以+m=30.0g,解得m=5.0g。n=5.0+10.0=15.0。
故答案为:(1)5:1;
(2)222.0;
(3)15.0。
17.在实验室中化学兴趣小组的同学们发现了一瓶敞口放置的Ca(OH)2粉末状试剂。他们对该试剂进行了定量实验分析:称取试剂19.8g放入锥形瓶中,加入30.2g的水,充分振荡,再向锥形瓶中依次滴加25g盐酸,充分反应后。测得部分数据与图象如图所示。
请根据有关信息回答问题。
第1次 第2次 第3次 第4次 第5次 第6次
加入盐酸的质量/g 25 25 25 25 25 25
锥形瓶中物质的质量/g 75 100 a 150 172.8 197.8
(1)a的数值为 125 。
(2)兴趣小组的同学们通过实验,得出该试剂 是 (填“是”或“不是”)已部分变质的结论,其依据是 滴加盐酸至100g时,开始时有二氧化碳生成,证明有碳酸钙存在,之前滴加的盐酸无现象,说明了盐酸与氢氧化钙反应,从而证明氢氧化钙存在 (温馨提示:通过实验数据和图象作出你的判断)。
(3)b的数值为 2.2 。
(4)该试剂中氢氧化钙的质量分数为 74.7% (不要求计算过程,结果保留一位小数)。
【解答】解:(1)由表中的数据可知,第1、2、4次加入盐酸的质量就等于锥形瓶中增加的质量,所以第3次加入盐酸后物质的质量就是2次锥形瓶中物质的质量再加上盐酸的质量,故a的值为:100g+25g=125g;
(2)由实验数据和图象可知,滴加盐酸至100g时,开始时有二氧化碳生成,证明有碳酸钙存在,之前滴加的盐酸无现象,说明了盐酸与氢氧化钙反应,从而证明氢氧化钙存在,据此得出该试剂已部分变质的结论。
(3)由表中的数据可知,第6次加入盐酸的质量就等于锥形瓶增加的质量,说明了第5次加入的盐酸已将碳酸钙完全反应,则生成的二氧化碳的质量:150g+25g﹣172.8g=2.2g
(4)设需要碳酸钙的质量为x。
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 2.2g
解得:x=5g
试剂中氢氧化钙的质量分数为:×100%≈74.7%
故答案为:(1)125;
(2)滴加盐酸至100g时,开始时有二氧化碳生成,证明有碳酸钙存在,之前滴加的盐酸无现象,说明了盐酸与氢氧化钙反应,从而证明氢氧化钙存在;
(3)2.2;
(3)答:氢氧化钙的质量分数为74.7%。
18.为了探究石灰石与稀盐酸反应制备二氧化碳后的废液中的溶质成分,将废液过滤,取滤液20g于烧杯中,在不断振荡的条件下,向其中滴加质量分数为10.6%的碳酸钠溶液直至过量,有关的变化如图所示:根据题中有关信息和图象分析回答下列问题。
(1)原废液中的溶质成分有 HCl、CaCl2 (用化学式回答)。
(2)A点处溶液中溶质的质量是多少克?(通过计算回答)
【解答】解:(1)由图中信息可知,加入5g碳酸钠溶液时才开始产生沉淀,说明滤液中含有稀盐酸,因此原废液中的溶质成分有HCl、CaCl2。
故填:HCl、CaCl2。
(2)设反应产生的沉淀的质量为x,
和氯化钙反应的碳酸钠溶液质量为:20g﹣5g=15g,
Na2CO3+CaCl2═CaCO3↓+2NaCl,
106 100
15g×10.6% x
=
x=1.5g,
答:A点处所得沉淀的质量是1.5g。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
初中化学计算综合练习
1.在科技创新课上,小丽在10g高锰酸钾,加热后剩余固体质量为9g,再往试管中加入5g氯酸钾,继续加热后,试管中剩余固体13g,则生成氧气的总质量为( )
A.8g B.4g C.3g D.2g
2.将A、B、C三种物质各16g混合加热,充分反应后混合物中有12gA、27g C和一定质量的D.如果A、B、C、D各物质的相对分子质量分别为16、32、44、18,该反应的化学方程式为( )
A.2A+B═C+2D B.A+2B═C+2D C.2A+B═2C+D D.A+B═C+D
3.如图表示一定质量的KClO3和MnO2固体混合物受热过程中,某变量随时间的变化趋势,纵坐标y可以表示( )
A.固体中氧元素的质量
B.固体中MnO2的质量
C.生成O2的质量
D.固体中钾元素的质量分数
4.有一在空气中暴露过的KOH样品,经分析测知其含水7.62%,含K2CO32.38%,KOH 90%,若将此样品加入10g 20%的盐酸中,再用10.2%的KOH溶液中和过量的酸,则蒸发中和后的溶液所得固体的质量约为( )
A.3.4g B.4.1g C.4.5g D.无法计算
5.小明在加热高锰酸钾制取氧气时绘制了如图的图象,y可以表示( )
A.生成氧气的总质量 B.生成二氧化锰的质量
C.固体物质的总质量 D.固体中钾元素的质量
6.在一个密闭容器中,有甲、乙、丙、丁四种物质,在一定条件下发生反应,测得反应前后各物质的质量如下表。下列说法不正确的是( )
物质 甲 乙 丙 丁
反应前的质量/g 40 90 10 3
反应后的质量/g 12 19 10 x
A.x=102
B.丁一定是化合物
C.丙可能为该反应的催化剂
D.参加反应的甲和乙的质量之比为4:9
7.某纯净的有机化合物,在8克纯氧中充分燃烧,生成8.8克二氧化碳和1.8克水,该物质组成中( )
A.一定含有C、H、O三种元素
B.该有机物可能是C2H2
C.一定含有C、H元素,可能含有O元素
D.燃烧过程中消耗了有机物1.6克
8.锌粉、铝粉、铁粉的混合物3.6g与一定量的稀硫酸恰好完全反应生成氢气0.2克,将反应后的溶液蒸发水分,则得固体硫酸锌、硫酸铝、硫酸亚铁的混合物的质量为( )
A.13.2g B.13.4 g C.12 g D.11g
9.小明对一包可能变质的氢氧化钠固体(不含水分等其他杂质)进行了定量实验分析:称取9.3g氢氧化钠固体样品放入锥形瓶中,加入40.7g水,充分振荡,再向锥形瓶中依次滴加25g盐酸溶液充分反应,测得数据和绘制图象如下:
实验序号 1 2 3 4 5
加入盐酸溶液的质量(g) 25 25 25 25 25
锥形瓶中物质的质量(g) 75 100 123.9 147.8 172.8
请根据有关信息回答问题:
(1)a的数值为 。
(2)分析实验数据与图象,小明得出该样品已部分变质的结论,其依据是 。
(3)计算该样品中氢氧化钠的质量分数(结果保留一位小数)。
将a克过氧化氢和b克的二氧化锰混合,使之完全反应;反应方程式为:
2H2O22H2O+O2↑。
(1)若得到水为c克,则可得氧气为 克;
(2)若得到剩余物c克,则可得氧气为 克;
(3)若反应后质量减轻c克,则可得氧气 克。
11.为了测定某石灰石样品中碳酸钙的质量分数,小明采用如图1实验装置来研究。
实验次数 1 2 3 4 5
稀盐酸累计加入量/g 0 40.0 80.0 120.0 160.0
C装置的总重/g 100 102.2 104.4 105.5 105.5
(1)装置B所盛的试剂要具备的性质是 。
(2)取用15g石灰石样品,把160g稀盐酸平均分4次加入样品中(样品中的杂质既不与盐酸反应,也不溶解于水),每次充分反应后实验数据如表,请计算:
①在如图2中画出生成气体的质量与加入稀盐酸的质量的关系。
②石灰石样品中碳酸钙的质量分数是多少?(写出计算过程,结果保留一位小数)。
12.实验室用碳酸钠溶液与氯化钙溶液反应制取高纯度碳酸钙粉末,烧杯中现有100g碳酸钠溶液,将150g氯化钙溶液分四次加入,充分反应,四次测量所得数据如下表所示:
次数 累计加入氯化钙溶液的质量/g 烧杯中溶液的总质量/g
一 40 134
二 80 168
三 120 205
四 150 x
(1)第三次测量时,所得溶液中的溶质有 (填化学式)。
(2)表格中x的数值为 。
(3)原100g碳酸钠溶液中所含溶质质量为 。
13.5G通讯需要大量光纤连接各种基站,在光纤的表面涂布Cu﹣Al合金层的金属涂层光纤是其中一种。为测定金属涂层光纤的Cu﹣Al合金层中铝的质量分数,小乐进行了相关实验,测得实验数据如表所示,则:
甲 乙 丙
加入Cu﹣Al合金层样品粉末的质量(g) 10 10 20
加入稀硫酸的质量(g) 100 50 50
烧杯中剩余物的质量(g) 109 59 69
(1)实验中Cu﹣Al合金层样品粉末与稀硫酸恰好完全反应的实验是 (选填“甲”“乙”或“丙”);
(2)该Cu﹣Al合金层样品粉末中铝的质量分数为多少?(写出计算过程)
14.实验室用足量的稀盐酸和大理石制取CO2,为了分析反应后滤液的成分,取100g反应后的滤液,逐滴滴入溶质质量分数为20.0%的Na2CO3溶液,测得滴加溶液的质量与产生沉淀的关系如图。回答下列问题:(已知:CaCl2溶液呈中性)
(1)从开始加入碳酸钠溶液至10g时,没有产生沉淀的原因是 。
(2)计算原滤液中氯化钙的质量。
(3)通过计算求出图中m的大小。
(4)随着滴加Na2CO3溶液质量的增加,烧杯中溶液的pH也呈现一定的变化规律。结合图象判断:b→c段烧杯中溶液pH如何变化? 。
15.为了测定某铜锌合金(即铜锌混合物)中锌的质量分数,某同学利用该合金与稀硫酸的反应,进行了三次实验,所得相关的实验数据记录如下(实验中的误差忽略不计):
第一次 第二次 第三次
所取合金的质量/g 25 25 50
所用稀硫酸的质量/g 120 160 100
生产氢气的质量/g 0.4 0.4 0.4
(1)试计算该铜锌合金中锌的质量分数.
(2)从上表数据分析,当所取合金与所用稀硫酸的质量比为 时,表明合金中的锌与稀硫酸中的硫酸恰好完全反应.
16.实验室有一瓶碳酸钙和氯化钙粉末组成的均匀混合物,小明用相同溶质质量分数的稀盐酸和该混合物反应(所得溶液均为不饱和溶液),四组实验数据记录如表,请分析计算(写出计算过程):
实验组别 一 二 三 四
稀盐酸质量/g 200.0 200.0 200.0 200.0
混合物质量/g 12.0 24.0 36.0 48.0
所得溶液质量/g 207.6 215.2 220.0 a
剩余固体质量/g 0 0 m n
(1)求混合物中碳酸钙和氯化钙质量之比为 。
(2)表中a的值为 。
(3)求表中n的值。
17.在实验室中化学兴趣小组的同学们发现了一瓶敞口放置的Ca(OH)2粉末状试剂。他们对该试剂进行了定量实验分析:称取试剂19.8g放入锥形瓶中,加入30.2g的水,充分振荡,再向锥形瓶中依次滴加25g盐酸,充分反应后。测得部分数据与图象如图所示。
请根据有关信息回答问题。
第1次 第2次 第3次 第4次 第5次 第6次
加入盐酸的质量/g 25 25 25 25 25 25
锥形瓶中物质的质量/g 75 100 a 150 172.8 197.8
(1)a的数值为 。
(2)兴趣小组的同学们通过实验,得出该试剂 (填“是”或“不是”)已部分变质的结论,其依据是 (温馨提示:通过实验数据和图象作出你的判断)。
(3)b的数值为 。
(4)该试剂中氢氧化钙的质量分数为 (不要求计算过程,结果保留一位小数)。
18.为了探究石灰石与稀盐酸反应制备二氧化碳后的废液中的溶质成分,将废液过滤,取滤液20g于烧杯中,在不断振荡的条件下,向其中滴加质量分数为10.6%的碳酸钠溶液直至过量,有关的变化如图所示:根据题中有关信息和图象分析回答下列问题。
(1)原废液中的溶质成分有 (用化学式回答)。
(2)A点处溶液中溶质的质量是多少克?(通过计算回答)
参考答案与试题解析
一.选择题(共8小题)
1.在科技创新课上,小丽在10g高锰酸钾,加热后剩余固体质量为9g,再往试管中加入5g氯酸钾,继续加热后,试管中剩余固体13g,则生成氧气的总质量为( )
A.8g B.4g C.3g D.2g
【解答】解:依据质量守恒定律反应后减小的质量即是生成的氧气的质量,反应时虽经两次加入固体但对整个固体来说减少的质量即是生成氧气的质量,即生成的氧气的质量是(10+5﹣13)g=2g。
故选:D。
2.将A、B、C三种物质各16g混合加热,充分反应后混合物中有12gA、27g C和一定质量的D.如果A、B、C、D各物质的相对分子质量分别为16、32、44、18,该反应的化学方程式为( )
A.2A+B═C+2D B.A+2B═C+2D C.2A+B═2C+D D.A+B═C+D
【解答】解:充分反应后混合物中有12gA、27gC和一定质量的D,说明A是反应物,反应了4g,B是反应物,反应了16g,C是生成物,生成了11g,根据质量守恒定律可知,D是生成物,生成了:4g+16g﹣11g=9g,如果A、B、C、D各物质的相对分子质量分别为16、32、44、18,则A、B、C、D各物质的化学计量数之比为::::=1:2:1:2,即该反应的化学方程式为A+2B═C+2D。
故选:B。
3.如图表示一定质量的KClO3和MnO2固体混合物受热过程中,某变量随时间的变化趋势,纵坐标y可以表示( )
A.固体中氧元素的质量
B.固体中MnO2的质量
C.生成O2的质量
D.固体中钾元素的质量分数
【解答】解:A.反应后生成氧气跑掉,故固体中氧元素的质量从开反应就不断减少,反应停止后不变,由于二氧化锰中也有氧元素,故最后不能为0,故符合该图象正确。
B.二氧化锰在反应中为催化剂,反应前后质量不变,不符合该图象。
C.生成氧气的质量不断增加,不符合该图象。
D.反应前后固体中钾元素的质量不变,固体质量减少,钾元素的质量分数增大,不符合该图象。
故选:A。
4.有一在空气中暴露过的KOH样品,经分析测知其含水7.62%,含K2CO32.38%,KOH 90%,若将此样品加入10g 20%的盐酸中,再用10.2%的KOH溶液中和过量的酸,则蒸发中和后的溶液所得固体的质量约为( )
A.3.4g B.4.1g C.4.5g D.无法计算
【解答】解:因样品中碳酸钾和氢氧化钾能与盐酸反应,过量酸用KOH溶液中和后溶液中的溶质只有氯化钾,
即蒸发中和后的溶液所得固体的质量为氯化钾的质量,设氯化钾的质量为x,
由Cl原子守恒可得,
HCl~KCl
36.5 74.5
10g×20% x
解得x=4.08g≈4.1g,
故选:B。
5.小明在加热高锰酸钾制取氧气时绘制了如图的图象,y可以表示( )
A.生成氧气的总质量 B.生成二氧化锰的质量
C.固体物质的总质量 D.固体中钾元素的质量
【解答】解:A、高锰酸钾在加热条件下生成锰酸钾、二氧化锰和氧气,生成氧气的质量逐渐增加,至完全反应不再发生改变,与图示不符,故选项错误。
B、高锰酸钾在加热条件下生成锰酸钾、二氧化锰和氧气,生成二氧化锰的质量逐渐增加,至完全反应不再发生改变,与图示不符,故选项错误。
C、高锰酸钾在加热条件下生成锰酸钾、二氧化锰和氧气,反应后氧气逸出,固体物质的总质量不断减少,至完全反应不再发生改变,与图示不符,故选项错误。
D、高锰酸钾在加热条件下生成锰酸钾、二氧化锰和氧气,固体中钾元素的质量不变,与图相符,故选项正确。
故选:D。
6.在一个密闭容器中,有甲、乙、丙、丁四种物质,在一定条件下发生反应,测得反应前后各物质的质量如下表。下列说法不正确的是( )
物质 甲 乙 丙 丁
反应前的质量/g 40 90 10 3
反应后的质量/g 12 19 10 x
A.x=102
B.丁一定是化合物
C.丙可能为该反应的催化剂
D.参加反应的甲和乙的质量之比为4:9
【解答】解:由表中数据分析可知,反应前后甲的质量减少了40g﹣12g=28g,故是反应物,参加反应的质量为28g;同理可以确定乙是反应物,生成的质量为90g﹣19g=71g;丙的质量不变,可能作该反应的催化剂,也可能没有参加反应;由质量守恒定律,丁应是生成物,生成的质量为28g+71g=99g,故x的数值为3+99=102。
A、x的数值为3+99=102,故选项说法正确。
B、该反应的反应物为甲和乙,生成物是丁,符合“多变一”的形式,属于化合反应,丁是化合反应的生成物,丁一定是化合物,故选项说法正确。
C、丙的质量不变,可能作该反应的催化剂,也可能没有参加反应,故选项说法正确。
D、参加反应的甲和乙的质量之比28g:71g=28:71,故选项说法错误。
故选:D。
7.某纯净的有机化合物,在8克纯氧中充分燃烧,生成8.8克二氧化碳和1.8克水,该物质组成中( )
A.一定含有C、H、O三种元素
B.该有机物可能是C2H2
C.一定含有C、H元素,可能含有O元素
D.燃烧过程中消耗了有机物1.6克
【解答】解:A、参加反应的化合物的质量为8.8g+1.8g﹣8g=2.6g。8.8gCO2中含有碳元素的质量为:8.8g××100%=2.4g,1.8g水中含有氢元素的质量为:1.8g××100%=0.2g,生成物8.8g二氧化碳和1.8g水中所含碳、氢元素的质量和=2.4g+0.2g=2.6g,2.6g=2.6g,则该化合物中一定含有碳、氢两种元素,一定不含氧元素,故选项说法错误.
B、根据化合物原子的个数比=元素的质量与相对原子质量之比,则该物质分子中碳原子和氢原子的个数比为:=1:1,该有机物可能是C2H2,故选项说法正确。
C、根据A选项的分析,该化合物中一定含有碳、氢两种元素,一定不含氧元素,故选项说法错误。
D、燃烧过程中消耗了有机物2.6克,故选项说法错误。
故选:B。
8.锌粉、铝粉、铁粉的混合物3.6g与一定量的稀硫酸恰好完全反应生成氢气0.2克,将反应后的溶液蒸发水分,则得固体硫酸锌、硫酸铝、硫酸亚铁的混合物的质量为( )
A.13.2g B.13.4 g C.12 g D.11g
【解答】解:根据硫酸的化学式H2SO4,其中氢元素与硫酸根的质量比=2:96=1:48,当硫酸中所含氢元素的质量为0.2g时,硫酸根的质量=0.2g÷=9.6g,则得固体硫酸锌、硫酸铝、硫酸亚铁混合物的质量为:9.6g+3.6g=13.2g。
故选:A。
二.计算题(共10小题)
9.小明对一包可能变质的氢氧化钠固体(不含水分等其他杂质)进行了定量实验分析:称取9.3g氢氧化钠固体样品放入锥形瓶中,加入40.7g水,充分振荡,再向锥形瓶中依次滴加25g盐酸溶液充分反应,测得数据和绘制图象如下:
实验序号 1 2 3 4 5
加入盐酸溶液的质量(g) 25 25 25 25 25
锥形瓶中物质的质量(g) 75 100 123.9 147.8 172.8
请根据有关信息回答问题:
(1)a的数值为 2.2 。
(2)分析实验数据与图象,小明得出该样品已部分变质的结论,其依据是 滴加盐酸至100g时,开始时有二氧化碳生成,证明有碳酸钙存在,之前滴加的盐酸无现象,说明了盐酸与氢氧化钙反应,从而证明氢氧化钙存在 。
(3)计算该样品中氢氧化钠的质量分数(结果保留一位小数)。
【解答】解:(1)由表中的数据可知,第6次加入盐酸的质量就等于锥形瓶增加的质量,说明了第5次加入的盐酸已将碳酸钙完全反应,则生成的二氧化碳的质量:125g+9.3g+40.7g﹣172.8g=2.2g
(2)由实验数据和图象可知,滴加盐酸至100g时,开始时有二氧化碳生成,证明有碳酸钠存在,之前滴加的盐酸无现象,说明了盐酸与氢氧化钠反应,从而证明氢氧化钠存在,据此得出该试剂已部分变质的结论。
(3)设参加反应的碳酸钠质量为x。
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 2.2g
=,
x=5.3g,
氢氧化钠在样品中的质量分数×100%≈43.0%。
答:氢氧化钠的质量分数为43.0%。
故答案为:(1)2.2;
(2)滴加盐酸至100g时,开始时有二氧化碳生成,证明有碳酸钙存在,之前滴加的盐酸无现象,说明了盐酸与氢氧化钙反应,从而证明氢氧化钙存在;
(3)氢氧化钠的质量分数为43.0%。
10.将a克过氧化氢和b克的二氧化锰混合,使之完全反应;反应方程式为:2H2O22H2O+O2↑。
(1)若得到水为c克,则可得氧气为 (a﹣c) 克;
(2)若得到剩余物c克,则可得氧气为 (a+b﹣c) 克;
(3)若反应后质量减轻c克,则可得氧气 c 克。
【解答】解:(1)将a克过氧化氢和b克的二氧化锰混合,使之完全反应,由质量守恒定律,若得到水为c克,则可得氧气为ag﹣cg=(a﹣c)g;
(2)若得到剩余物c克,由质量守恒定律,则可得氧气为ag+bg﹣cg=(a+b﹣c)g。
(3)若反应后质量减轻c克,减少的即为生成氧气的质量,则可得氧气cg。
故答案为:
(1)(a﹣c);
(2)(a+b﹣c);
(3)c。
11.为了测定某石灰石样品中碳酸钙的质量分数,小明采用如图1实验装置来研究。
实验次数 1 2 3 4 5
稀盐酸累计加入量/g 0 40.0 80.0 120.0 160.0
C装置的总重/g 100 102.2 104.4 105.5 105.5
(1)装置B所盛的试剂要具备的性质是 不能和二氧化碳反应,能够吸收水蒸气 。
(2)取用15g石灰石样品,把160g稀盐酸平均分4次加入样品中(样品中的杂质既不与盐酸反应,也不溶解于水),每次充分反应后实验数据如表,请计算:
①在如图2中画出生成气体的质量与加入稀盐酸的质量的关系。
②石灰石样品中碳酸钙的质量分数是多少?(写出计算过程,结果保留一位小数)。
【解答】解:(1)装置B所盛的试剂要具备的性质是不能和二氧化碳反应,能够吸收水蒸气。
故填:不能和二氧化碳反应,能够吸收水蒸气。
(2)①由表中数据可知,40g稀盐酸恰好完全反应时生成2.2g二氧化碳,最终生成二氧化碳质量是5.5g,说明反应的稀盐酸质量是100g,生成气体的质量与加入稀盐酸的质量的关系如下所示:
。
故填:。
②设碳酸钙质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
x 5.5g
=,
x=12.5g,
石灰石样品中碳酸钙的质量分数是:×100%=83.3%,
答:石灰石样品中碳酸钙的质量分数是83.3%。
12.实验室用碳酸钠溶液与氯化钙溶液反应制取高纯度碳酸钙粉末,烧杯中现有100g碳酸钠溶液,将150g氯化钙溶液分四次加入,充分反应,四次测量所得数据如下表所示:
次数 累计加入氯化钙溶液的质量/g 烧杯中溶液的总质量/g
一 40 134
二 80 168
三 120 205
四 150 x
(1)第三次测量时,所得溶液中的溶质有 CaCl2、NaCl (填化学式)。
(2)表格中x的数值为 235g 。
(3)原100g碳酸钠溶液中所含溶质质量为 15.9g 。
【解答】解:(1)由表中的数据可知,每加入40g的氯化钙生成沉淀的质量是6g,第三次总质量减少100g+120g﹣205g=15g<18g,说明了有剩余的氯化钙,溶液中溶质的为:CaCl2、NaCl;
(2)由于上述分析可知,在第三次加入氯化钙时碳酸钠已完全反应,在第四次加入的氯化钙不发生反应,则溶液的质量为:205g+(150g﹣120g)=235g;
(3)设原100g碳酸钠溶液中所含溶质质量为x。
CaCl2+Na2CO3=CaCO3↓+2NaCl
106 100
x 15g
解得:x=15.9g。
故答为:(1)CaCl2、NaCl。
(2)235g。
(3)15.9g。
13.5G通讯需要大量光纤连接各种基站,在光纤的表面涂布Cu﹣Al合金层的金属涂层光纤是其中一种。为测定金属涂层光纤的Cu﹣Al合金层中铝的质量分数,小乐进行了相关实验,测得实验数据如表所示,则:
甲 乙 丙
加入Cu﹣Al合金层样品粉末的质量(g) 10 10 20
加入稀硫酸的质量(g) 100 50 50
烧杯中剩余物的质量(g) 109 59 69
(1)实验中Cu﹣Al合金层样品粉末与稀硫酸恰好完全反应的实验是 乙 (选填“甲”“乙”或“丙”);
(2)该Cu﹣Al合金层样品粉末中铝的质量分数为多少?(写出计算过程)
【解答】解:(1)由实验甲和实验乙对比,可得知10g合金样品粉末全部反应生成了1g氢气,实验乙和实验丙对比,可得知50g稀硫酸全部反应生成了1g氢气。综上所述,实验乙中的两物质恰好完全反应;
(2)设10g合金样品中铝的质量为x
2Al+3H2SO4=Al2(SO4)3+3H2↑
54 6
x 1g
解得:x=9g
该合金样品中铅的质量分数为:×100%=90%
答:该Cu﹣Al合金层样品粉末中铝的质量分数为90%
故答案为:(1)乙。
(2)90%。
14.实验室用足量的稀盐酸和大理石制取CO2,为了分析反应后滤液的成分,取100g反应后的滤液,逐滴滴入溶质质量分数为20.0%的Na2CO3溶液,测得滴加溶液的质量与产生沉淀的关系如图。回答下列问题:(已知:CaCl2溶液呈中性)
(1)从开始加入碳酸钠溶液至10g时,没有产生沉淀的原因是 碳酸钠先与过量的稀盐酸反应,当稀盐酸消耗完后,碳酸钠才与氯化钙反应生成碳酸钙沉淀 。
(2)计算原滤液中氯化钙的质量。
(3)通过计算求出图中m的大小。
(4)随着滴加Na2CO3溶液质量的增加,烧杯中溶液的pH也呈现一定的变化规律。结合图象判断:b→c段烧杯中溶液pH如何变化? 不变 。
【解答】解:(1)碳酸钠先与过量的稀盐酸反应,当稀盐酸消耗完后,碳酸钠才与氯化钙反应生成碳酸钙沉淀;
(2)设生成10g碳酸钙需要氯化钙的质量为x,碳酸钠的质量为y。
Na2CO3+CaCl2=2NaCl+CaCO3↓
106 111 100
x y 10g
x=10.6g
y=11.1g
答:原滤液中氯化钙的质量为11.1g;
(3)与氯化钙反应的碳酸钠溶液的质量为:
10.6g÷20%=53g
m的值为:
10+53=63
答:图中m的值为63;
(4)由于混合溶液中含有盐酸和氯化钙,盐酸先反应掉,所以逐渐滴入碳酸钠溶液的过程中,a→b段杯中溶液的pH有小于7,慢慢变大,后来等于7,b→c段是碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,溶液的pH不变。
故答案为:
(1)碳酸钠先与过量的稀盐酸反应,当稀盐酸消耗完后,碳酸钠才与氯化钙反应生成碳酸钙沉淀;
(2)11.1g;
(3)63;
(4)不变。
15.为了测定某铜锌合金(即铜锌混合物)中锌的质量分数,某同学利用该合金与稀硫酸的反应,进行了三次实验,所得相关的实验数据记录如下(实验中的误差忽略不计):
第一次 第二次 第三次
所取合金的质量/g 25 25 50
所用稀硫酸的质量/g 120 160 100
生产氢气的质量/g 0.4 0.4 0.4
(1)试计算该铜锌合金中锌的质量分数.
(2)从上表数据分析,当所取合金与所用稀硫酸的质量比为 1:4 时,表明合金中的锌与稀硫酸中的硫酸恰好完全反应.
【解答】解:(1)由实验数据可知,25g合金与足量酸反应最多生成0.4g氢气,
设25g合金中锌的质量为x,则
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.4g
解得x=13g,
则铜锌合金中锌的质量分数为×100%=52%,
答:铜锌合金中锌的质量分数为52%;
(2)由实验一和实验三的数据可知,25g合金和100g硫酸都能在反应中生成等质量的氢气,
即25g合金与100g硫酸恰好完全反应,则其质量比为25g:100g=1:4,故答案为:1:4;
16.实验室有一瓶碳酸钙和氯化钙粉末组成的均匀混合物,小明用相同溶质质量分数的稀盐酸和该混合物反应(所得溶液均为不饱和溶液),四组实验数据记录如表,请分析计算(写出计算过程):
实验组别 一 二 三 四
稀盐酸质量/g 200.0 200.0 200.0 200.0
混合物质量/g 12.0 24.0 36.0 48.0
所得溶液质量/g 207.6 215.2 220.0 a
剩余固体质量/g 0 0 m n
(1)求混合物中碳酸钙和氯化钙质量之比为 5:1 。
(2)表中a的值为 222.0 。
(3)求表中n的值。
【解答】解:根据图表中数据分析,每消耗12.0g混合物,溶液增加7.6g,第三组加入混合物36.0g,溶液增加质量为20.0g小于7.6g×3,说明混合物剩余,稀盐酸完全反应;第一、二组稀盐酸还有剩余,故:
(1)由第一组数据可知,二氧化碳的质量为200.0+12.0g﹣207.6g=4.4g
设12.0g混合物中碳酸钙的质量为x。
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
x 4.4g
,
解得x=10.0g
故混合物中碳酸钙和氯化钙质量之比为10.0g:(12.0g﹣10.0g)=5:1;
(2)由于第三组混合物剩余,稀盐酸完全反应;所以第四组比第三组多溶解了48.0g﹣36.0g=12.0g混合物中的氯化钙,12.0g混合物中的氯化钙质量为12.0g﹣10.0g=2.0g,所以a=220.0+2.0=222.0;
(3)第三组中产生二氧化碳的质量为200.0g+36.0g﹣220.0g﹣m=16.0g﹣m。
设反应的碳酸钙的质量为y。
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
y 16.0g﹣m
,
解得y=,
36.0g混合物中的碳酸钙质量为36.0g×=30.0g,所以+m=30.0g,解得m=5.0g。n=5.0+10.0=15.0。
故答案为:(1)5:1;
(2)222.0;
(3)15.0。
17.在实验室中化学兴趣小组的同学们发现了一瓶敞口放置的Ca(OH)2粉末状试剂。他们对该试剂进行了定量实验分析:称取试剂19.8g放入锥形瓶中,加入30.2g的水,充分振荡,再向锥形瓶中依次滴加25g盐酸,充分反应后。测得部分数据与图象如图所示。
请根据有关信息回答问题。
第1次 第2次 第3次 第4次 第5次 第6次
加入盐酸的质量/g 25 25 25 25 25 25
锥形瓶中物质的质量/g 75 100 a 150 172.8 197.8
(1)a的数值为 125 。
(2)兴趣小组的同学们通过实验,得出该试剂 是 (填“是”或“不是”)已部分变质的结论,其依据是 滴加盐酸至100g时,开始时有二氧化碳生成,证明有碳酸钙存在,之前滴加的盐酸无现象,说明了盐酸与氢氧化钙反应,从而证明氢氧化钙存在 (温馨提示:通过实验数据和图象作出你的判断)。
(3)b的数值为 2.2 。
(4)该试剂中氢氧化钙的质量分数为 74.7% (不要求计算过程,结果保留一位小数)。
【解答】解:(1)由表中的数据可知,第1、2、4次加入盐酸的质量就等于锥形瓶中增加的质量,所以第3次加入盐酸后物质的质量就是2次锥形瓶中物质的质量再加上盐酸的质量,故a的值为:100g+25g=125g;
(2)由实验数据和图象可知,滴加盐酸至100g时,开始时有二氧化碳生成,证明有碳酸钙存在,之前滴加的盐酸无现象,说明了盐酸与氢氧化钙反应,从而证明氢氧化钙存在,据此得出该试剂已部分变质的结论。
(3)由表中的数据可知,第6次加入盐酸的质量就等于锥形瓶增加的质量,说明了第5次加入的盐酸已将碳酸钙完全反应,则生成的二氧化碳的质量:150g+25g﹣172.8g=2.2g
(4)设需要碳酸钙的质量为x。
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 2.2g
解得:x=5g
试剂中氢氧化钙的质量分数为:×100%≈74.7%
故答案为:(1)125;
(2)滴加盐酸至100g时,开始时有二氧化碳生成,证明有碳酸钙存在,之前滴加的盐酸无现象,说明了盐酸与氢氧化钙反应,从而证明氢氧化钙存在;
(3)2.2;
(3)答:氢氧化钙的质量分数为74.7%。
18.为了探究石灰石与稀盐酸反应制备二氧化碳后的废液中的溶质成分,将废液过滤,取滤液20g于烧杯中,在不断振荡的条件下,向其中滴加质量分数为10.6%的碳酸钠溶液直至过量,有关的变化如图所示:根据题中有关信息和图象分析回答下列问题。
(1)原废液中的溶质成分有 HCl、CaCl2 (用化学式回答)。
(2)A点处溶液中溶质的质量是多少克?(通过计算回答)
【解答】解:(1)由图中信息可知,加入5g碳酸钠溶液时才开始产生沉淀,说明滤液中含有稀盐酸,因此原废液中的溶质成分有HCl、CaCl2。
故填:HCl、CaCl2。
(2)设反应产生的沉淀的质量为x,
和氯化钙反应的碳酸钠溶液质量为:20g﹣5g=15g,
Na2CO3+CaCl2═CaCO3↓+2NaCl,
106 100
15g×10.6% x
=
x=1.5g,
答:A点处所得沉淀的质量是1.5g。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
