第三单元 课题二 原子的结构(第1课时)课件 -2022-2023学年九年级化学人教版上册(共39张PPT)
文档属性
| 名称 | 第三单元 课题二 原子的结构(第1课时)课件 -2022-2023学年九年级化学人教版上册(共39张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 22.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-05 17:24:36 | ||
图片预览






文档简介
(共39张PPT)
第三单元 物质构成的奥秘
课题二 原子的结构
第一课时
那么,原子在任何情况下都不能再分吗?
在化学变化中,分子可以分为 , 又可以结合成新分子。即在化学变化中 不可再分, 是化学变化的最小粒子。
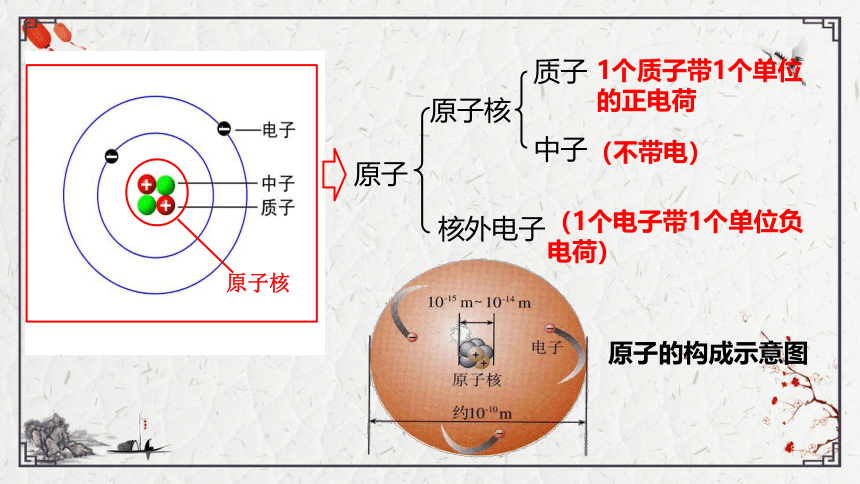
一、原子的构成
原子不是一个实心的球体
原子
原子核
核外电子
中子
质子
1个质子带1个单位的正电荷
(不带电)
(1个电子带1个单位负电荷)
原子核
原子的构成示意图
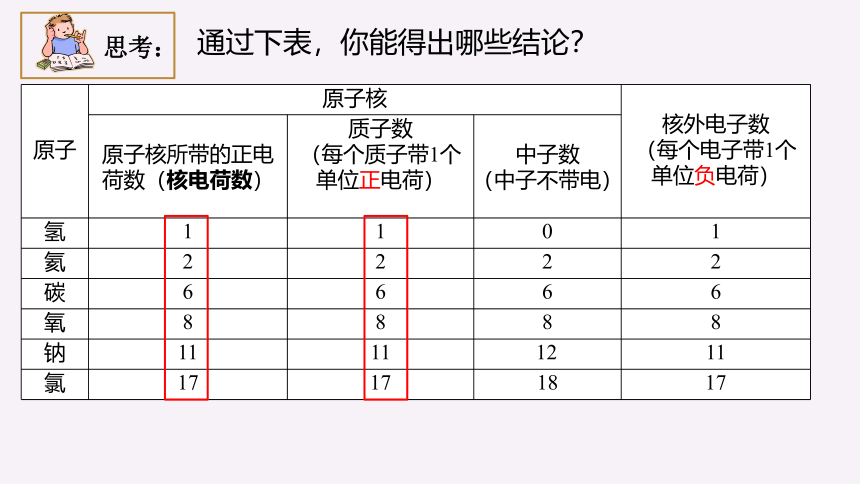
原子 原子核
核外电子数
(每个电子带1个单位负电荷)
原子核所带的正电荷数(核电荷数) 质子数 (每个质子带1个单位正电荷) 中子数 (中子不带电)
氢 1 1 0 1
氦 2 2 2 2
碳 6 6 6 6
氧 8 8 8 8
钠 11 11 12[ 11
氯 17 17 18 17
通过下表,你能得出哪些结论?
思考:
7
8
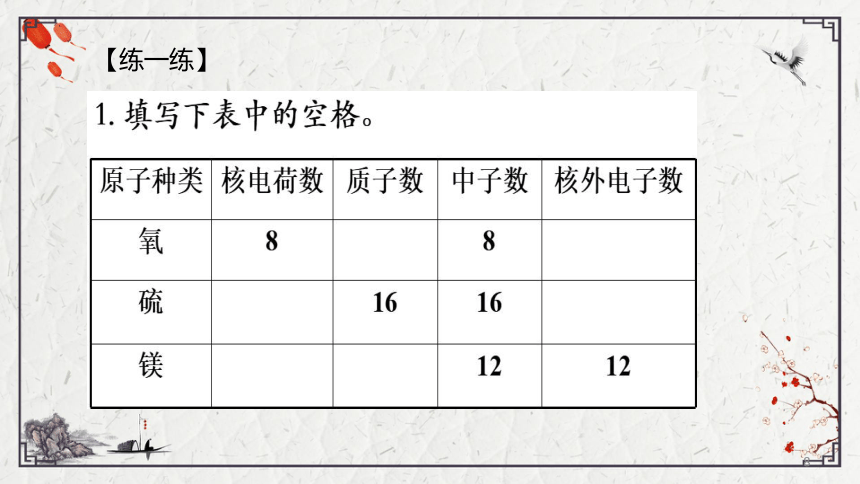
【练一练】
【练一练】下列叙述中错误的是( )。
①原子是化学变化中的最小粒子 ②原子是不能再分的粒子 ③一切物质都是由原子直接构成的 ④一切原子核都是由质子和中子构成的 ⑤原子不显电性 ⑥原子之间有间隔
A.①② B.②③④ C.③⑤ D.③⑥
B
【练一练】钛被称为“航空金属”,国产C919大飞机的钛合金用量达到9.3%.已知一种钛原子核内有22个质子和26个中子,该原子的核外电子数为( )
A.22 B.26 C.48 D.4
A
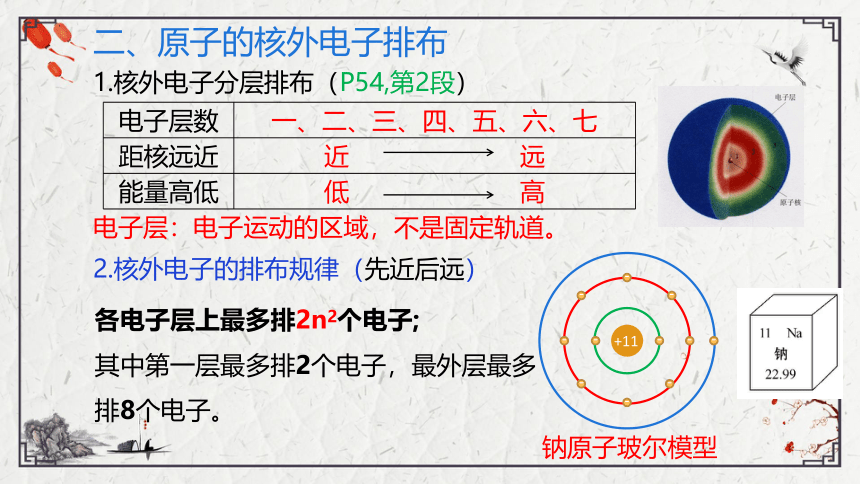
二、原子的核外电子排布
1.核外电子分层排布(P54,第2段)
电子层数 一、二、三、四、五、六、七
距核远近 近 远
能量高低 低 高
电子层:电子运动的区域,不是固定轨道。
2.核外电子的排布规律(先近后远)
+11
-
-
-
-
-
-
-
-
-
-
-
钠原子玻尔模型
各电子层上最多排2n2个电子;
其中第一层最多排2个电子,最外层最多排8个电子。
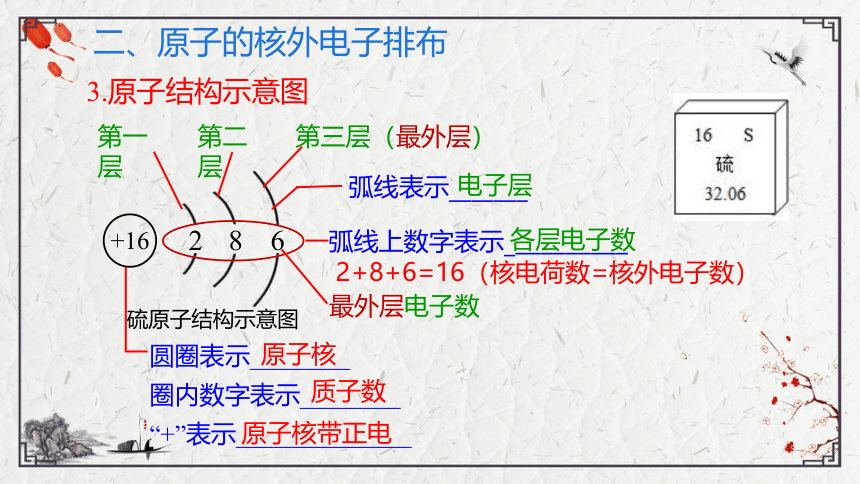
+16
2
8
6
弧线表示_______
2+8+6=16(核电荷数=核外电子数)
圆圈表示________
圈内数字表示________
“+”表示______________
弧线上数字表示__________
第一层
第二层
第三层(最外层)
电子层
各层电子数
最外层电子数
原子核
质子数
原子核带正电
硫原子结构示意图
3.原子结构示意图
二、原子的核外电子排布
【练一练】画出1-20号元素原子结构示意图,并观察它们的原子结构特点。
金属原子:最外层电子数一般少于4个
非金属原子:最外层电子数一般等于或多于4个
稀有气体原子:最外层电子数等于8个(氦原子除外,最外层电子数为2)
最外层电子为8(只有一个电子层时有2个电子)时的结构,不易与其它物质发生反应,属于相对稳定的结构,元素化学性质相对稳定。
思考:
想一想,下列这些结构是不是稳定结构?
元素的分类 最外层的电子数 结构的稳定性
稀有气体原子 一般为 ,只有氦为 。 结构
金属原子 一般少于 个 结构
非金属原子 一般多于 个 结构
8
稳定
2
4
不稳定
4
不稳定
·多数金属原子的最外层电子数少于4,容易 电子;
·许多非金属原子的最外层电子数多于4,容易 电子;
·氦、氛、氩等稀有气体的原子的最外层电子数为8(氦原子的最外层电子数为2),既不易失去电子,也不易得到电子。
最外层的电子数不为8的原子,在化学反应中容易得到或者失去电子,趋于变成稳定结构:
失去
得到
思考:
多数金属原子容易失去电子,那么失去电子之后变成了什么?
三、离子的形成
失去1个电子
得到1个电子
NaCl
钠原子Na
氯原子Cl
钠离子Na+
氯离子Cl-
氯化钠
相互作用
在上述过程中,钠原子因失去l个电子而带上1个单位的正电荷;氯原子因得到1个电子而带上1个单位的负电荷。
像这种 叫做离子。其中 叫做阳离子,如钠离子(Na+); 叫做阴离子,如氯离子(CI-)。
带电的原子
带正电的原子
带负电的原子
思考:
如何区分离子和原子?
原子不带电而离子带电,即离子的质子数≠电子数
4.离子的形成
离子:带电的原子
离子也是构成物质的一种粒子
如:氯化钠(NaCl)是由_______和______构成的。
(+)阳离子 原子 阴离子(-)
形成:
电子层数减少
电子层数不变
失去电子
得到电子
Na+
Cl-
钠离子
失去e-
钠原子
得到e-
Cl
氯原子
Cl-
氯离子
【练一练】下列结构中属于原子结构的是 ,属于阳离子的是 ;属于阴离子的是 。
10
11
5
15
8
15
8
17
8
18
⑥
①
②
③
④
⑤
①③⑥
②
④⑤
【练一练】右图为氯原子的结构示意图,下列有关说法错误的是( )
A.氯原子的核电荷数为17
B.氯原子最外层有7个电子
C.氯原子的质子数为17
D.在化学反应中氯原子容易失去电子
D
【练一练】(2020 青白江区模拟)某粒子的结构示意图是 ,当n=9时,该微粒是( )
A.阳离子 B.分子 C.阴离子 D.原子
C
第三单元 物质构成的奥秘
课题二 原子的结构
第二课时
离子的形成
离子:带电的原子
离子也是构成物质的一种粒子
如:氯化钠(NaCl)是由_______和______构成的。
(+)阳离子 原子 阴离子(-)
形成:
电子层数减少
电子层数不变
失去电子
得到电子
Na+
Cl-
钠离子
失去e-
钠原子
得到e-
Cl
氯原子
Cl-
氯离子
温故知新
三、离子的形成
2Mg2+
Mg2+:整体表示__________;
意义:
1个镁离子
2个镁离子
一个镁离子带两个单位的正电荷
写法:
①位置:元素符号的右上方
②顺序:先数字,后符号(电荷数为1时,省略不写)
钠离子 氯离子 铝离子 镁离子 氧离子
Mg2+
Al3+
O2-
Na+
Cl-
三、离子的形成
根据原子序数/最外层电子数写离子符号
原子 质子数 最外层电子数 电子得失 离子
Na 11 1 失1e-
Mg 12 2 失2e-
Al 13 3 失3e-
O 8 6 得2e-
S 16 6 得2e-
Cl 17 7 得1e-
Mg2+
Al3+
O2-
Na+
Cl-
S2-
设某原子R的最外层电子数为n:
当n<4,离子符号写为______
当n>4,离子符号写为______
规律
失正得负
金正非负
Rn+
R(8-n)-
原子 Na Mg Al Cl O
质子数 11 12 13 17 8
离子符号
1.根据原子的质子数写出其离子符号
Mg2+
Al3+
O2-
Na+
Cl-
2.根据微粒的结构示意图写出粒子的符号
Ne
Na+
O2-
Mg
Mg2+
① ② ③ ④ ⑤
1.原子与离子的区别和联系
原子 离子
阳离子 阴离子
区别 结构 质子数=电子数
电子层数(与原子比较)
电性 不带电
稳定性 离子 原子
联系
>
<
+
-
>
1.质子数相同;
减少
不变
3.离子也是一种原子。
钠原子
钠离子
Cl
Cl-
氯原子
氯离子
2.质量几乎相等;
2.物质是由分子、原子、离子构成的
分子
原子
离子
构成
物质
金属、“石”旁、稀有气体
例:铁是由________构成的
氯化钠、硫酸铜
氯化钠(NaCl)是____和____构成的
硫酸铜(CuSO4)是由____和 构成的
水和气体(稀气除外)
例:水是由________构成的
水分子
铁原子
Cu2+
SO42-
Na+
Cl-
构
成
分
为
得失电子
三、相对原子质量
1.相对原子质量:以一种碳原子质量的 为标准,其他原子的质量与它相比较得到的____。(用Ar表示,单位为“1”,省略不写)
相对原子质量=
比
1/12
一种原子的实际质量
一种碳原子质量的1/12
三、相对原子质量
P582.选择题(3)碳的相对原子质量是( )
A.12g B.12
C.1.66×1027kg D.1/12g
B
练一练
相对原子质量=______数 + _____数
中子
质子
原子 质子数 中子数 相对原子质量
氢 1 0 1
氧 8 8 16
钠 11 12 23
镁 12 12 24
观察以下表格中几种原子的相对原子质量、质子数、中子数,你发现什么规律?(质子和中子的相对质量都为1)
三、相对原子质量
2.我国科学家_________主持测定了铟、铱、锑等10种元素相对原子质量的新值,被国际纯粹与应用化学联合会确定为新的国际标准数据。
张青莲
三、相对原子质量
1. 相对原子质量的单位是“1”,省略不写;
例:钠原子的相对原子质量约为23(√)
钠原子的相对原子质量约为23g(×)
2. 原子的实际质量越大,其相对原子质量越大。
4.(教材P58,5)从附录Ⅱ中查出钠,镁,铝的相对原子质量。根据所查数据,比较相同质量的钠、镁、铝三种金属,哪一种所含的原子最多?哪一种所含的原子最少?为什么?
一斤鸡蛋
一斤黄豆
钠所含原子最多,铝所含原子最少。
相对原子质量越大,原子个数越少。
1.原子是由居于原子中心带正电荷的 和核外带负电荷的__________构成的;原子核一般由带正电荷的_____和不带电的______构成的。由于原子核和核外电子所带电荷,______相等,______相反,所以整个原子不带电(显电中性)。
2.在原子中:核电荷数=_______数=___________数
一、原子的构成
二、相对原子质量=_____数+_____数
1.我国科学家_________对测定元素的相对原子质量新值做出了贡献。
1.相对原子质量不用书写单位;
2.原子实际质量越大,其相对原子质量越大。
质子
原子核
核外电子
质子
中子
电量
质子
核外电子
中子
电性
张青莲
三、原子结构示意图
弧线表示________
硫原子结构示意图
圆圈表示________
圈内数字表示________
“+”表示_______________
弧线上数字表示__________
第一层
第二层
第三层(最外层)
电子层
数字6还可以表示____________
各层电子数
最外层电子数
原子核
质子数
原子核带正电
四、离子:_______的原子。带正电的是___离子,带负电的是____离子。
2Mg2+
2个镁离子
一个镁离子带两个单位的正电荷
带电
阳
阴
离子符号的意义
1.下列关于Na、Na+两种粒子的判断中,正确的是( )
①核电荷数相同 ②核外电子数相等 ③电子层结构完全相同
④质量几乎相等 ⑤化学性质相同 ⑥Na+比Na稳定
A.①④⑤ B.①③⑤⑥ C.①④⑥ D.②③④
C
1.根据如图R2-的离子结构示意图,推测m的值为( )
A.10 B.16 C.18 D.20
B
【2018】下列粒子结构示意图,表示阴离子的是( ).
【2018】(2)氮元素和磷元素的化学性质相似,是因为氮原子和磷原子的______________相同。(3)在化学反应中,原子序数为17的元素的原子容易________(填“得到”或“失去”)电子。
链接中考
【2019】(2分)(2019 南宁)下列粒子可以通过得到电子变成原子的是( )
A.F B.S2﹣ C. D.
链接中考
【2021】2. 下列物质,由原子直接构成的是( )A. 水 B. 铜 C. 氢气 D. 氯化钠
第三单元 物质构成的奥秘
课题二 原子的结构
第一课时
那么,原子在任何情况下都不能再分吗?
在化学变化中,分子可以分为 , 又可以结合成新分子。即在化学变化中 不可再分, 是化学变化的最小粒子。
一、原子的构成
原子不是一个实心的球体
原子
原子核
核外电子
中子
质子
1个质子带1个单位的正电荷
(不带电)
(1个电子带1个单位负电荷)
原子核
原子的构成示意图
原子 原子核
核外电子数
(每个电子带1个单位负电荷)
原子核所带的正电荷数(核电荷数) 质子数 (每个质子带1个单位正电荷) 中子数 (中子不带电)
氢 1 1 0 1
氦 2 2 2 2
碳 6 6 6 6
氧 8 8 8 8
钠 11 11 12[ 11
氯 17 17 18 17
通过下表,你能得出哪些结论?
思考:
7
8
【练一练】
【练一练】下列叙述中错误的是( )。
①原子是化学变化中的最小粒子 ②原子是不能再分的粒子 ③一切物质都是由原子直接构成的 ④一切原子核都是由质子和中子构成的 ⑤原子不显电性 ⑥原子之间有间隔
A.①② B.②③④ C.③⑤ D.③⑥
B
【练一练】钛被称为“航空金属”,国产C919大飞机的钛合金用量达到9.3%.已知一种钛原子核内有22个质子和26个中子,该原子的核外电子数为( )
A.22 B.26 C.48 D.4
A
二、原子的核外电子排布
1.核外电子分层排布(P54,第2段)
电子层数 一、二、三、四、五、六、七
距核远近 近 远
能量高低 低 高
电子层:电子运动的区域,不是固定轨道。
2.核外电子的排布规律(先近后远)
+11
-
-
-
-
-
-
-
-
-
-
-
钠原子玻尔模型
各电子层上最多排2n2个电子;
其中第一层最多排2个电子,最外层最多排8个电子。
+16
2
8
6
弧线表示_______
2+8+6=16(核电荷数=核外电子数)
圆圈表示________
圈内数字表示________
“+”表示______________
弧线上数字表示__________
第一层
第二层
第三层(最外层)
电子层
各层电子数
最外层电子数
原子核
质子数
原子核带正电
硫原子结构示意图
3.原子结构示意图
二、原子的核外电子排布
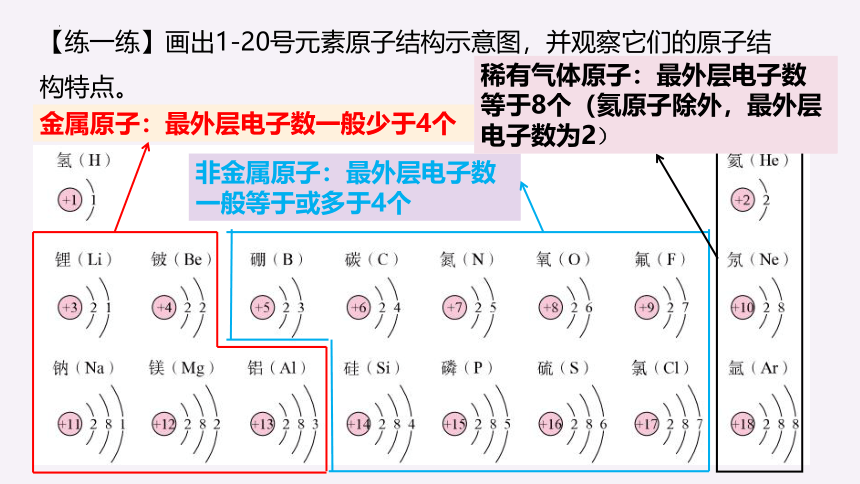
【练一练】画出1-20号元素原子结构示意图,并观察它们的原子结构特点。
金属原子:最外层电子数一般少于4个
非金属原子:最外层电子数一般等于或多于4个
稀有气体原子:最外层电子数等于8个(氦原子除外,最外层电子数为2)
最外层电子为8(只有一个电子层时有2个电子)时的结构,不易与其它物质发生反应,属于相对稳定的结构,元素化学性质相对稳定。
思考:
想一想,下列这些结构是不是稳定结构?
元素的分类 最外层的电子数 结构的稳定性
稀有气体原子 一般为 ,只有氦为 。 结构
金属原子 一般少于 个 结构
非金属原子 一般多于 个 结构
8
稳定
2
4
不稳定
4
不稳定
·多数金属原子的最外层电子数少于4,容易 电子;
·许多非金属原子的最外层电子数多于4,容易 电子;
·氦、氛、氩等稀有气体的原子的最外层电子数为8(氦原子的最外层电子数为2),既不易失去电子,也不易得到电子。
最外层的电子数不为8的原子,在化学反应中容易得到或者失去电子,趋于变成稳定结构:
失去
得到
思考:
多数金属原子容易失去电子,那么失去电子之后变成了什么?
三、离子的形成
失去1个电子
得到1个电子
NaCl
钠原子Na
氯原子Cl
钠离子Na+
氯离子Cl-
氯化钠
相互作用
在上述过程中,钠原子因失去l个电子而带上1个单位的正电荷;氯原子因得到1个电子而带上1个单位的负电荷。
像这种 叫做离子。其中 叫做阳离子,如钠离子(Na+); 叫做阴离子,如氯离子(CI-)。
带电的原子
带正电的原子
带负电的原子
思考:
如何区分离子和原子?
原子不带电而离子带电,即离子的质子数≠电子数
4.离子的形成
离子:带电的原子
离子也是构成物质的一种粒子
如:氯化钠(NaCl)是由_______和______构成的。
(+)阳离子 原子 阴离子(-)
形成:
电子层数减少
电子层数不变
失去电子
得到电子
Na+
Cl-
钠离子
失去e-
钠原子
得到e-
Cl
氯原子
Cl-
氯离子
【练一练】下列结构中属于原子结构的是 ,属于阳离子的是 ;属于阴离子的是 。
10
11
5
15
8
15
8
17
8
18
⑥
①
②
③
④
⑤
①③⑥
②
④⑤
【练一练】右图为氯原子的结构示意图,下列有关说法错误的是( )
A.氯原子的核电荷数为17
B.氯原子最外层有7个电子
C.氯原子的质子数为17
D.在化学反应中氯原子容易失去电子
D
【练一练】(2020 青白江区模拟)某粒子的结构示意图是 ,当n=9时,该微粒是( )
A.阳离子 B.分子 C.阴离子 D.原子
C
第三单元 物质构成的奥秘
课题二 原子的结构
第二课时
离子的形成
离子:带电的原子
离子也是构成物质的一种粒子
如:氯化钠(NaCl)是由_______和______构成的。
(+)阳离子 原子 阴离子(-)
形成:
电子层数减少
电子层数不变
失去电子
得到电子
Na+
Cl-
钠离子
失去e-
钠原子
得到e-
Cl
氯原子
Cl-
氯离子
温故知新
三、离子的形成
2Mg2+
Mg2+:整体表示__________;
意义:
1个镁离子
2个镁离子
一个镁离子带两个单位的正电荷
写法:
①位置:元素符号的右上方
②顺序:先数字,后符号(电荷数为1时,省略不写)
钠离子 氯离子 铝离子 镁离子 氧离子
Mg2+
Al3+
O2-
Na+
Cl-
三、离子的形成
根据原子序数/最外层电子数写离子符号
原子 质子数 最外层电子数 电子得失 离子
Na 11 1 失1e-
Mg 12 2 失2e-
Al 13 3 失3e-
O 8 6 得2e-
S 16 6 得2e-
Cl 17 7 得1e-
Mg2+
Al3+
O2-
Na+
Cl-
S2-
设某原子R的最外层电子数为n:
当n<4,离子符号写为______
当n>4,离子符号写为______
规律
失正得负
金正非负
Rn+
R(8-n)-
原子 Na Mg Al Cl O
质子数 11 12 13 17 8
离子符号
1.根据原子的质子数写出其离子符号
Mg2+
Al3+
O2-
Na+
Cl-
2.根据微粒的结构示意图写出粒子的符号
Ne
Na+
O2-
Mg
Mg2+
① ② ③ ④ ⑤
1.原子与离子的区别和联系
原子 离子
阳离子 阴离子
区别 结构 质子数=电子数
电子层数(与原子比较)
电性 不带电
稳定性 离子 原子
联系
>
<
+
-
>
1.质子数相同;
减少
不变
3.离子也是一种原子。
钠原子
钠离子
Cl
Cl-
氯原子
氯离子
2.质量几乎相等;
2.物质是由分子、原子、离子构成的
分子
原子
离子
构成
物质
金属、“石”旁、稀有气体
例:铁是由________构成的
氯化钠、硫酸铜
氯化钠(NaCl)是____和____构成的
硫酸铜(CuSO4)是由____和 构成的
水和气体(稀气除外)
例:水是由________构成的
水分子
铁原子
Cu2+
SO42-
Na+
Cl-
构
成
分
为
得失电子
三、相对原子质量
1.相对原子质量:以一种碳原子质量的 为标准,其他原子的质量与它相比较得到的____。(用Ar表示,单位为“1”,省略不写)
相对原子质量=
比
1/12
一种原子的实际质量
一种碳原子质量的1/12
三、相对原子质量
P582.选择题(3)碳的相对原子质量是( )
A.12g B.12
C.1.66×1027kg D.1/12g
B
练一练
相对原子质量=______数 + _____数
中子
质子
原子 质子数 中子数 相对原子质量
氢 1 0 1
氧 8 8 16
钠 11 12 23
镁 12 12 24
观察以下表格中几种原子的相对原子质量、质子数、中子数,你发现什么规律?(质子和中子的相对质量都为1)
三、相对原子质量
2.我国科学家_________主持测定了铟、铱、锑等10种元素相对原子质量的新值,被国际纯粹与应用化学联合会确定为新的国际标准数据。
张青莲
三、相对原子质量
1. 相对原子质量的单位是“1”,省略不写;
例:钠原子的相对原子质量约为23(√)
钠原子的相对原子质量约为23g(×)
2. 原子的实际质量越大,其相对原子质量越大。
4.(教材P58,5)从附录Ⅱ中查出钠,镁,铝的相对原子质量。根据所查数据,比较相同质量的钠、镁、铝三种金属,哪一种所含的原子最多?哪一种所含的原子最少?为什么?
一斤鸡蛋
一斤黄豆
钠所含原子最多,铝所含原子最少。
相对原子质量越大,原子个数越少。
1.原子是由居于原子中心带正电荷的 和核外带负电荷的__________构成的;原子核一般由带正电荷的_____和不带电的______构成的。由于原子核和核外电子所带电荷,______相等,______相反,所以整个原子不带电(显电中性)。
2.在原子中:核电荷数=_______数=___________数
一、原子的构成
二、相对原子质量=_____数+_____数
1.我国科学家_________对测定元素的相对原子质量新值做出了贡献。
1.相对原子质量不用书写单位;
2.原子实际质量越大,其相对原子质量越大。
质子
原子核
核外电子
质子
中子
电量
质子
核外电子
中子
电性
张青莲
三、原子结构示意图
弧线表示________
硫原子结构示意图
圆圈表示________
圈内数字表示________
“+”表示_______________
弧线上数字表示__________
第一层
第二层
第三层(最外层)
电子层
数字6还可以表示____________
各层电子数
最外层电子数
原子核
质子数
原子核带正电
四、离子:_______的原子。带正电的是___离子,带负电的是____离子。
2Mg2+
2个镁离子
一个镁离子带两个单位的正电荷
带电
阳
阴
离子符号的意义
1.下列关于Na、Na+两种粒子的判断中,正确的是( )
①核电荷数相同 ②核外电子数相等 ③电子层结构完全相同
④质量几乎相等 ⑤化学性质相同 ⑥Na+比Na稳定
A.①④⑤ B.①③⑤⑥ C.①④⑥ D.②③④
C
1.根据如图R2-的离子结构示意图,推测m的值为( )
A.10 B.16 C.18 D.20
B
【2018】下列粒子结构示意图,表示阴离子的是( ).
【2018】(2)氮元素和磷元素的化学性质相似,是因为氮原子和磷原子的______________相同。(3)在化学反应中,原子序数为17的元素的原子容易________(填“得到”或“失去”)电子。
链接中考
【2019】(2分)(2019 南宁)下列粒子可以通过得到电子变成原子的是( )
A.F B.S2﹣ C. D.
链接中考
【2021】2. 下列物质,由原子直接构成的是( )A. 水 B. 铜 C. 氢气 D. 氯化钠
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
