第6节 几种重要的盐(第2课时)(课件 30张PPT)
文档属性
| 名称 | 第6节 几种重要的盐(第2课时)(课件 30张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-08-07 22:38:33 | ||
图片预览









文档简介
(共30张PPT)
浙教版 九年级上
第6节 几种重要的盐
(第2课时)
教材解析
【核心概念】
1.物质的结构与性质 结构与功能
【学习内容与要求】
1.4 常见的化合物 2.3物质变化的特征
理解复分解反应的实质,知道复分解反应发生的条件
根据盐的性质进行盐的制取
化肥类型的判定和化肥的作用
通过对常见盐的化学性质的分析,概括出盐的一般性质,
创设情境
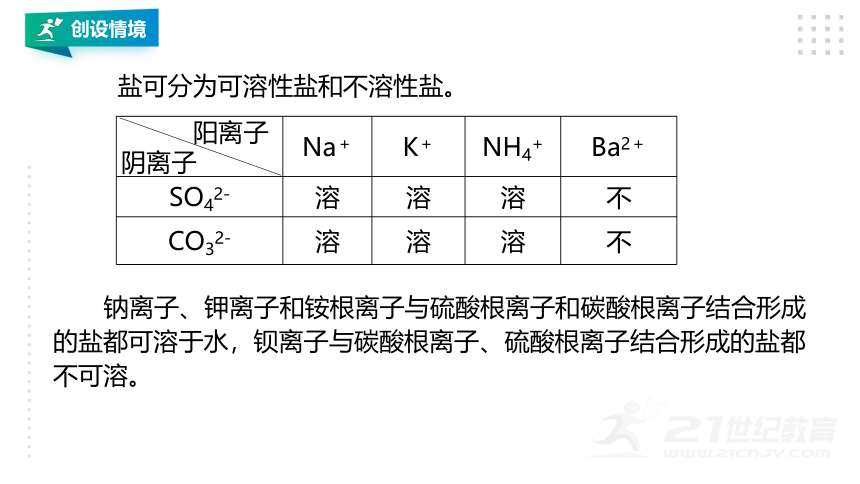
阳离子 阴离子 Na+ K+ NH4+ Ba2+
SO42- 溶 溶 溶 不
CO32- 溶 溶 溶 不
盐可分为可溶性盐和不溶性盐。
钠离子、钾离子和铵根离子与硫酸根离子和碳酸根离子结合形成的盐都可溶于水,钡离子与碳酸根离子、硫酸根离子结合形成的盐都不可溶。
探究实践
盐的溶解性有何规律呢?
查看附录2“部分酸、碱和盐的溶解性表(20℃)
盐是金属阳离子(或NH4+)和酸根离子构成的化合物。
含NH4+、K+、Na+的盐都可溶;
含NO3-的盐都可溶。
含Cl-的盐为盐酸盐;
盐酸盐只有AgCl不溶。
含SO42-的盐为硫酸盐;
硫酸盐只有硫酸钡不溶。
含CO32-的盐为碳酸盐;
碳酸盐含NH4+、K+、Na+的都可溶。
探究实践
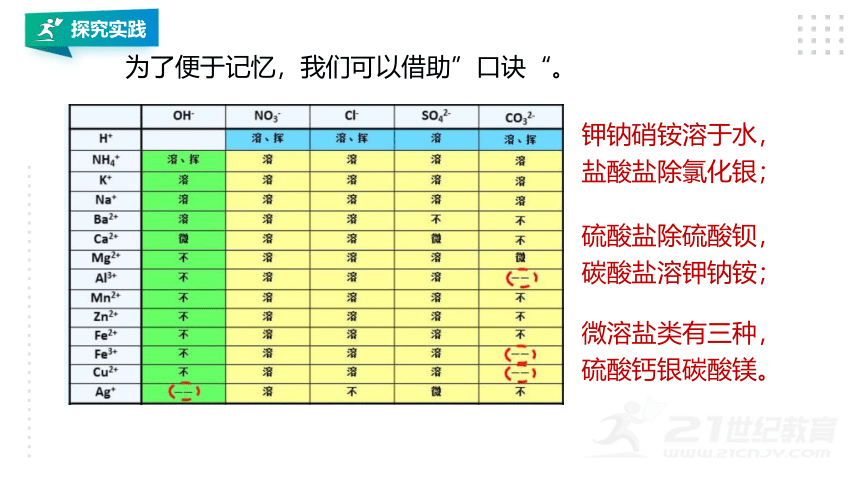
为了便于记忆,我们可以借助”口诀“。
钾钠硝铵溶于水,
盐酸盐除氯化银;
硫酸盐除硫酸钡,
碳酸盐溶钾钠铵;
微溶盐类有三种,
硫酸钙银碳酸镁。
科学思维
根据已学知识归纳一些沉淀的性质。
物质名称 化学式 颜色 与酸反应
氯化银
硫酸钡
碳酸钙
碳酸钡
氢氧化镁
氢氧化铜
氢氧化铁
AgCl
白色
不溶于酸
白色
不溶于酸
BaSO4
CaCO3
白色
溶于酸,产生CO2
BaCO3
白色
溶于酸,产生CO2
Mg(OH)2
白色
溶于酸,不产生气泡
Cu(OH)2
Fe(OH)3
蓝色絮状
红褐色絮状
溶于酸,不产生气泡
溶于酸,不产生气泡
人们常利用一些盐的溶解性来实现物质的制取、提纯和鉴别,盐的制取主要有以下几种方法:
(1)物理方法提取:有些盐是天然存在的,通过蒸发水、降温等方法析出晶体。
探究实践
①蒸发结晶:如从海水、盐湖或盐井中提取食盐。
②降温结晶:如从盐湖中提取纯碱。
从盐湖中“夏天晒盐”,----蒸发结晶;
从盐湖中“冬天捞碱”,----降温结晶。
(2)化学方法制取:通过物质间的化学反应来制取。
①我国化学家侯德榜发明的“侯氏制碱法”。
NaCl+NH3+H2O+CO2=NH4Cl+NaHCO3↓
NaHCO3的溶解度小,会结晶析出。
2NaHCO3===Na2CO3+H2O+CO2↑
加热
盐的制取方法:
探究实践
②酸 + 碱 = 盐+ 水
2NaOH + H2SO4 = Na2SO4 + 2H2O
③盐 + 盐 = 新盐1+ 新盐2
Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl
还有哪些方法有盐生成?课后与同学讨论列举。
探究实践
在盛有 Na2CO3 溶液的试管里加入 CaCl2 溶液,可发现:______________________。
Na2CO3溶液
CaCl2 溶液
产生白色沉淀。
Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl
盐 + 盐 = 新盐1 + 新盐2
两种化合物互相交换成分生成两种新的化合物的反应。
复分解反应:
CaCO3 溶解度小,从溶液中析出,沉淀。
Na2CO3 溶液中
含有的离子
CaCl2溶液中
含有的离子
2Na+
CO32—
Ca2+
2Cl—
2NaCl
CaCO3
Na2CO3+CaCl2 = CaCO3↓+ 2NaCl
AB + CD = AD + CB
互相交换成分,反应前后各元素的化合价不变。
探究实践
探究实践
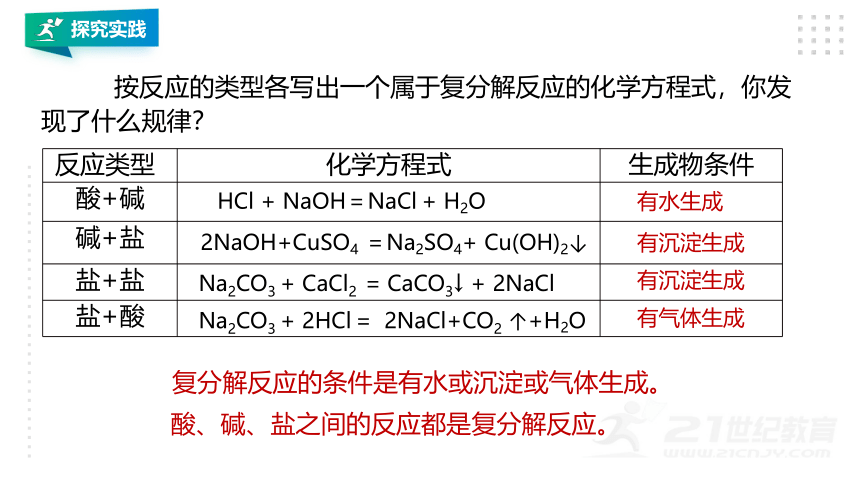
按反应的类型各写出一个属于复分解反应的化学方程式,你发现了什么规律?
反应类型 化学方程式 生成物条件
酸+碱
碱+盐
盐+盐
盐+酸
HCl + NaOH=NaCl + H2O
2NaOH+CuSO4 =Na2SO4+ Cu(OH)2↓
Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl
Na2CO3 + 2HCl = 2NaCl+CO2 ↑+H2O
有水生成
有沉淀生成
有沉淀生成
有气体生成
复分解反应的条件是有水或沉淀或气体生成。
酸、碱、盐之间的反应都是复分解反应。
探究实践
Na2CO3+CaCl2 = CaCO3↓ +2NaCl
2NaOH + H2SO4 = Na2SO4 + 2H2O
2HCl + Na2CO3 = 2NaCl+ H2O + CO2↑
OH- + H+ = H2O
2H+ + CO32- = H2O + CO2↑
复分解反应的实质是相互交换离子,结合生成沉淀或气体或水。
2Na+ + CO32-+Ca2+ + 2Cl-= CaCO3↓ + 2Na+ + 2Cl-
2Na+ + 2OH- + 2H+ + SO42- = 2Na+ + SO42- + 2H2O
2H+ + 2Cl- + 2Na++CO32- = 2Na++2Cl- + H2O + CO2↑
写出下列反应的化学方程式反应前后的离子符号。复分解反应的实质是什么?
Ca2++CO32- = CaCO3↓
参照酸和碱性质的推断方法,你能否推断出盐有哪些性质?
科学思维
(1)盐的性质
反应条件
(2)盐的性质
反应条件
实例
(3)盐的性质
反应条件
实例
盐+酸=新盐+新酸
AgNO3 + HCl = AgCl ↓+ HNO3
2HCl +Na2CO3 =2NaCl+H2O + CO2↑
①酸溶于水;②有沉淀或气体生成
实例
盐+碱=新盐+新碱
①反应物都溶于水;②生成物有沉淀
盐+盐=新盐1+新盐2
①反应物都溶于水;②生成物有沉淀
Na2CO3+CaCl2 = CaCO3↓ +2NaCl
CuSO4+2NaOH= Cu(OH)2↓ +Na2SO4
“庄稼一枝花,全靠肥当家”。农作物正常的生长发育和开花结果,除了需要一定的光照、水分、空气和温度条件外,还需要从外界吸收各种养料,主要营养是含氮、磷、钾的盐。
探究实践
CO(NH2)2
NH4HCO3
KCl
KNO3
Ca(H2PO4)2·H2O、CaSO4和少量磷酸
氮肥
钾肥
复合肥料
含有氮元素。
含有磷元素。
含有钾元素。
含有两种或两种以上主要营养元素
磷肥
氮肥
磷肥
钾肥
复合肥料
(NH4)2SO4
NH4HCO3
NaNO3
NH4Cl
Ca(H2PO4)2
Ca3PO4
K2SO4
KCl
K2CO3
KNO3
(NH4)3PO4
NH4NO3
分析下列化肥的组成,你认为它们各属于哪一类肥料?用线条将它们连起来。
探究实践
人的尿液里有从体内排出的含氮有机物,如尿素[CO(NH2)2],它们在微生物的作用下会转变为铵盐或氨气。
探究实践
工业上常用酸与氨气(NH3)反应制氮肥(铵盐):
铵盐是含NH4+的盐,都是易溶于水的。
NH3+H2O+CO2 = NH4HCO3(碳铵)
2NH3+H2SO4 = (NH4)2SO4(硫铵)
铵盐由NH4和酸根离子构成。
探究实践
化肥在植物生长中有什么作用?缺乏时又有什么表现?
正常
缺氮
缺磷
缺钾
氮是组成叶绿素的重要元素,促使作物的茎叶生长茂盛。
缺氮时叶片发黄,生长缓慢。
氮肥
主要的作用:
缺乏时表现:
探究实践
化肥在植物生长中有什么作用?缺乏时又有什么表现?
正常
缺氮
缺磷
缺钾
缺磷时根系短小,叶暗绿带红。
磷肥
主要的作用:
缺乏时表现:
促进农作物根系发达,多开花结果。
探究实践
化肥在植物生长中有什么作用?缺乏时又有什么表现?
正常
缺氮
缺磷
缺钾
缺钾时茎细小,易倒伏,叶有褐斑。
钾肥
主要的作用:
缺乏时表现:
促使茎秆粗壮,促进糖和淀粉的生成。
收集几种化学肥料的资料,讨论它们的性质和作用。
探究实践
(1)硫酸铵[(NH4)2SO4]:白色晶体,易溶于水,常温时性质稳定,可作氮肥使用;避免与碱性物质(如草木灰)混合使用。
铵盐与碱性物质混合使用时,会放出氨气,降低肥效。
(2)碳酸氢铵(NH4HCO3):白色晶体,易溶于水,会受潮,易分解,施后盖土,可作基肥和追肥。
NH4HCO3=NH3↑+CO2↑+H2O
“庄稼一枝花,全靠肥当家”,是否可以长期施用化肥而且施肥越多越好呢?
探究实践
(1)长期使用化肥往往会使土壤板结,破坏土壤结构;
通常需要施一些农家肥料(有机肥),有利于改良土壤结构,提高土壤肥力。
(2)过多施肥会使植物根细胞失水,植物“萎蔫”。
合理施肥!
植物的正常生长除需要合理施肥,还需防治病害?波尔多液是常用的杀菌农药,它是如何配制的?
波尔多液是无机铜素杀菌剂,是硫酸铜、氢氧化铜和氢氧化钙的碱式复盐。
由法国人 A·米亚尔代于波尔多城发现其杀菌作用,因此得名。
将硫酸铜溶液慢慢倒入石灰乳中,同时用玻璃棒不断搅拌,即成波尔多液。
Cu(SO)4+Ca(OH)2=Cu(OH)2↓+Ca(SO)4
探究实践
探究实践
认识盐的一些性质
(1)取 3 支试管,分别倒入稀硫酸、硫酸铜溶液、碳酸钠溶液。在这3 支试管中分别滴加少量氯化钡溶液,观察到的现象是 _______________________。
再往这 3 支试管里各滴入几滴稀硝酸,振荡后观察到的现象是 ________________________________________________________________
______________________________________________________。
都产生白色沉淀
装稀硫酸和硫酸铜溶液的试管中白色沉淀不溶解,
装碳酸钠溶液的试管中白色沉淀溶解,产生气泡
BaCl2+H2SO4 =BaSO4↓+2HCl
BaCl2+CuSO4 =BaSO4↓+CuCl2
BaCl2+Na2CO3=BaCO3↓+2NaCl
盐+酸=新盐+新酸
盐+盐=新盐1+新盐2
检验SO4:
用BaCl2溶液和稀硝酸,产生不溶于酸的白色沉淀,
加稀硝酸的目的是排除CO32-的干扰。
认识盐的一些性质
(1)取 3 支试管,分别倒入稀盐酸、氯化钠溶液、碳酸钠溶液。在这3 支试管中分别滴加几滴硝酸银溶液,观察到的现象是 _______________________。
再往这 3 支试管里各滴入几滴稀硝酸,振荡后观察到的现象是 ________________________________________________________________
______________________________________________________。
都产生白色沉淀
装稀盐酸和氯化钠溶液的试管中白色沉淀不溶解,
装碳酸钠溶液的试管中白色沉淀溶解,产生气泡
2AgNO3+Na2CO3=Ag2CO3↓+2NaNO3
AgNO3+NaCl=AgCl↓+NaNO3
AgNO3+HCl=AgCl↓+HNO3
盐+酸=新盐+新酸
盐+盐=新盐1+新盐2
检验Cl-:
用AgNO3溶液和稀硝酸,产生不溶于酸的白色沉淀,
加稀硝酸的目的是排除CO32-的干扰。
探究实践
课堂反思
2.我们知道可用氯化钡溶液检验稀硫酸,可用硝酸银溶液检验稀盐酸,为什么在本实验中,还可用这两种溶液分别检验含 SO42-和 Cl-的化合物?
1.两种化合物反应生成两种化合物一定是复分解反应吗?
不是。由两种化合物互相交换成分,生成另外两种化合物的反应,叫复分解反应。其实质是:两种物质在水溶液中相互交换成分,结合成难电离的物质--沉淀或气体或水。
氯化钡与稀硫酸反应的实质是Ba2+和SO42-反应生成难溶的硫酸钡。
硝酸银与稀盐酸反应的实质是Ag+和Cl-反应生成难溶的氯化银。
3.区分硫酸钠溶液和氯化钠溶液,能用硝酸银溶液吗?
不能。硝酸银溶液滴入到氯化钠溶液和硫酸钠溶液中,Ag2SO4是微溶的,都能产生白色浑浊的现象,没有明显区别。应用含Ba2+的溶液来区分。
迁移应用
1. 以下各类盐中,除钾盐、钠盐、铵盐能溶于水外,其余大都不溶于水的盐是( )
①磷酸盐 ②碳酸盐 ③硝酸盐 ④硫酸盐 ⑤盐酸盐
A.①② B.②④ C.①③ D.①⑤
A
2.下列反应属于复分解反应的是( )
A.CO2+Ca(OH)2=CaCO3↓+H2O
B.2H2O2 == 2H2O+O2↑
C.3NaOH+FeCl3=Fe(OH)3↓+3NaCl
D.CO2+H2O=H2CO3
MnO2
C
4.有 3 瓶无色溶液:硝酸银溶液、碳酸钠溶液和氯化钙溶液,试用一种试剂把它们区别开来,设计实验方案并完成实验。
3.下列化肥,能促使根系发达,耐寒耐旱的是( )
A.尿素 B.氯化钾 C.磷酸二氢钙 D.硫酸铵
C
分别取三种溶液少量于三支试管中,然后向三支试管中分别滴加稀盐酸,有白色沉淀生成的与氨溶液是硝酸银溶液,有气泡产生的是碳酸钠溶液,无明显现象的是氯化钙溶液。
迁移应用
盐的溶解性
钾钠硝铵溶于水
盐酸盐除氯化银
硫酸盐除硫酸钡
碳酸盐溶钾钠铵
盐的制取
物理方法:从海水、盐湖中结晶
化学方法:化学反应生成
复分解反应
概念:两种化合物相互交换成分,生成两种新化合物
通式:AB + CD = AD + CB
条件:有沉淀或气体或水生成
化学性质
盐+酸=新盐+新酸
盐+碱=新盐+新碱
盐+盐=新盐1+新盐2
离子
检验
用BaCl2溶液和稀硝酸检验SO42-
用AgNO3溶液和稀硝酸检验Cl-
化 肥
氮肥:含N,促进茎叶生长茂盛
磷肥: 含P,促进根系发达
钾肥:含K,促进茎粗壮
复合肥:含N、P、K的两种及以上
合理施肥
盐和化肥
第6节 几种重要的盐(第2课时)
板书设计
https://www.21cnjy.com/help/help_extract.php
浙教版 九年级上
第6节 几种重要的盐
(第2课时)
教材解析
【核心概念】
1.物质的结构与性质 结构与功能
【学习内容与要求】
1.4 常见的化合物 2.3物质变化的特征
理解复分解反应的实质,知道复分解反应发生的条件
根据盐的性质进行盐的制取
化肥类型的判定和化肥的作用
通过对常见盐的化学性质的分析,概括出盐的一般性质,
创设情境
阳离子 阴离子 Na+ K+ NH4+ Ba2+
SO42- 溶 溶 溶 不
CO32- 溶 溶 溶 不
盐可分为可溶性盐和不溶性盐。
钠离子、钾离子和铵根离子与硫酸根离子和碳酸根离子结合形成的盐都可溶于水,钡离子与碳酸根离子、硫酸根离子结合形成的盐都不可溶。
探究实践
盐的溶解性有何规律呢?
查看附录2“部分酸、碱和盐的溶解性表(20℃)
盐是金属阳离子(或NH4+)和酸根离子构成的化合物。
含NH4+、K+、Na+的盐都可溶;
含NO3-的盐都可溶。
含Cl-的盐为盐酸盐;
盐酸盐只有AgCl不溶。
含SO42-的盐为硫酸盐;
硫酸盐只有硫酸钡不溶。
含CO32-的盐为碳酸盐;
碳酸盐含NH4+、K+、Na+的都可溶。
探究实践
为了便于记忆,我们可以借助”口诀“。
钾钠硝铵溶于水,
盐酸盐除氯化银;
硫酸盐除硫酸钡,
碳酸盐溶钾钠铵;
微溶盐类有三种,
硫酸钙银碳酸镁。
科学思维
根据已学知识归纳一些沉淀的性质。
物质名称 化学式 颜色 与酸反应
氯化银
硫酸钡
碳酸钙
碳酸钡
氢氧化镁
氢氧化铜
氢氧化铁
AgCl
白色
不溶于酸
白色
不溶于酸
BaSO4
CaCO3
白色
溶于酸,产生CO2
BaCO3
白色
溶于酸,产生CO2
Mg(OH)2
白色
溶于酸,不产生气泡
Cu(OH)2
Fe(OH)3
蓝色絮状
红褐色絮状
溶于酸,不产生气泡
溶于酸,不产生气泡
人们常利用一些盐的溶解性来实现物质的制取、提纯和鉴别,盐的制取主要有以下几种方法:
(1)物理方法提取:有些盐是天然存在的,通过蒸发水、降温等方法析出晶体。
探究实践
①蒸发结晶:如从海水、盐湖或盐井中提取食盐。
②降温结晶:如从盐湖中提取纯碱。
从盐湖中“夏天晒盐”,----蒸发结晶;
从盐湖中“冬天捞碱”,----降温结晶。
(2)化学方法制取:通过物质间的化学反应来制取。
①我国化学家侯德榜发明的“侯氏制碱法”。
NaCl+NH3+H2O+CO2=NH4Cl+NaHCO3↓
NaHCO3的溶解度小,会结晶析出。
2NaHCO3===Na2CO3+H2O+CO2↑
加热
盐的制取方法:
探究实践
②酸 + 碱 = 盐+ 水
2NaOH + H2SO4 = Na2SO4 + 2H2O
③盐 + 盐 = 新盐1+ 新盐2
Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl
还有哪些方法有盐生成?课后与同学讨论列举。
探究实践
在盛有 Na2CO3 溶液的试管里加入 CaCl2 溶液,可发现:______________________。
Na2CO3溶液
CaCl2 溶液
产生白色沉淀。
Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl
盐 + 盐 = 新盐1 + 新盐2
两种化合物互相交换成分生成两种新的化合物的反应。
复分解反应:
CaCO3 溶解度小,从溶液中析出,沉淀。
Na2CO3 溶液中
含有的离子
CaCl2溶液中
含有的离子
2Na+
CO32—
Ca2+
2Cl—
2NaCl
CaCO3
Na2CO3+CaCl2 = CaCO3↓+ 2NaCl
AB + CD = AD + CB
互相交换成分,反应前后各元素的化合价不变。
探究实践
探究实践
按反应的类型各写出一个属于复分解反应的化学方程式,你发现了什么规律?
反应类型 化学方程式 生成物条件
酸+碱
碱+盐
盐+盐
盐+酸
HCl + NaOH=NaCl + H2O
2NaOH+CuSO4 =Na2SO4+ Cu(OH)2↓
Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl
Na2CO3 + 2HCl = 2NaCl+CO2 ↑+H2O
有水生成
有沉淀生成
有沉淀生成
有气体生成
复分解反应的条件是有水或沉淀或气体生成。
酸、碱、盐之间的反应都是复分解反应。
探究实践
Na2CO3+CaCl2 = CaCO3↓ +2NaCl
2NaOH + H2SO4 = Na2SO4 + 2H2O
2HCl + Na2CO3 = 2NaCl+ H2O + CO2↑
OH- + H+ = H2O
2H+ + CO32- = H2O + CO2↑
复分解反应的实质是相互交换离子,结合生成沉淀或气体或水。
2Na+ + CO32-+Ca2+ + 2Cl-= CaCO3↓ + 2Na+ + 2Cl-
2Na+ + 2OH- + 2H+ + SO42- = 2Na+ + SO42- + 2H2O
2H+ + 2Cl- + 2Na++CO32- = 2Na++2Cl- + H2O + CO2↑
写出下列反应的化学方程式反应前后的离子符号。复分解反应的实质是什么?
Ca2++CO32- = CaCO3↓
参照酸和碱性质的推断方法,你能否推断出盐有哪些性质?
科学思维
(1)盐的性质
反应条件
(2)盐的性质
反应条件
实例
(3)盐的性质
反应条件
实例
盐+酸=新盐+新酸
AgNO3 + HCl = AgCl ↓+ HNO3
2HCl +Na2CO3 =2NaCl+H2O + CO2↑
①酸溶于水;②有沉淀或气体生成
实例
盐+碱=新盐+新碱
①反应物都溶于水;②生成物有沉淀
盐+盐=新盐1+新盐2
①反应物都溶于水;②生成物有沉淀
Na2CO3+CaCl2 = CaCO3↓ +2NaCl
CuSO4+2NaOH= Cu(OH)2↓ +Na2SO4
“庄稼一枝花,全靠肥当家”。农作物正常的生长发育和开花结果,除了需要一定的光照、水分、空气和温度条件外,还需要从外界吸收各种养料,主要营养是含氮、磷、钾的盐。
探究实践
CO(NH2)2
NH4HCO3
KCl
KNO3
Ca(H2PO4)2·H2O、CaSO4和少量磷酸
氮肥
钾肥
复合肥料
含有氮元素。
含有磷元素。
含有钾元素。
含有两种或两种以上主要营养元素
磷肥
氮肥
磷肥
钾肥
复合肥料
(NH4)2SO4
NH4HCO3
NaNO3
NH4Cl
Ca(H2PO4)2
Ca3PO4
K2SO4
KCl
K2CO3
KNO3
(NH4)3PO4
NH4NO3
分析下列化肥的组成,你认为它们各属于哪一类肥料?用线条将它们连起来。
探究实践
人的尿液里有从体内排出的含氮有机物,如尿素[CO(NH2)2],它们在微生物的作用下会转变为铵盐或氨气。
探究实践
工业上常用酸与氨气(NH3)反应制氮肥(铵盐):
铵盐是含NH4+的盐,都是易溶于水的。
NH3+H2O+CO2 = NH4HCO3(碳铵)
2NH3+H2SO4 = (NH4)2SO4(硫铵)
铵盐由NH4和酸根离子构成。
探究实践
化肥在植物生长中有什么作用?缺乏时又有什么表现?
正常
缺氮
缺磷
缺钾
氮是组成叶绿素的重要元素,促使作物的茎叶生长茂盛。
缺氮时叶片发黄,生长缓慢。
氮肥
主要的作用:
缺乏时表现:
探究实践
化肥在植物生长中有什么作用?缺乏时又有什么表现?
正常
缺氮
缺磷
缺钾
缺磷时根系短小,叶暗绿带红。
磷肥
主要的作用:
缺乏时表现:
促进农作物根系发达,多开花结果。
探究实践
化肥在植物生长中有什么作用?缺乏时又有什么表现?
正常
缺氮
缺磷
缺钾
缺钾时茎细小,易倒伏,叶有褐斑。
钾肥
主要的作用:
缺乏时表现:
促使茎秆粗壮,促进糖和淀粉的生成。
收集几种化学肥料的资料,讨论它们的性质和作用。
探究实践
(1)硫酸铵[(NH4)2SO4]:白色晶体,易溶于水,常温时性质稳定,可作氮肥使用;避免与碱性物质(如草木灰)混合使用。
铵盐与碱性物质混合使用时,会放出氨气,降低肥效。
(2)碳酸氢铵(NH4HCO3):白色晶体,易溶于水,会受潮,易分解,施后盖土,可作基肥和追肥。
NH4HCO3=NH3↑+CO2↑+H2O
“庄稼一枝花,全靠肥当家”,是否可以长期施用化肥而且施肥越多越好呢?
探究实践
(1)长期使用化肥往往会使土壤板结,破坏土壤结构;
通常需要施一些农家肥料(有机肥),有利于改良土壤结构,提高土壤肥力。
(2)过多施肥会使植物根细胞失水,植物“萎蔫”。
合理施肥!
植物的正常生长除需要合理施肥,还需防治病害?波尔多液是常用的杀菌农药,它是如何配制的?
波尔多液是无机铜素杀菌剂,是硫酸铜、氢氧化铜和氢氧化钙的碱式复盐。
由法国人 A·米亚尔代于波尔多城发现其杀菌作用,因此得名。
将硫酸铜溶液慢慢倒入石灰乳中,同时用玻璃棒不断搅拌,即成波尔多液。
Cu(SO)4+Ca(OH)2=Cu(OH)2↓+Ca(SO)4
探究实践
探究实践
认识盐的一些性质
(1)取 3 支试管,分别倒入稀硫酸、硫酸铜溶液、碳酸钠溶液。在这3 支试管中分别滴加少量氯化钡溶液,观察到的现象是 _______________________。
再往这 3 支试管里各滴入几滴稀硝酸,振荡后观察到的现象是 ________________________________________________________________
______________________________________________________。
都产生白色沉淀
装稀硫酸和硫酸铜溶液的试管中白色沉淀不溶解,
装碳酸钠溶液的试管中白色沉淀溶解,产生气泡
BaCl2+H2SO4 =BaSO4↓+2HCl
BaCl2+CuSO4 =BaSO4↓+CuCl2
BaCl2+Na2CO3=BaCO3↓+2NaCl
盐+酸=新盐+新酸
盐+盐=新盐1+新盐2
检验SO4:
用BaCl2溶液和稀硝酸,产生不溶于酸的白色沉淀,
加稀硝酸的目的是排除CO32-的干扰。
认识盐的一些性质
(1)取 3 支试管,分别倒入稀盐酸、氯化钠溶液、碳酸钠溶液。在这3 支试管中分别滴加几滴硝酸银溶液,观察到的现象是 _______________________。
再往这 3 支试管里各滴入几滴稀硝酸,振荡后观察到的现象是 ________________________________________________________________
______________________________________________________。
都产生白色沉淀
装稀盐酸和氯化钠溶液的试管中白色沉淀不溶解,
装碳酸钠溶液的试管中白色沉淀溶解,产生气泡
2AgNO3+Na2CO3=Ag2CO3↓+2NaNO3
AgNO3+NaCl=AgCl↓+NaNO3
AgNO3+HCl=AgCl↓+HNO3
盐+酸=新盐+新酸
盐+盐=新盐1+新盐2
检验Cl-:
用AgNO3溶液和稀硝酸,产生不溶于酸的白色沉淀,
加稀硝酸的目的是排除CO32-的干扰。
探究实践
课堂反思
2.我们知道可用氯化钡溶液检验稀硫酸,可用硝酸银溶液检验稀盐酸,为什么在本实验中,还可用这两种溶液分别检验含 SO42-和 Cl-的化合物?
1.两种化合物反应生成两种化合物一定是复分解反应吗?
不是。由两种化合物互相交换成分,生成另外两种化合物的反应,叫复分解反应。其实质是:两种物质在水溶液中相互交换成分,结合成难电离的物质--沉淀或气体或水。
氯化钡与稀硫酸反应的实质是Ba2+和SO42-反应生成难溶的硫酸钡。
硝酸银与稀盐酸反应的实质是Ag+和Cl-反应生成难溶的氯化银。
3.区分硫酸钠溶液和氯化钠溶液,能用硝酸银溶液吗?
不能。硝酸银溶液滴入到氯化钠溶液和硫酸钠溶液中,Ag2SO4是微溶的,都能产生白色浑浊的现象,没有明显区别。应用含Ba2+的溶液来区分。
迁移应用
1. 以下各类盐中,除钾盐、钠盐、铵盐能溶于水外,其余大都不溶于水的盐是( )
①磷酸盐 ②碳酸盐 ③硝酸盐 ④硫酸盐 ⑤盐酸盐
A.①② B.②④ C.①③ D.①⑤
A
2.下列反应属于复分解反应的是( )
A.CO2+Ca(OH)2=CaCO3↓+H2O
B.2H2O2 == 2H2O+O2↑
C.3NaOH+FeCl3=Fe(OH)3↓+3NaCl
D.CO2+H2O=H2CO3
MnO2
C
4.有 3 瓶无色溶液:硝酸银溶液、碳酸钠溶液和氯化钙溶液,试用一种试剂把它们区别开来,设计实验方案并完成实验。
3.下列化肥,能促使根系发达,耐寒耐旱的是( )
A.尿素 B.氯化钾 C.磷酸二氢钙 D.硫酸铵
C
分别取三种溶液少量于三支试管中,然后向三支试管中分别滴加稀盐酸,有白色沉淀生成的与氨溶液是硝酸银溶液,有气泡产生的是碳酸钠溶液,无明显现象的是氯化钙溶液。
迁移应用
盐的溶解性
钾钠硝铵溶于水
盐酸盐除氯化银
硫酸盐除硫酸钡
碳酸盐溶钾钠铵
盐的制取
物理方法:从海水、盐湖中结晶
化学方法:化学反应生成
复分解反应
概念:两种化合物相互交换成分,生成两种新化合物
通式:AB + CD = AD + CB
条件:有沉淀或气体或水生成
化学性质
盐+酸=新盐+新酸
盐+碱=新盐+新碱
盐+盐=新盐1+新盐2
离子
检验
用BaCl2溶液和稀硝酸检验SO42-
用AgNO3溶液和稀硝酸检验Cl-
化 肥
氮肥:含N,促进茎叶生长茂盛
磷肥: 含P,促进根系发达
钾肥:含K,促进茎粗壮
复合肥:含N、P、K的两种及以上
合理施肥
盐和化肥
第6节 几种重要的盐(第2课时)
板书设计
https://www.21cnjy.com/help/help_extract.php
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
