鲁科版 高中化学 必修第一册 第1章 第2节 第1课时 研究物质性质的基本方法 课件(60张)
文档属性
| 名称 | 鲁科版 高中化学 必修第一册 第1章 第2节 第1课时 研究物质性质的基本方法 课件(60张) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-07 22:31:34 | ||
图片预览











文档简介
(共60张PPT)
第2节 研究物质性质的方法和程序
第1课时 研究物质性质的基本方法
课前自主学习
学习任务一 研究物质性质的基本
方法及钠的性质
任务驱动:
我们在初中学习了铁的性质,铁物理性质是通过什么方法得到的
1.研究物质性质的基本方法
常用方法有观察法、_____法、_____法、_____法等,其中观察法是一种有计划、
有目的地运用_____或借助_____考察研究对象的方法。
实验
分类
比较
感官
仪器
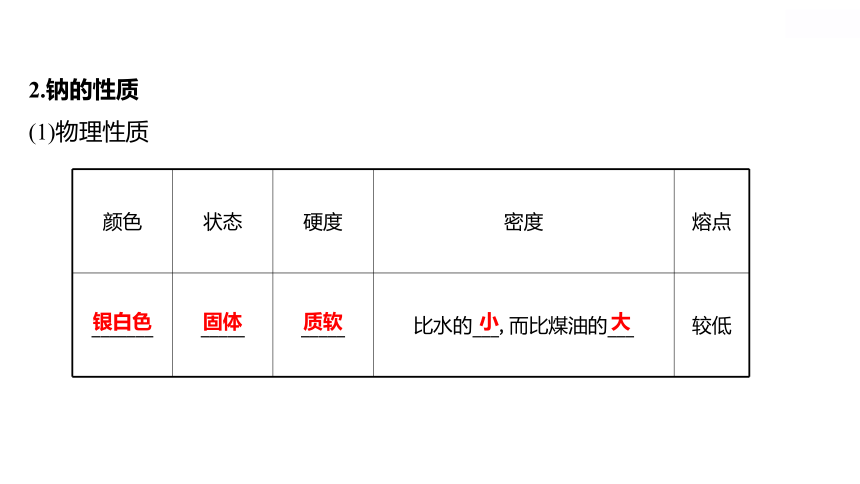
2.钠的性质
(1)物理性质
颜色 状态 硬度 密度 熔点
_______ _____ _____ 比水的___,而比煤油的___ 较低
银白色
固体
质软
小
大
(2)化学性质
钠的化学性质非常活泼,在空气中易与O2和H2O发生反应。
①钠与H2O反应:________________________(写化学方程式,下同)。
②钠与O2反应。
a.常温下:________________;
b.加热时:________________。
2Na+2H2O===2NaOH+H2↑
4Na+O2===2Na2O
2Na+O2 Na2O2
【想一想】在钠与氧气反应的生成物中,钠、氧元素的化合价是否相同 请说明理由。
提示:在氧化钠、过氧化钠中,钠元素的化合价都是+1,氧化钠中氧元素的化合价是-2,过氧化钠中氧元素的化合价是-1。
3.钠的保存及用途
(1)实验室中,少量的钠保存在_____中,大量的钠保存在液态石蜡中。
(2)钠、钾合金可用作原子反应堆的导热剂,高压钠灯常用作路灯,金属钠还可用于
钛、锆、铌、钽等金属的冶炼。
煤油
学习任务二 氧化钠、过氧化钠的性质
任务驱动:
金属钠在不同条件下与氧气反应生成物不相同,二者的性质有何差别
1.物理性质:氧化钠是一种_____色固体,过氧化钠是一种_____色固体。
2.化学性质
Na2O与H2O反应的化学方程式为____________________。
Na2O2与H2O反应的化学方程式为___________________________。
Na2O2与CO2反应的化学方程式为___________________________。
银白
淡黄
Na2O+H2O===2NaOH
2Na2O2+2H2O===4NaOH+O2↑
2Na2O2+2CO2===2Na2CO3+O2
【做一做】在实验室里为了研究钠的性质,做了如下实验:
(1)取用浸没在煤油中的金属钠的操作方法是_________________________________
_________________________________________________________________________。
(2)在空气中切开一小块金属钠,可以看到断面呈_______,具有__________,但断面很
快变___,反应的化学方程式为________________。若把钠放在石棉网上加热可观
察到__________________________________________,反应的化学方程式为
________________。
用镊子取出钠块,用滤纸吸干钠块
表面的煤油,在玻璃片上用小刀切下一小粒备用,余下的钠全部放回试剂瓶中
银白色
金属光泽
暗
4Na+O2===2Na2O
钠熔成小球,发出黄色火焰,生成淡黄色固体
2Na+O2 Na2O2
课堂合作探究
2.实验验证
(1)实验步骤:用镊子将金属钠从试剂瓶中取出,用滤纸将其表面煤油吸干,在玻璃
片上用小刀切下黄豆粒大小的钠块,放入盛硫酸铜溶液的烧杯中。
(2)实验现象:___________________________________________。
3.解释与结论
(1)分析钠与水反应的剧烈程度并写出反应的化学方程式。
提示:2Na + 2H2O===2NaOH + H2↑。
(2)写出总反应的化学方程式。
提示:CuSO4+2Na+2H2O===Na2SO4 +Cu(OH)2↓+H2↑。
硫酸铜溶液中有气泡冒出,产生蓝色沉淀
4.迁移应用:如果将硫酸铜溶液换成氯化铁溶液,预测反应的现象,并写出发生反应的化学方程式。
提示:溶液产生气泡,并有红褐色沉淀生成。
2Na+2H2O===2NaOH+H2↑,
3NaOH+FeCl3===Fe(OH)3↓+3NaCl。
【问题探究】
1.钠着火时,能否用干粉灭火器或水灭火 应如何灭火
提示:不能。因为金属钠燃烧的生成物过氧化钠可以与二氧化碳和水反应,只能用沙子盖灭。
2.Na2O和Na2O2与水的反应都是化合反应吗 为什么
提示:Na2O与水的反应中只有NaOH生成,所以是化合反应,但是Na2O2与水的反应除了有NaOH生成外还有氧气生成,所以不是化合反应。
课堂素养达标
课题 金属钠与氧气反应的实验
实验
目的 (1)探究金属钠与氧气的反应;(2)认识条件控制在实验研究中的意义
试剂与
仪器 金属钠、镊子、小刀、酒精灯、石棉网、铁架台、铁圈、滤纸、火柴
实验
步骤 (1)将切好的金属钠放置在空气中,使其与氧气反应;
(2)将金属钠放在石棉网上加热,使其与氧气反应
实验
记录 实验内容 实验现象 结论
金属钠放置在空气中
在空气中加热金属钠
第2节 研究物质性质的方法和程序
第1课时 研究物质性质的基本方法
课前自主学习
学习任务一 研究物质性质的基本
方法及钠的性质
任务驱动:
我们在初中学习了铁的性质,铁物理性质是通过什么方法得到的
1.研究物质性质的基本方法
常用方法有观察法、_____法、_____法、_____法等,其中观察法是一种有计划、
有目的地运用_____或借助_____考察研究对象的方法。
实验
分类
比较
感官
仪器
2.钠的性质
(1)物理性质
颜色 状态 硬度 密度 熔点
_______ _____ _____ 比水的___,而比煤油的___ 较低
银白色
固体
质软
小
大
(2)化学性质
钠的化学性质非常活泼,在空气中易与O2和H2O发生反应。
①钠与H2O反应:________________________(写化学方程式,下同)。
②钠与O2反应。
a.常温下:________________;
b.加热时:________________。
2Na+2H2O===2NaOH+H2↑
4Na+O2===2Na2O
2Na+O2 Na2O2
【想一想】在钠与氧气反应的生成物中,钠、氧元素的化合价是否相同 请说明理由。
提示:在氧化钠、过氧化钠中,钠元素的化合价都是+1,氧化钠中氧元素的化合价是-2,过氧化钠中氧元素的化合价是-1。
3.钠的保存及用途
(1)实验室中,少量的钠保存在_____中,大量的钠保存在液态石蜡中。
(2)钠、钾合金可用作原子反应堆的导热剂,高压钠灯常用作路灯,金属钠还可用于
钛、锆、铌、钽等金属的冶炼。
煤油
学习任务二 氧化钠、过氧化钠的性质
任务驱动:
金属钠在不同条件下与氧气反应生成物不相同,二者的性质有何差别
1.物理性质:氧化钠是一种_____色固体,过氧化钠是一种_____色固体。
2.化学性质
Na2O与H2O反应的化学方程式为____________________。
Na2O2与H2O反应的化学方程式为___________________________。
Na2O2与CO2反应的化学方程式为___________________________。
银白
淡黄
Na2O+H2O===2NaOH
2Na2O2+2H2O===4NaOH+O2↑
2Na2O2+2CO2===2Na2CO3+O2
【做一做】在实验室里为了研究钠的性质,做了如下实验:
(1)取用浸没在煤油中的金属钠的操作方法是_________________________________
_________________________________________________________________________。
(2)在空气中切开一小块金属钠,可以看到断面呈_______,具有__________,但断面很
快变___,反应的化学方程式为________________。若把钠放在石棉网上加热可观
察到__________________________________________,反应的化学方程式为
________________。
用镊子取出钠块,用滤纸吸干钠块
表面的煤油,在玻璃片上用小刀切下一小粒备用,余下的钠全部放回试剂瓶中
银白色
金属光泽
暗
4Na+O2===2Na2O
钠熔成小球,发出黄色火焰,生成淡黄色固体
2Na+O2 Na2O2
课堂合作探究
2.实验验证
(1)实验步骤:用镊子将金属钠从试剂瓶中取出,用滤纸将其表面煤油吸干,在玻璃
片上用小刀切下黄豆粒大小的钠块,放入盛硫酸铜溶液的烧杯中。
(2)实验现象:___________________________________________。
3.解释与结论
(1)分析钠与水反应的剧烈程度并写出反应的化学方程式。
提示:2Na + 2H2O===2NaOH + H2↑。
(2)写出总反应的化学方程式。
提示:CuSO4+2Na+2H2O===Na2SO4 +Cu(OH)2↓+H2↑。
硫酸铜溶液中有气泡冒出,产生蓝色沉淀
4.迁移应用:如果将硫酸铜溶液换成氯化铁溶液,预测反应的现象,并写出发生反应的化学方程式。
提示:溶液产生气泡,并有红褐色沉淀生成。
2Na+2H2O===2NaOH+H2↑,
3NaOH+FeCl3===Fe(OH)3↓+3NaCl。
【问题探究】
1.钠着火时,能否用干粉灭火器或水灭火 应如何灭火
提示:不能。因为金属钠燃烧的生成物过氧化钠可以与二氧化碳和水反应,只能用沙子盖灭。
2.Na2O和Na2O2与水的反应都是化合反应吗 为什么
提示:Na2O与水的反应中只有NaOH生成,所以是化合反应,但是Na2O2与水的反应除了有NaOH生成外还有氧气生成,所以不是化合反应。
课堂素养达标
课题 金属钠与氧气反应的实验
实验
目的 (1)探究金属钠与氧气的反应;(2)认识条件控制在实验研究中的意义
试剂与
仪器 金属钠、镊子、小刀、酒精灯、石棉网、铁架台、铁圈、滤纸、火柴
实验
步骤 (1)将切好的金属钠放置在空气中,使其与氧气反应;
(2)将金属钠放在石棉网上加热,使其与氧气反应
实验
记录 实验内容 实验现象 结论
金属钠放置在空气中
在空气中加热金属钠
