鲁科版 高中化学 必修第一册 第1章 第2节 第2课时 研究物质性质的基本程序 课件(79张)
文档属性
| 名称 | 鲁科版 高中化学 必修第一册 第1章 第2节 第2课时 研究物质性质的基本程序 课件(79张) |

|
|
| 格式 | ppt | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-08 00:00:00 | ||
图片预览









文档简介
(共79张PPT)
第2课时 研究物质性质的基本程序
课前自主学习
学习任务一 研究物质性质的基本程序
任务驱动:
由于被研究的物质性质往往具有一定的未知性,所以在研究物质性质的过程中,可能需要在“实验和观察”与“预测物质的性质”两个环节之间反复进行。进行实验时,先要对物质性质进行预测,然后去验证预测。
将研究物质性质的重要环节科学组合就形成了研究物质性质的基本程序。科学探究的主要环节有:
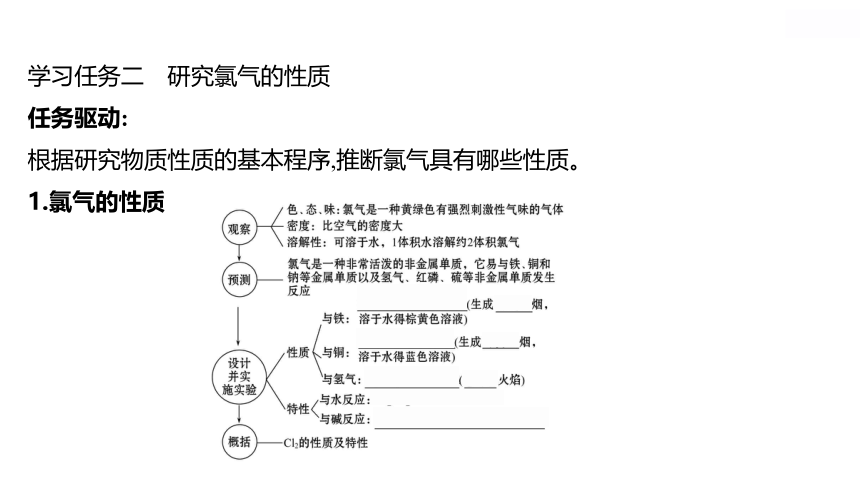
学习任务二 研究氯气的性质
任务驱动:
根据研究物质性质的基本程序,推断氯气具有哪些性质。
1.氯气的性质
【想一想】氯气有毒,如何闻氯气的气味
提示:闻氯气气味的方法是用手在瓶口轻轻扇动,使极少量的氯气飘进鼻孔。
2.次氯酸及次氯酸盐
(1)次氯酸
①酸性:属于___酸;酸性:HClO②不稳定性:____________________。
③强氧化性:杀菌、消毒、_____。
弱
2HClO 2HCl+O2↑
漂白
(2)次氯酸盐
①84消毒液:主要成分是NaClO。
②漂白粉:主要成分是______和________,有效成分是________。
工业上制漂白粉是用Cl2与石灰乳反应,反应的化学方程式为
_____________________________________。
3.氯气的用途:在工业上,氯气是一种重要的化工原料,大量用于制造_____、有机
溶剂和杀菌消毒剂。
CaCl2
Ca(ClO)2
Ca(ClO)2
2Ca(OH)2+2Cl2===CaCl2+Ca(ClO)2+2H2O
盐酸
【做一做】根据氯气的性质,填写下列空白。
(1)用注射器向一盛满氯气的矿泉水瓶中注入少量的水,充分振荡后,观察到矿泉水
瓶_____,矿泉水瓶中的溶液呈_______色,说明氯气能够溶于水,氯水中的主要溶质
是_____分子。
(2)如图所示,把红色纸条放在注射器内,然后将注射器的针头插入盛氯气的矿泉
水中,向外拉动注射器,使注射器内吸入少量氯气,一段时间后观察到注射器内的
红色纸条_______。
变瘪
浅黄绿
氯气
不褪色
(3)再将上述注射器的针头放在盛水的烧杯中,拉动注射器,使注射器内吸入水,轻
轻振荡注射器,一段时间后观察到注射器内的红色纸条_____。
(4)Cl2可用于制盐酸,其反应的化学方程式为______________。
褪色
Cl2+H2 2HCl
课堂合作探究
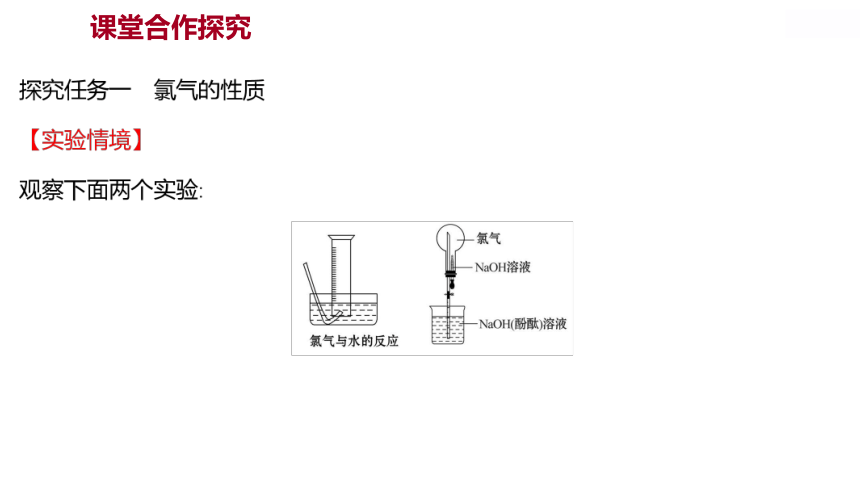
2.实验室制取氯气时,尾气用什么溶液吸收
提示:氢氧化钠溶液。氯气与氢氧化钠溶液反应。
3.氯气是否具有漂白性
提示:氯气不能使干燥的红纸条褪色,所以氯气没有漂白性;氯气能使湿润的红纸条褪色,是因为氯气与水反应生成的次氯酸具有漂白性。
【探究总结】
Cl2的特殊性质
(1)Cl2可使湿润的有色布条褪色,不能使干燥的有色布条褪色,说明Cl2没有漂白性,HClO有漂白作用。
(2)Cl2可使湿润的石蕊试纸先变红后褪色,原因是Cl2与水反应生成的盐酸使石蕊试纸先变红,HClO使变色后的石蕊试纸褪色。
(3)常温下液态氯与铁不反应,故可用钢瓶贮运液氯。
【探究训练】
1.下列有关氯气的叙述中,正确的是 ( )
A.氯气在常温下能与铁反应,故不能用铁罐存放液氯
B.液氯和氯水不是同一物质
C.点燃氢气和氯气的混合气体可以用来制取氯化氢
D.用氯气对生活用水进行消毒的原因是氯气本身能杀灭细菌
【解题指南】解答本题需要注意以下两点:
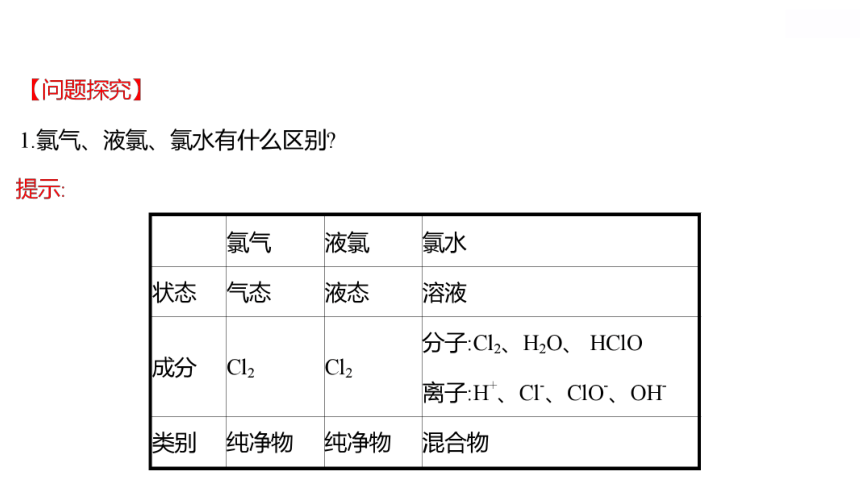
(1)液氯是液态的氯气,属于纯净物。
(2)氯水是混合物。
液氯 新制氯水 久置氯水
分类 纯净物 混合物 混合物
颜色 黄绿色 浅黄绿色 无色
性质 氧化性 酸性、氧化性、
漂白性 酸性
粒子
种类 Cl2 Cl2、HClO、H2O、H+、
Cl-、ClO-、OH- H2O、H+、Cl-、OH-
课堂素养达标
第2课时 研究物质性质的基本程序
课前自主学习
学习任务一 研究物质性质的基本程序
任务驱动:
由于被研究的物质性质往往具有一定的未知性,所以在研究物质性质的过程中,可能需要在“实验和观察”与“预测物质的性质”两个环节之间反复进行。进行实验时,先要对物质性质进行预测,然后去验证预测。
将研究物质性质的重要环节科学组合就形成了研究物质性质的基本程序。科学探究的主要环节有:
学习任务二 研究氯气的性质
任务驱动:
根据研究物质性质的基本程序,推断氯气具有哪些性质。
1.氯气的性质
【想一想】氯气有毒,如何闻氯气的气味
提示:闻氯气气味的方法是用手在瓶口轻轻扇动,使极少量的氯气飘进鼻孔。
2.次氯酸及次氯酸盐
(1)次氯酸
①酸性:属于___酸;酸性:HClO
③强氧化性:杀菌、消毒、_____。
弱
2HClO 2HCl+O2↑
漂白
(2)次氯酸盐
①84消毒液:主要成分是NaClO。
②漂白粉:主要成分是______和________,有效成分是________。
工业上制漂白粉是用Cl2与石灰乳反应,反应的化学方程式为
_____________________________________。
3.氯气的用途:在工业上,氯气是一种重要的化工原料,大量用于制造_____、有机
溶剂和杀菌消毒剂。
CaCl2
Ca(ClO)2
Ca(ClO)2
2Ca(OH)2+2Cl2===CaCl2+Ca(ClO)2+2H2O
盐酸
【做一做】根据氯气的性质,填写下列空白。
(1)用注射器向一盛满氯气的矿泉水瓶中注入少量的水,充分振荡后,观察到矿泉水
瓶_____,矿泉水瓶中的溶液呈_______色,说明氯气能够溶于水,氯水中的主要溶质
是_____分子。
(2)如图所示,把红色纸条放在注射器内,然后将注射器的针头插入盛氯气的矿泉
水中,向外拉动注射器,使注射器内吸入少量氯气,一段时间后观察到注射器内的
红色纸条_______。
变瘪
浅黄绿
氯气
不褪色
(3)再将上述注射器的针头放在盛水的烧杯中,拉动注射器,使注射器内吸入水,轻
轻振荡注射器,一段时间后观察到注射器内的红色纸条_____。
(4)Cl2可用于制盐酸,其反应的化学方程式为______________。
褪色
Cl2+H2 2HCl
课堂合作探究
2.实验室制取氯气时,尾气用什么溶液吸收
提示:氢氧化钠溶液。氯气与氢氧化钠溶液反应。
3.氯气是否具有漂白性
提示:氯气不能使干燥的红纸条褪色,所以氯气没有漂白性;氯气能使湿润的红纸条褪色,是因为氯气与水反应生成的次氯酸具有漂白性。
【探究总结】
Cl2的特殊性质
(1)Cl2可使湿润的有色布条褪色,不能使干燥的有色布条褪色,说明Cl2没有漂白性,HClO有漂白作用。
(2)Cl2可使湿润的石蕊试纸先变红后褪色,原因是Cl2与水反应生成的盐酸使石蕊试纸先变红,HClO使变色后的石蕊试纸褪色。
(3)常温下液态氯与铁不反应,故可用钢瓶贮运液氯。
【探究训练】
1.下列有关氯气的叙述中,正确的是 ( )
A.氯气在常温下能与铁反应,故不能用铁罐存放液氯
B.液氯和氯水不是同一物质
C.点燃氢气和氯气的混合气体可以用来制取氯化氢
D.用氯气对生活用水进行消毒的原因是氯气本身能杀灭细菌
【解题指南】解答本题需要注意以下两点:
(1)液氯是液态的氯气,属于纯净物。
(2)氯水是混合物。
液氯 新制氯水 久置氯水
分类 纯净物 混合物 混合物
颜色 黄绿色 浅黄绿色 无色
性质 氧化性 酸性、氧化性、
漂白性 酸性
粒子
种类 Cl2 Cl2、HClO、H2O、H+、
Cl-、ClO-、OH- H2O、H+、Cl-、OH-
课堂素养达标
