鲁科版 高中化学 必修第一册 第2章 第2节 第2课时 离 子 反 应 课件(45张)
文档属性
| 名称 | 鲁科版 高中化学 必修第一册 第2章 第2节 第2课时 离 子 反 应 课件(45张) |  | |
| 格式 | ppt | ||
| 文件大小 | 4.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-08 18:20:05 | ||
图片预览









文档简介
(共45张PPT)
第2课时 离 子 反 应
课前自主学习
学习任务一 离子反应的含义及发生的条件
任务驱动:
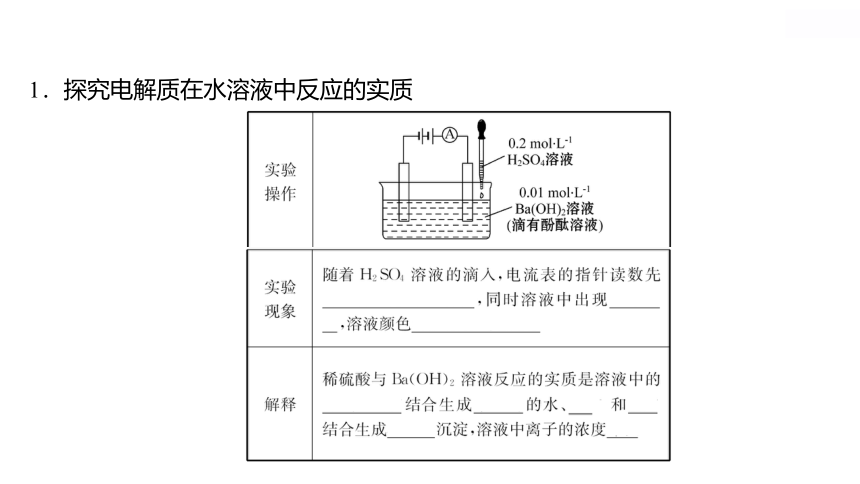
稀硫酸可以导电,氢氧化钡是强电解质,其水溶液也可以导电,两种溶液混合,导电性会如何变化呢?
1.探究电解质在水溶液中反应的实质
2.含义:在溶液中_________________的化学反应。
3.实质:_______________。
4.离子互换型的离子反应发生的条件
(1)_______________。
(2)_________________。
(3)_________________。
有离子参加或生成
离子浓度的降低
生成难溶的物质
生成难电离的物质
生成挥发性的物质
【想一想】离子反应中参加反应的全是离子。这种说法正确吗?
提示:不正确。离子反应指的是在反应中有离子参加或有离子生成的反应,有的离子反应中有气体、沉淀或弱电解质反应,如CO2+2NaOH===Na2CO3+H2O。
学习任务二 离子方程式
任务驱动:
化学反应用化学方程式表示,离子反应可以用离子方程式表示,一个离子
方程式只能表示一个离子反应吗?
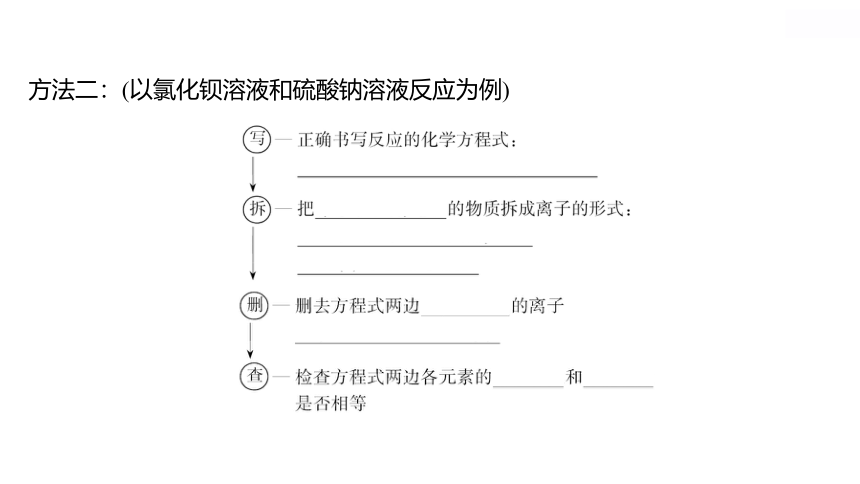
1.定义:用实际参加反应的_________来表示离子反应的式子。
2.书写步骤
方法一:(以稀硫酸与Ba(OH)2溶液反应为例)
①分析反应物在溶液中的存在形式。
如H2SO4、Ba(OH)2在溶液中均以_____形式存在。
离子符号
离子
②判断哪些离子相互作用生成沉淀、水或挥发性物质。
如:__________生成水,___________生成BaSO4沉淀。
③写出离子方程式,并配平。
__________________________________________
H+与OH-
Ba2+与
2H++2OH-+Ba2++ ===2H2O+BaSO4↓
方法二:(以氯化钡溶液和硫酸钠溶液反应为例)
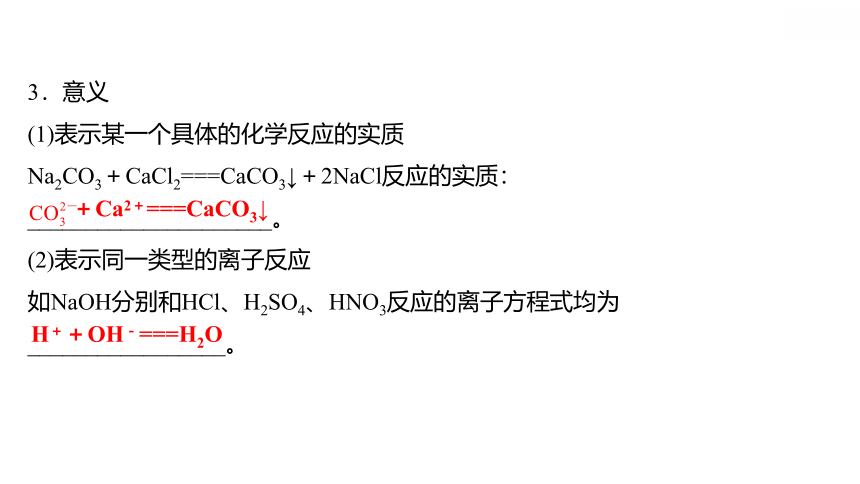
3.意义
(1)表示某一个具体的化学反应的实质
Na2CO3+CaCl2===CaCO3↓+2NaCl反应的实质:
_____________________。
(2)表示同一类型的离子反应
如NaOH分别和HCl、H2SO4、HNO3反应的离子方程式均为
_________________。
+Ca2+===CaCO3↓
H++OH-===H2O
课堂合作探究
√
×
√
×
√
×
√
×
√
×
×
√
课堂素养达标
第2课时 离 子 反 应
课前自主学习
学习任务一 离子反应的含义及发生的条件
任务驱动:
稀硫酸可以导电,氢氧化钡是强电解质,其水溶液也可以导电,两种溶液混合,导电性会如何变化呢?
1.探究电解质在水溶液中反应的实质
2.含义:在溶液中_________________的化学反应。
3.实质:_______________。
4.离子互换型的离子反应发生的条件
(1)_______________。
(2)_________________。
(3)_________________。
有离子参加或生成
离子浓度的降低
生成难溶的物质
生成难电离的物质
生成挥发性的物质
【想一想】离子反应中参加反应的全是离子。这种说法正确吗?
提示:不正确。离子反应指的是在反应中有离子参加或有离子生成的反应,有的离子反应中有气体、沉淀或弱电解质反应,如CO2+2NaOH===Na2CO3+H2O。
学习任务二 离子方程式
任务驱动:
化学反应用化学方程式表示,离子反应可以用离子方程式表示,一个离子
方程式只能表示一个离子反应吗?
1.定义:用实际参加反应的_________来表示离子反应的式子。
2.书写步骤
方法一:(以稀硫酸与Ba(OH)2溶液反应为例)
①分析反应物在溶液中的存在形式。
如H2SO4、Ba(OH)2在溶液中均以_____形式存在。
离子符号
离子
②判断哪些离子相互作用生成沉淀、水或挥发性物质。
如:__________生成水,___________生成BaSO4沉淀。
③写出离子方程式,并配平。
__________________________________________
H+与OH-
Ba2+与
2H++2OH-+Ba2++ ===2H2O+BaSO4↓
方法二:(以氯化钡溶液和硫酸钠溶液反应为例)
3.意义
(1)表示某一个具体的化学反应的实质
Na2CO3+CaCl2===CaCO3↓+2NaCl反应的实质:
_____________________。
(2)表示同一类型的离子反应
如NaOH分别和HCl、H2SO4、HNO3反应的离子方程式均为
_________________。
+Ca2+===CaCO3↓
H++OH-===H2O
课堂合作探究
√
×
√
×
√
×
√
×
√
×
×
√
课堂素养达标
