10.2酸和碱的中和反应第一课时课件—2021-2022学年九年级化学人教版下册(共17张PPT)
文档属性
| 名称 | 10.2酸和碱的中和反应第一课时课件—2021-2022学年九年级化学人教版下册(共17张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-08 22:37:43 | ||
图片预览




文档简介
(共17张PPT)
课题2
酸
和
碱
的
选自人教版初中化学九年级下册
第十单元
中
和
反
应
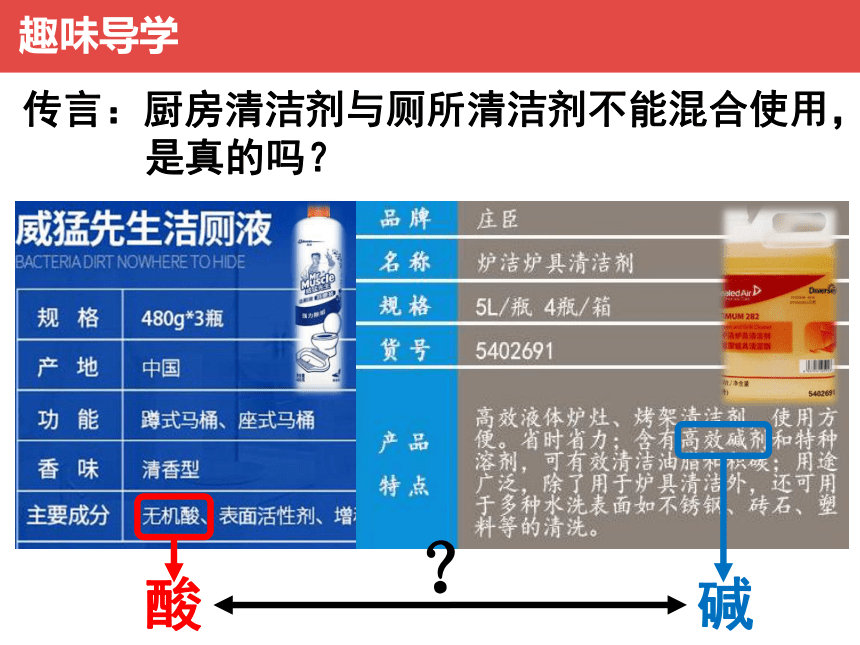
趣味导学
酸
碱
传言:厨房清洁剂与厕所清洁剂不能混合使用,
是真的吗?
?
学习目标
学习目标
01 认识中和反应,能判断某反应是否为中和反应;
02 了解盐的定义;
03 掌握中和反应的实质;
04 了解中和反应正在生产、生活中的应用。
探究一:酸和碱是否能发生反应?
步 骤 现 象
向装有约2mL氢氧化钠溶液的试管中,加入约2mL稀盐酸,振荡并观察现象。
无明显现象
实验一:
没有明显现象是否表示酸和碱没有反应?
思考:
不一定表示酸和碱没有发生反应。
探究一:酸和碱是否能发生反应?
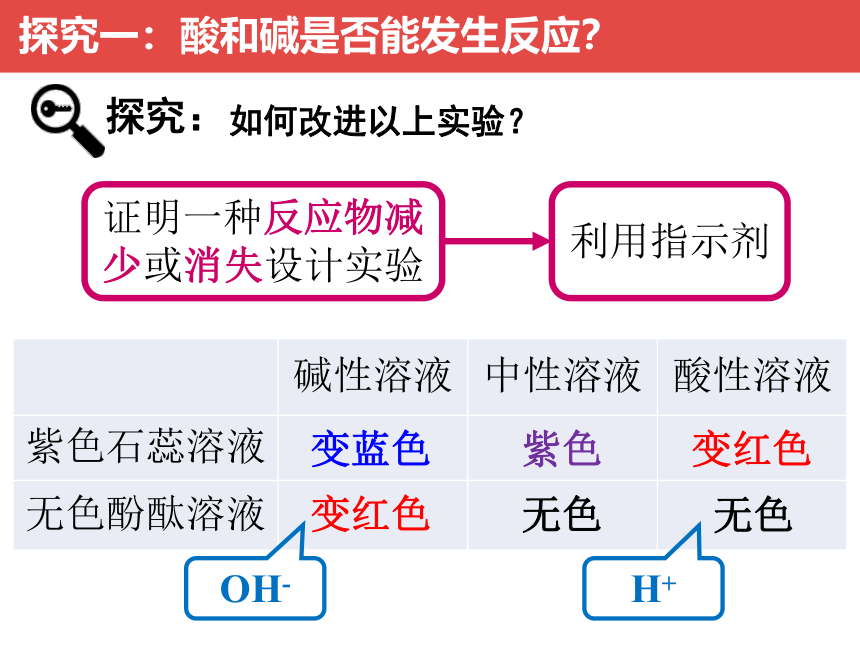
如何改进以上实验?
证明一种反应物减少或消失设计实验
利用指示剂
探究:
碱性溶液 中性溶液 酸性溶液
紫色石蕊溶液
无色酚酞溶液
变红色
变蓝色
无色
紫色
变红色
无色
OH-
H+
探究一:酸和碱是否能发生反应?
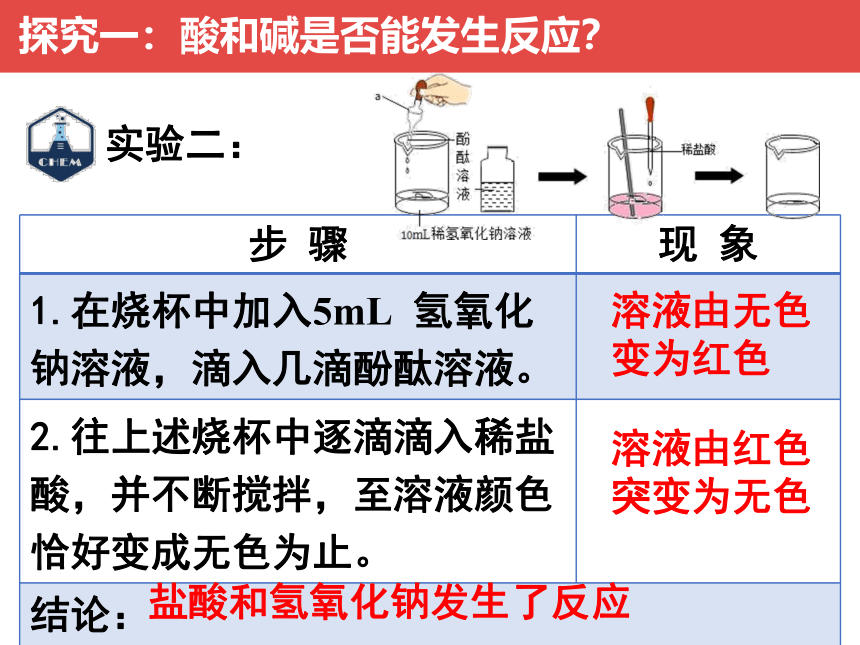
步 骤 现 象
1.在烧杯中加入5mL 氢氧化钠溶液,滴入几滴酚酞溶液。
2.往上述烧杯中逐滴滴入稀盐酸,并不断搅拌,至溶液颜色恰好变成无色为止。
结论:
溶液由无色变为红色
实验二:
溶液由红色突变为无色
盐酸和氢氧化钠发生了反应
能力提升
思考:
1.酚酞溶液在实验中的作用是什么?
2.用滴管滴入盐酸时要缓慢,一滴一滴加入,还要边滴边搅拌,为什么?
防止稀盐酸过量,使稀盐酸与氢氧化钠溶液充分反应
起指示作用。根据酚酞溶液由红色变为无色来判断NaOH和HCl是否反应完全。
能力提升
思考:
3.能否把无色酚酞换成紫色石蕊?
哪个效果更好?
可以,NaOH溶液中滴加石蕊变蓝色,
再加入盐酸,恰好由蓝色变为紫色时,
即恰好完全反应;
用酚酞溶液效果更好,红色变无色更明显。
能力提升
思考:
4.能否把酸和碱的先后顺序调换?
不可以,因为盐酸中滴加酚酞时不变色,滴加氢氧化钠溶液溶液变红色时,氢氧化钠溶液已经过量,不能指示出恰好完全反应的时刻。
①酸入碱;②滴酸之前加酚酞
酸和碱反应的实验操作顺序:
探究二:酸和碱如何发生反应?
酸和碱是如何发生反应的?反应前后溶液中的离子发生了怎样的变化
探究:
反应前 反应后 变化的微粒
物质 /
微粒
H+ Cl-
Na+ OH-
Na+ Cl-
H2O
NaOH
HCl
NaCl
H2O
酸和碱反应的实质:
H+ + OH = H2O
H+ OH-
1 : 1 : 1
H2O
探究三:酸和碱发生什么类型的化学反应?
探究:
其它的酸和碱也能发生类似的反应,从物质组成上看,以下反应有什么共同特点?
+ = +
酸
碱
水
盐
HCl + NaOH = Na Cl + H2O
2HCl + Ca(OH)2 = Ca Cl2 + 2H2O
H2SO4 + 2NaOH = Na2SO4 + 2H2O
盐:
由金属离子和酸根离子构成的化合物
中和反应:
酸与碱作用生成盐和水的反应
探究三:酸和碱发生什么类型的化学反应?
练一练:
下列反应中属于中和反应的是( )
A .NaHCO3 + HCl ═ NaCl + H2O + CO2↑
B.SO2 + 2NaOH ═ Na2SO3 + H2O
C. Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
D.Fe + CuSO4 ═ Cu + FeSO4
C
探究三:酸和碱发生什么类型的化学反应?
思考:
中和反应生成盐和水,所以生成盐和水的反应都是中和反应,这句话对吗?
不对。因为能生成盐和水的反应有3种:
①酸+金属氧化物=盐+水,
2HCl+CuO=CuCl2+H2O
②碱+非金属氧化物=盐+水,
NaOH+CO2=Na2CO3+H2O
③酸+碱=盐+水,
HCl+NaOH=NaCl+H2O
探究三:酸和碱发生什么类型的化学反应?
探究:
请同学们根据酸碱中和反应的通式,写出下列反应的化学方程式
(1)向澄清石灰水中加入适量盐酸
(2)向氢氧化铝中加入适量稀硫酸
2HCl+Ca(OH)2 = CaCl2+2H2O
3H2SO4+2Al(OH)3 = Al2(SO4)3 +6H2O
找H+和OH-的最小公倍数
探究四:酸碱中和反应的实际应用
15
1、改变土壤的酸碱性
根据土壤的情况,可以利用中和反应,在土壤中加入酸性或者碱性物质,以调节土壤的酸碱性利于植物生长。
阅读教材P61,归纳中和反应生活中的实际应用
中性土壤
如:酸性土壤
熟石灰
Ca(OH)2
H2SO4+Ca(OH)2=CaSO4+2H2O
探究四:酸碱中和反应的实际应用
16
2、处理工厂的废水
⑴酸性废水加碱性物质
硫酸厂的污水中含有硫酸等杂质,可以用熟石灰进行中和处理。(熟石灰价格便宜,处理污水成本低)
⑵碱性废水加酸性物质:造纸厂处理污水
3、用于医药
治疗胃酸过多
胃药胶囊的主要成分氢氧化铝
胃酸的主要成分是盐酸
Al(OH)3 + 3HCl = AlCl3 + 3H2O
课堂总结
酸 + 碱 → 盐 + 水
酸与碱作用生成盐和水的反应。
H+ + OH- = H2O
改良酸性土壤;处理酸性废水;治疗胃酸。
二、盐:
由金属离子和酸根离子构成的化合物。
1.中和反应:
2.通式:
3.实质:
4.应用:
一、中和反应
课题2
酸
和
碱
的
选自人教版初中化学九年级下册
第十单元
中
和
反
应
趣味导学
酸
碱
传言:厨房清洁剂与厕所清洁剂不能混合使用,
是真的吗?
?
学习目标
学习目标
01 认识中和反应,能判断某反应是否为中和反应;
02 了解盐的定义;
03 掌握中和反应的实质;
04 了解中和反应正在生产、生活中的应用。
探究一:酸和碱是否能发生反应?
步 骤 现 象
向装有约2mL氢氧化钠溶液的试管中,加入约2mL稀盐酸,振荡并观察现象。
无明显现象
实验一:
没有明显现象是否表示酸和碱没有反应?
思考:
不一定表示酸和碱没有发生反应。
探究一:酸和碱是否能发生反应?
如何改进以上实验?
证明一种反应物减少或消失设计实验
利用指示剂
探究:
碱性溶液 中性溶液 酸性溶液
紫色石蕊溶液
无色酚酞溶液
变红色
变蓝色
无色
紫色
变红色
无色
OH-
H+
探究一:酸和碱是否能发生反应?
步 骤 现 象
1.在烧杯中加入5mL 氢氧化钠溶液,滴入几滴酚酞溶液。
2.往上述烧杯中逐滴滴入稀盐酸,并不断搅拌,至溶液颜色恰好变成无色为止。
结论:
溶液由无色变为红色
实验二:
溶液由红色突变为无色
盐酸和氢氧化钠发生了反应
能力提升
思考:
1.酚酞溶液在实验中的作用是什么?
2.用滴管滴入盐酸时要缓慢,一滴一滴加入,还要边滴边搅拌,为什么?
防止稀盐酸过量,使稀盐酸与氢氧化钠溶液充分反应
起指示作用。根据酚酞溶液由红色变为无色来判断NaOH和HCl是否反应完全。
能力提升
思考:
3.能否把无色酚酞换成紫色石蕊?
哪个效果更好?
可以,NaOH溶液中滴加石蕊变蓝色,
再加入盐酸,恰好由蓝色变为紫色时,
即恰好完全反应;
用酚酞溶液效果更好,红色变无色更明显。
能力提升
思考:
4.能否把酸和碱的先后顺序调换?
不可以,因为盐酸中滴加酚酞时不变色,滴加氢氧化钠溶液溶液变红色时,氢氧化钠溶液已经过量,不能指示出恰好完全反应的时刻。
①酸入碱;②滴酸之前加酚酞
酸和碱反应的实验操作顺序:
探究二:酸和碱如何发生反应?
酸和碱是如何发生反应的?反应前后溶液中的离子发生了怎样的变化
探究:
反应前 反应后 变化的微粒
物质 /
微粒
H+ Cl-
Na+ OH-
Na+ Cl-
H2O
NaOH
HCl
NaCl
H2O
酸和碱反应的实质:
H+ + OH = H2O
H+ OH-
1 : 1 : 1
H2O
探究三:酸和碱发生什么类型的化学反应?
探究:
其它的酸和碱也能发生类似的反应,从物质组成上看,以下反应有什么共同特点?
+ = +
酸
碱
水
盐
HCl + NaOH = Na Cl + H2O
2HCl + Ca(OH)2 = Ca Cl2 + 2H2O
H2SO4 + 2NaOH = Na2SO4 + 2H2O
盐:
由金属离子和酸根离子构成的化合物
中和反应:
酸与碱作用生成盐和水的反应
探究三:酸和碱发生什么类型的化学反应?
练一练:
下列反应中属于中和反应的是( )
A .NaHCO3 + HCl ═ NaCl + H2O + CO2↑
B.SO2 + 2NaOH ═ Na2SO3 + H2O
C. Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
D.Fe + CuSO4 ═ Cu + FeSO4
C
探究三:酸和碱发生什么类型的化学反应?
思考:
中和反应生成盐和水,所以生成盐和水的反应都是中和反应,这句话对吗?
不对。因为能生成盐和水的反应有3种:
①酸+金属氧化物=盐+水,
2HCl+CuO=CuCl2+H2O
②碱+非金属氧化物=盐+水,
NaOH+CO2=Na2CO3+H2O
③酸+碱=盐+水,
HCl+NaOH=NaCl+H2O
探究三:酸和碱发生什么类型的化学反应?
探究:
请同学们根据酸碱中和反应的通式,写出下列反应的化学方程式
(1)向澄清石灰水中加入适量盐酸
(2)向氢氧化铝中加入适量稀硫酸
2HCl+Ca(OH)2 = CaCl2+2H2O
3H2SO4+2Al(OH)3 = Al2(SO4)3 +6H2O
找H+和OH-的最小公倍数
探究四:酸碱中和反应的实际应用
15
1、改变土壤的酸碱性
根据土壤的情况,可以利用中和反应,在土壤中加入酸性或者碱性物质,以调节土壤的酸碱性利于植物生长。
阅读教材P61,归纳中和反应生活中的实际应用
中性土壤
如:酸性土壤
熟石灰
Ca(OH)2
H2SO4+Ca(OH)2=CaSO4+2H2O
探究四:酸碱中和反应的实际应用
16
2、处理工厂的废水
⑴酸性废水加碱性物质
硫酸厂的污水中含有硫酸等杂质,可以用熟石灰进行中和处理。(熟石灰价格便宜,处理污水成本低)
⑵碱性废水加酸性物质:造纸厂处理污水
3、用于医药
治疗胃酸过多
胃药胶囊的主要成分氢氧化铝
胃酸的主要成分是盐酸
Al(OH)3 + 3HCl = AlCl3 + 3H2O
课堂总结
酸 + 碱 → 盐 + 水
酸与碱作用生成盐和水的反应。
H+ + OH- = H2O
改良酸性土壤;处理酸性废水;治疗胃酸。
二、盐:
由金属离子和酸根离子构成的化合物。
1.中和反应:
2.通式:
3.实质:
4.应用:
一、中和反应
同课章节目录
